食管鳞癌组织中GRIM-19的表达及意义
王建君,孙淼淼,张红新,陈奎生
(1.郑州大学第一附属医院病理科、河南省肿瘤病理重点实验室,河南 郑州 450052;2.郑州人民医院病理科,河南 郑州 450000;3.河南省肿瘤医院病理科,河南 郑州 450008)
食管鳞癌组织中GRIM-19的表达及意义
王建君1,2,孙淼淼3,张红新1,陈奎生1
(1.郑州大学第一附属医院病理科、河南省肿瘤病理重点实验室,河南 郑州 450052;2.郑州人民医院病理科,河南 郑州 450000;3.河南省肿瘤医院病理科,河南 郑州 450008)
目的探讨干扰素/维甲酸联合应用诱导细胞凋亡相关基因(GRIM-19)在食管鳞癌组织中的表达及意义。方法采用免疫组化S-P法检测50例食管鳞癌组织、50例正常食管黏膜组织、30例癌旁不典型增生组织中GRIM-19蛋白表达;应用原位杂交法检测50例食管鳞癌组织、50例正常的食管黏膜组织、30例癌旁不典型增生的组织中GRIM-19 mRNA的表达。结果GRIM-19蛋白、mRNA在食管鳞癌组织中阳性表达率明显低于癌旁不典型增生组织以及正常的食管黏膜组织,三者比较差异均有统计学意义(P均<0.05)。GRIM-19蛋白、mRNA的阳性表达率与肿瘤浸润深度、淋巴结转移均有关(P均<0.05),而与患者的性别、年龄均无关(P均>0.05)。结论GRIM-19表达与食管鳞癌发生、发展有关,其表达的降低可能促进食管鳞癌的发生、发展。
食管鳞癌;干扰素/维甲酸联合应用诱导细胞凋亡相关基因;免疫组化;原位杂交
[Abstract]ObjectiveTo investigate the expressions and clinical significances of gene associated with retinoid-interferon-induced mortality 19(GRIM-19) protein and mRNA in the esophageal squamous cell carcinoma tissues.MethodsThe expressions of GRIM-19 protein and mRNA in the 50 cases of esophageal squamous cell carcinoma tissues,50 cases of normal esophageal mucosa tissues and 30 cases of adjacent atypical hyperplasia tissues were de-tected by immunohistochemistry and in situ hybridization methods.ResultsThe expression of GRIM-19 protein and mRNA in the esophageal squamous carcinoma tissues were significantly lower than those of the atypical hyperplasia tissue adjacent to carcinoma and the normal esophageal mucosa(P<0.05).The GRIM-19 protein and mRNA positive expression rates were associated with tumor infiltration depth and lymph node metastasis(P<0.05),and had nothing to do with the age and gender(P>0.05).ConclusionThe GRIM-19 lower expression may be related to the occurrence and development of esophageal squamous carcinoma.
[Key words]esophageal squamous cell carcinoma; gene associated with retinoid-interferon-induced mortality 19; immunohistochemistry; in situ hybridization
干扰素/维甲酸联合应用诱导细胞凋亡相关基因19(gene associated with retinoid-interferon-induced mortality 19,GRIM-19)是NADH脱氢酶I的亚单位,在线粒体的呼吸过程中发挥着重要作用[1],其在正常组织中表达,但在肿瘤组织中却呈现出不同程度的异常表达。研究[2-3]表明,GRIM-19是一种新的与肿瘤发生、发展、凋亡等有关的基因。有关GRIM-19表达与食管癌发生、发展的关系研究尚未见文献报道,本研究采用免疫组化S-P法检测50例食管鳞癌组织、50例正常食管黏膜组织、30例癌旁不典型增生组织中GRIM-19蛋白的表达,应用原位杂交法检测50例食管鳞癌组织、50例正常食管黏膜组织、30例癌旁不典型增生组织中GRIM-19 mRNA的表达,探讨GRIM-19表达与食管癌发生、发展的关系。
1 材料与方法
1.1材料50例食管鳞癌标本选取河南省肿瘤医院病理科2013年1月至2013年12月手术切除的标本,所有被选择的患者术前均未接受过放疗、化疗及其他相关治疗,临床资料完整,并由两名以上经验丰富的病理科医生诊断证实为食管鳞癌。每例标本分别取癌组织、癌旁组织以及正常食管黏膜组织(手术切缘/距癌组织边缘4 cm以外的组织)。所取标本均经质量分数4%多聚甲醛固定,经常规脱水,采用石蜡包埋,进行连续切片,备用。50例食管鳞癌标本中,男26例,女24例;年龄34~79岁,中位年龄61岁,年龄≥60岁者30例,<60岁者20例;临床分期根据2009年第7版国际抗癌联盟食管癌的TNM分期标准进行评定,浸润到黏膜下层或浅肌层者10例,浸润到深肌层者12例,浸润至全层或外膜者28例;伴有淋巴结转移者25例,无淋巴结转移者25例。
1.2主要试剂GRIM-19鼠抗人多克隆抗体购自美国Santa Cruz公司;5’端生物素标记GRIM-19探针(5’-GCGTCGAGGACTGTCGGG-3’)由上海生物工程有限公司设计并合成;S-P免疫组化通用试剂盒、SA-AP显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3免疫组化步骤染色步骤按照免疫组化S-P法试剂盒说明进行,高压抗原修复,DAB显色,苏木素复染。采用已知阳性表达的组织切片作阳性对照;用0.01 mol·L-1PBS代替一抗作阴性对照。
1.4免疫组化结果判断GRIM-19阳性产物定位于细胞浆,阳性染色为黄色或棕黄色。GRIM-19阳性表达标准,根据组织中阳性细胞所占的百分比以及阳性细胞的染色深度来进行综合的评分。阳性细胞百分比评分:随机选取10个视野,分别计数100个细胞。以阳性细胞比例≤10%为0分,>10%~25%为1分,>25%~50%为2分,>50%~100%为3分。阳性细胞的染色深度评分:阳性细胞无色为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分。2项评分的乘积作为该标本的积分,≤2分为阴性,>2分为阳性。
1.5原位杂交步骤组织经新鲜配制二甲苯脱蜡,梯度酒精脱水后,用新鲜配制的体积分数3% H2O2灭活内源性过氧化物酶;质量分数3%柠檬酸新鲜配制蛋白酶消化标本DNA结合蛋白;滴加不含探针的预杂交液(42 ℃),预杂交4 h;滴加含探针的杂交液,42 ℃湿盒内杂交12 h;滴加SA-AP 37 ℃,30 min,BCIP/NBT,避光显色2~4 h。用已知GRIM-19 mRNA阳性表达的组织切片作为阳性对照,用不含探针的预杂交液孵育标本作为阴性对照。
1.6原位杂交结果判断GRIM-19 mRNA阳性表达均主要存在于细胞浆中,呈蓝紫色颗粒。GRIM-19 mRNA表达的结果判定:根据阳性细胞在组织中所占百分比以及染色的深度来综合评分。阳性细胞百分比评分:阳性细胞百分率为随机选取10个视野,计数100个细胞,≤10%阳性细胞记为0分,11%~25%为1分,>25%~50%为2分,>50%为3分。阳性细胞染色深度评分:无色为0分,淡紫蓝色为1分,紫蓝色为2分,深紫蓝色为3分。以2项评分的乘积作为该标本的积分,≤2分为阴性,>2分为阳性。
1.7统计学处理采用SPSS 17.0处理实验数据,率的比较采用χ2检验;等级资料的相关性分析采用Spearman等级相关分析,检验水准α=0.05。
2 结果
2.1GRIM-19蛋白在不同食管组织中的表达GRIM-19蛋白在食管鳞癌组织中的阳性表达率为20.00%(10/50),癌旁不典型增生组织为76.67%(23/30),正常食管黏膜组织为84.00%(42/50),差异有统计学意义(χ2=12.13,P<0.05)。见图1、表1。

图1 GRIM-19蛋白在不同食管组织中的表达(S-P,×100)
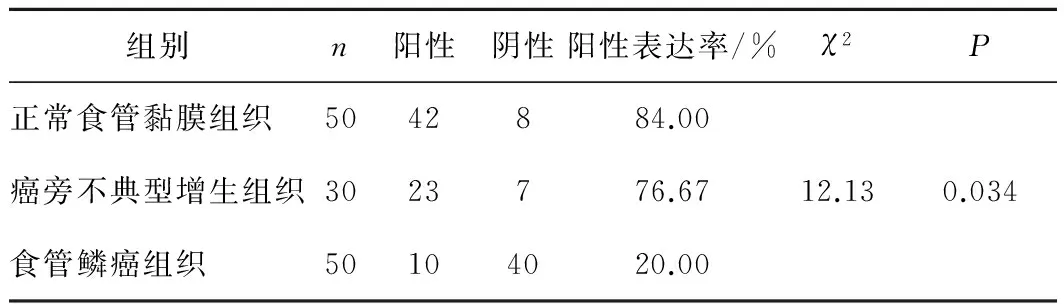
组别n阳性阴性阳性表达率/%χ2P正常食管黏膜组织5042884.00癌旁不典型增生组织3023776.6712.130.034食管鳞癌组织50104020.00
2.2GRIM-19蛋白的表达与食管鳞癌患者临床病理参数的关系GRIM-19蛋白的阳性表达率与食管鳞癌浸润深度、淋巴结转移均有关(P均<0.05),而与患者的年龄、性别均无关(P均>0.05)。见表2。
2.3GRIM-19 mRNA在不同食管组织中的表达GRIM-19 mRNA在食管鳞癌组织中的阳性表达率为24.00%(12/50),癌旁不典型增生组织为76.67%(23/30),正常食管黏膜组织为88.00%(44/50),差异有统计学意义(χ2=11.83,P<0.05)。见表图2、表3。
2.4GRIM-19 mRNA的表达与食管鳞癌患者临床病理参数的关系GRIM-19 mRNA的阳性表达率与食管鳞癌浸润深度、淋巴结转移均有关(P均<0.05),而与患者年龄、性别均无关(P均>0.05)。见表4。
表2GRIM-19蛋白的表达与食管鳞癌患者临床病理参数的关系
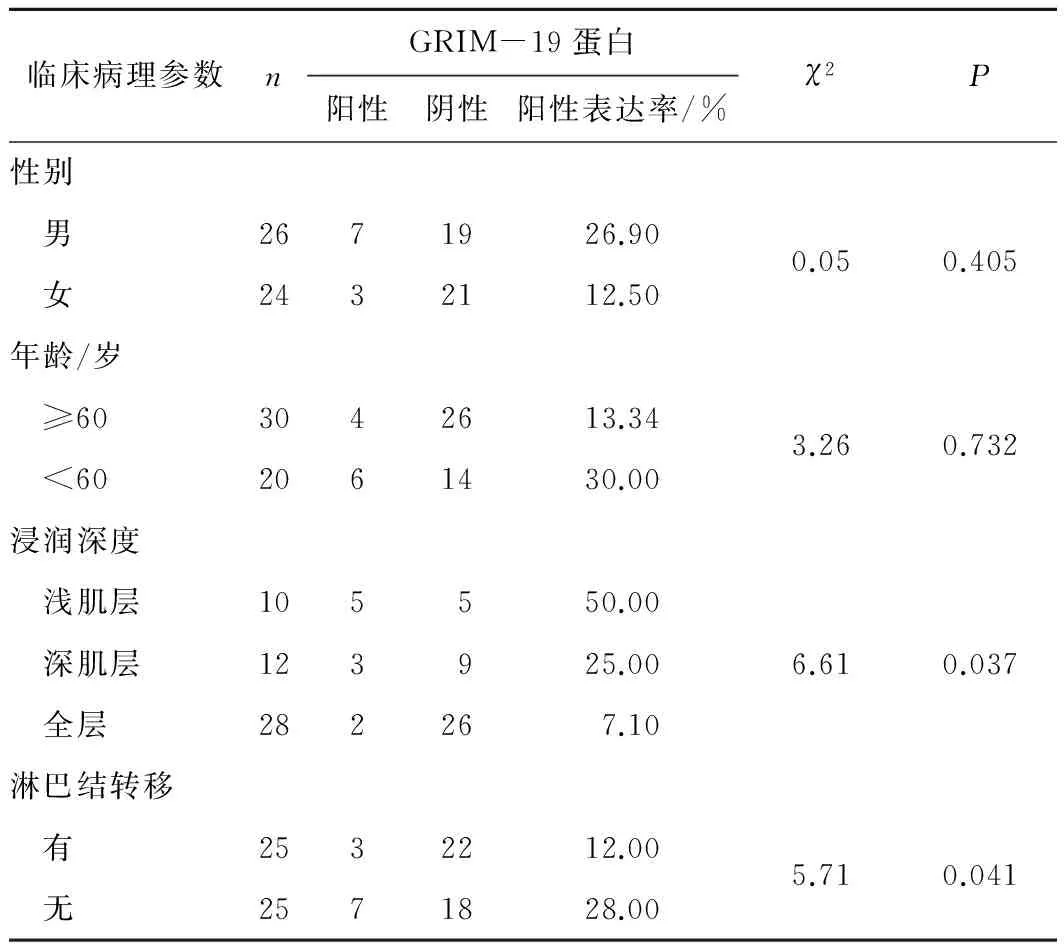
临床病理参数nGRIM-19蛋白阳性阴性阳性表达率/%χ2P性别 男2671926.900.050.405 女2432112.50年龄/岁 ≥603042613.343.260.732 <602061430.00浸润深度 浅肌层105550.00 深肌层123925.006.610.037 全层282267.10淋巴结转移 有2532212.005.710.041 无2571828.00
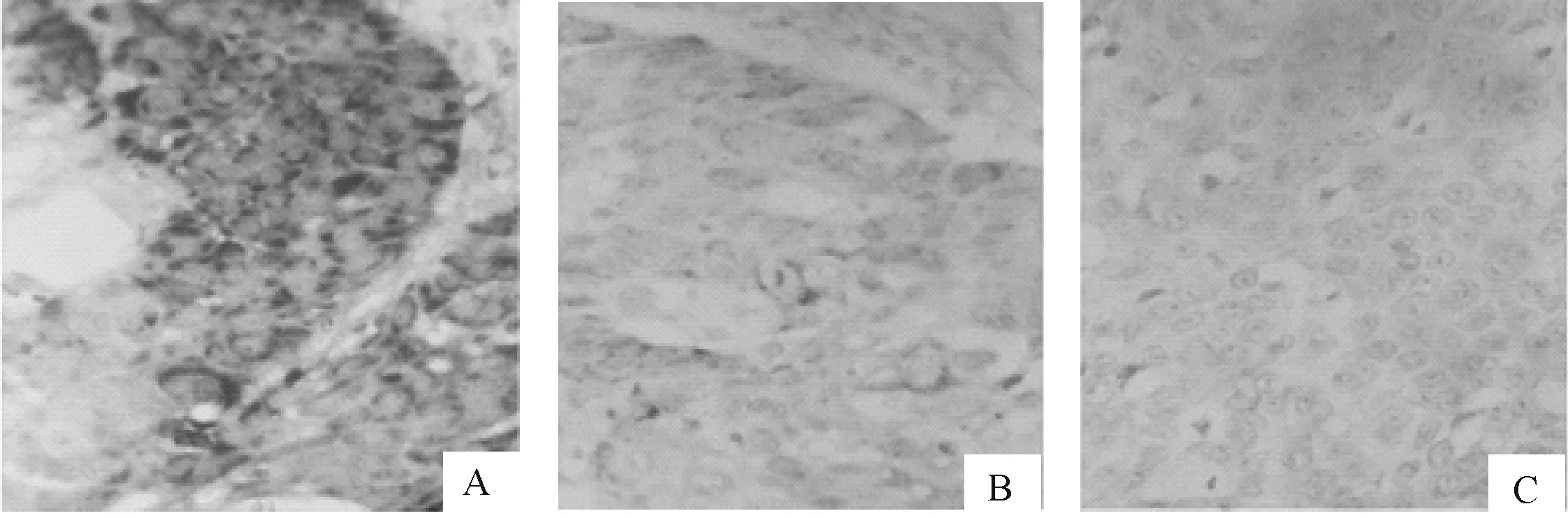
图2 GRIM-19 mRNA在不同食管组织中的表达(ISH,×200)
A:正常食管黏膜组织;B:癌旁不典型增生组织;C:食管鳞癌组织
表3GRIM-19 mRNA在不同食管组织中的表达

组别n阳性阴性阳性表达率/%χ2P正常食管黏膜组织5044688.00癌旁不典型增生组织3023776.6711.830.038食管鳞癌组织50123824.00
3 讨论
GRIM-19定位于第19号染色体,主要在线粒体内膜表达[4]。在多种正常组织(如心肌、肺脏、胸腺、骨骼肌、结肠)中均能检测到GRIM-19表达[5],通常是病毒癌基因结合的靶点。
研究[6-8]发现,GRIM-19基因的突变、蛋白表达降低或缺失发生在泌尿系统肿瘤、消化系统肿瘤等多种肿瘤组织中,与肿瘤的发生、发展密切相关,并有可能成为基因治疗的一个潜在靶点。另有研究[9]表明,GRIM-19在正常宫颈组织中高表达,在宫颈癌组织中的表达降低,其表达降低可能与肿瘤的发生、发展有着密切的关系。研究[10-11]表明,GRIM-19表达可以抑制宫颈癌细胞的侵袭、促进细胞凋亡,可能是宫颈癌治疗的新靶点,此外,在一些体内实验中,上调GRIM-19的表达可抑制肿瘤的生长和发展。下调GRIM-19的表达可促进肾肿瘤的生长和发育。但有关GRIM-19表达与食管癌发生、发展的关系研究尚未见文献报道。
表4GRIM-19 mRNA的表达与食管鳞癌患者临床病理参数的关系
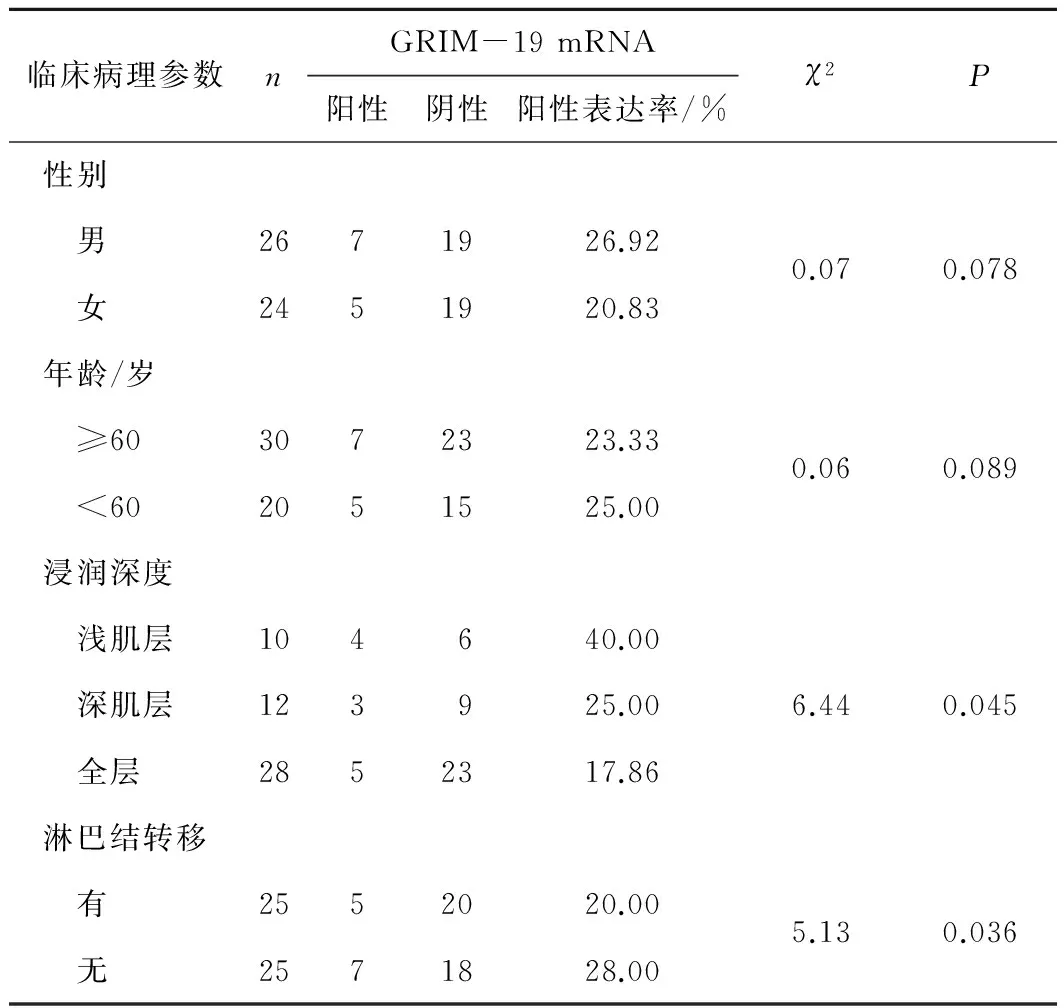
临床病理参数nGRIM-19mRNA阳性阴性阳性表达率/%χ2P性别 男2671926.920.070.078 女2451920.83年龄/岁 ≥603072323.330.060.089 <602051525.00浸润深度 浅肌层104640.00 深肌层123925.006.440.045 全层2852317.86淋巴结转移 有2552020.005.130.036 无2571828.00
本研究结果显示,GRIM-19蛋白、mRNA在食管鳞癌组织中阳性表达率明显低于癌旁不典型增生组织、正常食管黏膜组织(P<0.05)。GRIM-19蛋白、mRNA的阳性表达率与肿瘤浸润深度、淋巴结转移均有关(P均<0.05),而与患者的性别、年龄均无关(P均>0.05)。总之,GRIM-19低表达可能与食管鳞癌发生、发展有关,该研究结果为进一步探讨食管癌发生、发展机制提供了理论依据。
[1]Fitzgibbons PL,Page DL,Weaver D,et al.Prognostic factors in breast cancer.College of American Pathologists Consensus Statement 1999[J].Arch Pathol Lab Med,2000,124(7):966-978.
[2]Nallar SC,Kalakonda S,Sun P,et al.Identification of a structural motif in the tumor-suppressive protein GRIM-19 required for its antitumor activity[J].Am J Pathol,2010,177(2):896-907.
[3]Yeo WM,Isegawa Y,Chow VT.The U95 protein of human herpesvirus 6B interacts with human GRIM-19:silencing of U95 expression reduces viral load and abrogates loss of mitochondrial membrane potential[J].J Virol,2008,82(2):1011-1020.
[4]Zhang L,Gao L,Li Y,et al.Effects of plasmid-based Stat3-specific short hairpin RNA and GRIM-19 on PC-3M tumor cell growth[J].Clin Cancer Res,2008,14(2):559-568.
[5]Proietti C,Salatino M,Rosemblit C,et al.Progestins induce transcriptional activation of signal transducer and activator of transcription 3(Stat3) via a Jak- and Src-dependent mechanism in breast cancer cells[J].Mol Cell Biol,2005,25(12):4826-4840.
[6]周颖,凌斌.GRIM-19的功能及与肿瘤的相关性[J].医学分子生物学杂志,2008,5(3):262.
[7]沈国华,蔡华伟,赵祯.GRIM-19 及其相关蛋白促凋亡机制的研究进展[J].医学研究生学报,2015,28(3):303-307.
[8]龚龙波,胡俊波.GRIM-19及其靶基因产物STAT3与结直肠癌恶性程度的关系[J].癌症,2007,26(7):683-687.
[9]朱靖,卫莹,周颖.宫颈鳞组织中GRIM-19蛋白的表达及其临床意义[J].临床与实验病理学杂志,2010,26(6):681-683.
[10]程勇,周颖,卫莹.GRIM-19 的表达对人子宫颈癌细胞移植瘤细胞侵袭、凋亡的影响研究[J].中国实验诊断学,2010,14(5):733-735.
[11]Cohen HT,McGovern FJ.Renal-cell carcinoma[J].N Engl J Med,2005,353(23):2477-2490.
Expression and Signficance of GRIM-19 in the Esophageal Squamous Carcinoma Tissues
Wang Jianjun1,2,Sun Miaomiao3,Zhang Hongxin1,Chen Kuisheng1
(1.DepartmentofPathology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052,China;2.DepartmentofPathology,thePeople'sHospitalofZhengzhou,Zhengzhou450000,China;3.DepartmentofPathology,HenanTumorHospital,Zhengzhou450008,China)
河南省基础与前沿技术研究计划项目(编号:142300410076)
王建君(1984-),女,硕士,医师,主要从事肿瘤病理学研究。E-mail:173939918@ qq.com
陈奎生(1964-),男,博士,教授,主要从事肿瘤病理学研究。E-mail:chenksh2002@163.com
10.3969/j.issn.1673-5412.2016.04.004
R735.1;R730.23
A
1673-5412(2016)04-0290-04
2016-01-13)

