抗球虫新药AC4在SD大鼠体内的药代动力学研究
王春梅,林 析,张可煜,张丽芳,田玉柱,费陈忠,张晓晓,赵 娟,肖 遂,王霄旸,王 米,郑文丽,薛飞群
(1.中国农业科学院上海兽医研究所,上海200241;2. 齐鲁动物保健品有限公司,济南 250100)
·研究论文·
抗球虫新药AC4在SD大鼠体内的药代动力学研究
王春梅1,林 析1,张可煜1,张丽芳1,田玉柱2,费陈忠1,张晓晓1,赵 娟1,肖 遂1,王霄旸1,王 米1,郑文丽1,薛飞群1
(1.中国农业科学院上海兽医研究所,上海200241;2. 齐鲁动物保健品有限公司,济南 250100)
本研究的目的是建立检测SD大鼠血浆内AC4的分析方法,考察高、中、低3个剂量的AC4在SD大鼠体内的药代动力学特征,获得主要的药代动力学参数。采用超高液相色谱法检测SD大鼠血浆内AC4含量,使用乙酸乙酯作为提取溶剂,妥曲珠利亚砜作为内标。研究表明,建立的方法专属性良好,标准曲线定量范围0.08~80 μg/mL,线性关系良好;准确度和精密度均能达到检测目的,样品在室温放置8 h或者反复冻融3次后稳定;该方法灵敏、准确,可以用于检测SD大鼠血浆内AC4含量。药时曲线下面积和最大血药浓度存在剂量正相关关系,给药后4~5 h达到最大血药浓度,生物消除半衰期在不同性别、不同剂量组之间存在较大差异,AC4在SD大鼠的药动学存在较为明显的性别差异。本研究结果为AC4后期研究和临床合理应用提供了参考依据。关键词:AC4;SD大鼠;UPLC-UV;药代动力学
鸡球虫病对养禽业危害严重,人们一直在寻求新型、高效、低毒的药物对鸡球虫病进行防治。AC4是由中国农业科学院上海兽研究医所在地克珠利的结构基础上合成并筛选出的一种新型三嗪类抗球虫化合物。早期研究证实其使用剂量低,抗球虫活性高,抗虫谱广,具有成为新型抗球虫药物的潜力[1]。最近研究显示,AC4剂量为3 mg/kg·BW时,只观察到少量卵囊和轻微病变,与对照组相比,AC4有显著的增重作用;3 mg/kg·BW组球虫活性与1 mg/kg·BW组地克珠利相同或更优;AC4与地克珠利或妥曲珠利间没有交叉耐药性[2]。可见,AC4抗球虫效果优秀,具备广阔的开发前景。
药代动力学研究在新药研发中占有重要地位,是药物有效性和安全性研究的重要组成部分[3]。本研究拟建立可快速准确检测SD大鼠血浆内AC4的UPLC-UV方法,对高、中、低3个剂量的AC4在SD大鼠体内的药代动力学进行研究,获得主要的药代动力学参数,为AC4后续研究提供理论参考。
1 材料和方法
1.1仪器与试药 超高效液相色谱仪串联紫外检测器(ACQUITYTMUPLC system)购自Waters公司;涡旋仪(G560E)购自Scientific Industries;数控超声波清洗器(KQ-500DE型)购自昆山超声仪器有限公司;高速离心机(CT15RE)购自Hitachi Koki Co,Ltd;冰箱(BCD-209S/EA)购自海信容声冰箱有限公司;氮吹仪(N-Evap nitrogen evaporator)购自美国柏林公司;纯水机(Direct-Pure Plus Water System)购自Rephile Bioscience,Ltd;电子天平(AE240,Mettler-Toledo);微孔滤膜(SCAA-104)购自上海安谱科学仪器有限公司;AC4(纯度98%)由中国农业科学院上海兽研究医所兽用抗感染药物创新团队研制,批号:20140301;妥曲珠利亚砜(纯度99.4%±0.2%)购自WTTEGA Laboratorien;乙腈、甲醇(HPLC级)购自Fisher;肝素钠(效价≥130)、乙酸乙酯(分析纯)、PEG200(化学纯)均购自国药集团化学试剂有限公司。
1.2实验动物 6周龄笼养SD大鼠168只,雌雄各半,体重180~220 g,购自上海斯莱克实验动物有限责任公司,雌雄SD大鼠分开饲养,饲料保证不含任何药物,饮水充足。
1.3给药和样品采集 精确称定AC4和PEG200,配制成1、2、10 mg/g AC4的PEG200溶液,分别作为低、中、高剂量。将84只雄鼠随机分成3组,与低、中、高剂量相互对应,灌服给药前精确称取对应组AC4药液,使给药剂量为1 mg/kg·BW (低剂量组)、2 mg/kg·BW (中剂量组)、10 mg/kg·BW(高剂量组),给药前12 h断料,饮水正常。雌鼠给药方式同雄鼠。
根据预试验结果,采血点设置为0.5、1.5、3、4、5、8、12、24、36、48、72、96、120 h,采血方式为眼眶采血,采血量0.3~0.5 mL。由于采血点较密集,使用眼眶采血频率太高会使大鼠眼部来不及修复,造成角膜炎、失明等多种问题,因此,本研究采取每组大鼠交替采血的方式,每个时间点包含7只大鼠的数据。在预定时间点采集血液样品,放至含有肝素钠的离心管中,500×g离心10 min,取上层血浆,-20℃保存待测。
1.4溶液配制
1.4.1AC4标准溶液配制 精确称取50 mg AC4原料药至25 mL容量瓶,加入约10 mL甲醇后,超声使其完全溶解,待恢复至室温时用甲醇定容,摇匀,配制成2000 μg/mL的贮备液。准确移取AC4贮备液,用甲醇稀释成0.4、0.8、2、8、40、40、200、800 μg/mL的AC4标准溶液,封口膜封口后于4℃冰箱保存。
1.4.2TSO标准溶液配制 精确称取5 mg TSO标准品至25 mL容量瓶,加入约10 mL甲醇后,超声使其完全溶解,待恢复至室温时用甲醇定容,摇匀,配制成200 μg/mL的标准溶液。
1.4.3肝素钠溶液配制 称取肝素钠40 mg,用去离子水20 mL配制成2 mg/mL的肝素钠溶液。
1.5色谱条件 色谱柱为ACQUITY UPLC BEH C18色谱柱(Waters,2.1× 100 mm,1.7 μm),预柱为Van Guard BEH C18,1.7μm;A相为乙腈,B相为水,采用梯度洗脱方式(见表1),流速0.2 mL/min,柱温30℃,检测波长251 nm,进样量10 μL,内标为妥曲珠利亚砜(TSO)。
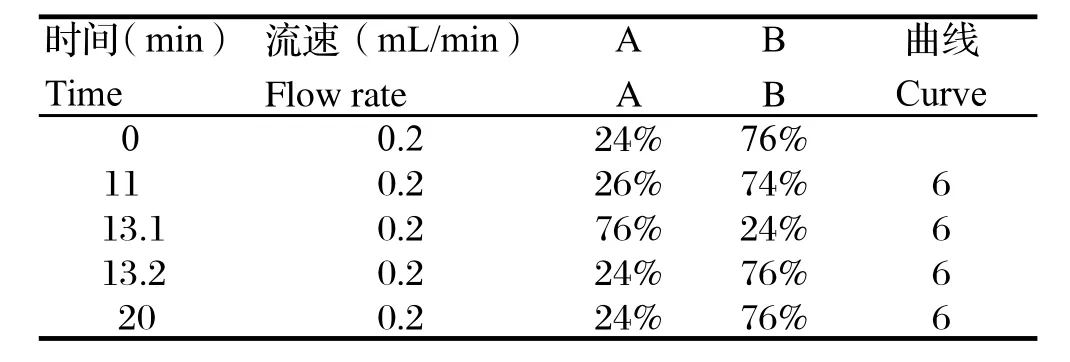
表1 检测SD大鼠血浆内AC4含量的UPLC-UV方法梯度洗脱条件Table 1 The elution situation of the UPLC-UV method for the detection of AC4 in SD rat plamsa
1.6样品前处理 取100 μL血浆样品至1.5 mL尖头离心管中,加入10 μL内标液后涡旋混匀,再加入1 mL乙酸乙酯,涡旋30 s后将离心管放至高速离心机,9600×g离心10 min,将上层有机相转移至2 mL平头离心管中,氮气吹干,加入100 μL流动相(乙腈-水,24:76,V/V)复溶残渣,涡旋30 s后过0.22 μm滤膜,进样测定。
1.7方法学考察
1.7.1专属性考察 专属性也称特异性,是指分析条件下区分待测物质与干扰物质的能力。本研究考察了空白样品及空白样品加药的色谱图,观察在AC4 和TSO保留时间处有无杂峰干扰,从而判定专属性是否良好。
1.7.2标准曲线制备 在100 μL SD大鼠空白血浆中加入AC4标准溶液,配制成血药浓度为0.08、0.2、0.8、4、20、80 μg/mL的标准样品,每个浓度设5个平行,按照1.6中的方法处理这些样品,按1.5中色谱条件进样测定,记录色谱图中AC4和TSO峰面积,以AC4与TSO的比值作为横坐标,以样品药物浓度作纵坐标绘制标准曲线。
1.7.3检测限和定量限 检测限(limit of detection,LOD)和定量限(limit of quantification,LOQ)属于灵敏度范畴,反映的是仪器的最小测量能力。
将AC4标准溶液逐级稀释到合适浓度后加入空白血浆中,按照1.6中的方法对样品进行处理,按1.5中色谱条件进样测定。以色谱图中AC4峰信噪比(s/ n)≥3时的浓度作为检测限,以信噪比(s/n)≥10时作为定量限。
1.7.4准确度和精密度 取100 μL空白血浆,添加AC4标准溶液获得高、中、低3个浓度的标准样品,低浓度在定量限附近,中浓度选标准曲线的中间浓度,高浓度选择略低于标准曲线最高点的浓度,每个浓度设5个平行。将制备的标准样品按1.6中的方法处理,以1.5中的色谱条件进样测定,样品的相对回收率根据当天制备的标准曲线计算。
制备高、中、低三个浓度的标准样品(浓度选择同准确度),每个浓度5个平行,按照1.6中方法处理后进样测定,根据当天制备的标准曲线计算每个浓度实测值之间的相对标准偏差,作为日内精密度。按照上面所述方法连续处理检测3 d,计算日间精密度。
1.7.5样品稳定性 制备两组含药浓度为2、20 μg/mL的血浆样品。第一组血浆样品经室温放置8 h后按照1.6中的方法处理并进样测定,记录AC4和TSO的峰面积;第二组血浆样品置于-20℃冰箱保存24 h后取出自然解冻,完全解冻后再次将血浆样品放至-20℃冰箱,如此重复3次后,将其按照1.6中的方法处理并进样测定,记录AC4和TSO的峰面积。将AC4/ TSO的值代入标准曲线方程,算出相对回收率。
1.8质量控制 在低剂量和中剂量组样品检测过程中使用的质控样品浓度分别为0.2、2 μg/mL,在高剂量组样品检测过程中使用的质控样品浓度分别为0.8、20 μg/mL。
2 结果
2.1方法的专属性 由图1可知,在SD大鼠血浆样品中,AC4和TSO出峰附近没有杂峰干扰,专属性良好。
2.2线性关系考察 按照1.7.2的方法制备标准血浆样品,制作的标准曲线如图2所示。以AC4/TSO比值作为y,以样品实际浓度作为x,计算得到的标准曲线方程为y=0.091x+0.001,R2=1,测量范围在0.08~80 μg/mL之间,最低浓度点的相对回收率偏差在20%以内,其他浓度点的相对回收率在15%以内,该标准曲线合格。
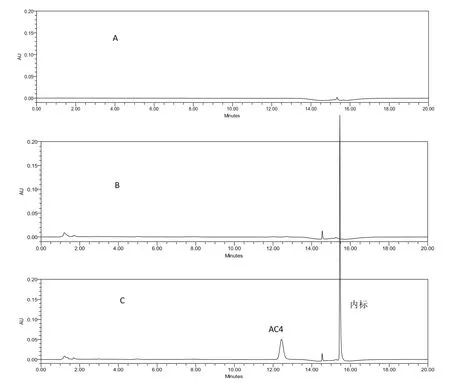
图1 AC4典型色谱图Fig. 1 Typical chromatograms of AC4 in rat plasma samples
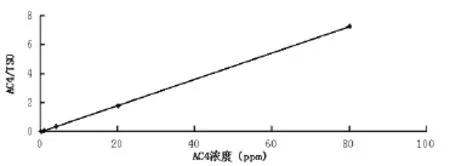
图2 检测大鼠血浆内AC4的UPLC-UV分析法标准曲线Fig. 2 The standard curve of UPLC-UV method for AC4 detection in SD rat plasma
2.3检测限和定量限 以AC4峰与噪音的比值(s/n)≥3时的浓度为检测限,由此得到本检测方法的检测限为0.04 μg/mL;同理,以s/n≥10的浓度为定量限,得到本检测方法的定量限为0.08 μg/mL。根据定量限应该小于被测物在3~5个消除半衰期时或者最大血药浓度的1/20~1/10的浓度,本方法符合要求。
2.4准确度和精密度 本研究考察了0.2、2、60 μg/ mL3个浓度的准确度和精密度,准确度用相对回收率表示,精密度用RSD表示。相关数据如表2所示。
根据《兽药化学药物非临床药代动力学试验指导原则》,回收率一般为85%~115%,定量限附近的回收率为80%~120%。对于6次重复测定的批内变异系数,当被测物浓度大于0.1 μg/mL时,应小于10%;当被测物浓度小于0.1 μg/mL时,应小于20%。对于批间变异系数,定量限附近的浓度应小于20%,其他浓度应小于10%[4]。本分析方法经过测试后,0.2 μg/mL时的回收率为97.56%~101.9%,批内和批间变异系数均小于5.51%;2 μg/mL时的回收率为98.63%~106.2%,批内和批间变异系数均小于6.36%;60 μg/mL时,回收率为101.8%~106.0%,批内和批间变异系数均小于3.00%,均符合指导原则要求。

表2 UPLC-UV法分析大鼠血浆样品中AC4的准确度和精密度Table 2 The recovery and precision results of the UPLC-UV method for detecting of AC4 in SD rat plasma
2.5 稳定性试验 2 μg/mL和20 μg/mL血浆样品分别在室温放置8 h和经过3次冻融后的稳定性显示,在室温放置8 h的平均相对回收率分别为98.7%和101.3%,表明血浆中的AC4至少在室温放置8 h内稳定(表3);经过冻融3次后的平均相对回收率分别为101.4%和95.7%,表明含药样品经过3次反复冻融是稳定的(表4)。

表3 SD大鼠血浆加标样品室温放置8 h后的稳定性检测Table 3 Stability of spiked SD rat plasma samples after storage for 8 h at room temperature
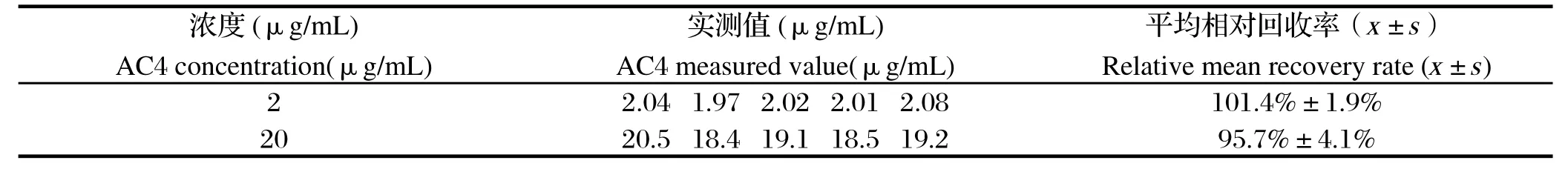
表4 SD大鼠血浆加标样品冻融3次后的稳定性检测Table 4 Stability of spiked SD rat plasma samples after three freeze-thaw cycles
2.6 平均血药浓度-时间曲线 按照前面建立的UPLCUV分析方法,分别对雌雄SD大鼠低、中、高剂量组在给药后不同时间点采集的样品进行分析,分析过程中,严格按照1.8中的方法进行质量控制,保证检测数据的真实、可靠。低、中、高组的口服给药剂量分别为1、2、10 mg/kg·BW,获得的药时曲线如图3~5所示。
2.7 药代动力学参数 利用药动学数据处理软件DAS3.0对血药浓度-时间数据进行分析。结果显示,雌鼠在低(1 mg/kg·BW)、中(2 mg/kg·BW)、高剂量(10 mg/kg·BW)的AUC(0-t)值分别为131.593、305.168、1764.100 mg/L·h,Cmax值为6.03、11.53、53.09 μg/mL(表5),可以看出药时曲线下面积和最大血药浓度均与给药剂量呈正相关关系,药时曲线下面积和最大血药浓度在雌性SD大鼠体内存在剂量依赖关系,同理得到,药时曲线下面积和最大血药浓度在雄性SD大鼠体内也存在剂量依赖关系。
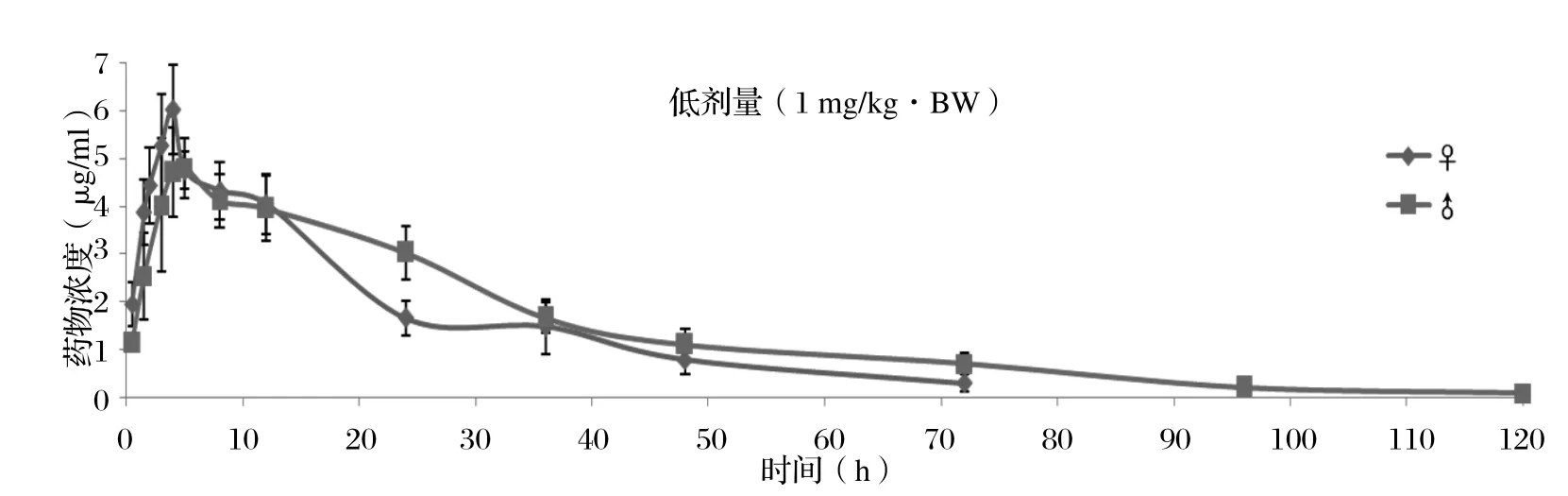
图3 雌、雄SD大鼠低剂量组血药浓度-时间曲线Fig. 3 The plasma concentration - time curve of female and male SD rat at a low-dose administration
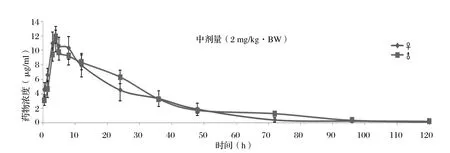
图4 雌、雄SD大鼠中剂量组血药浓度-时间曲线Fig. 4 The plasma concentration - time curve of female and male SD rat at a middle-dose administration
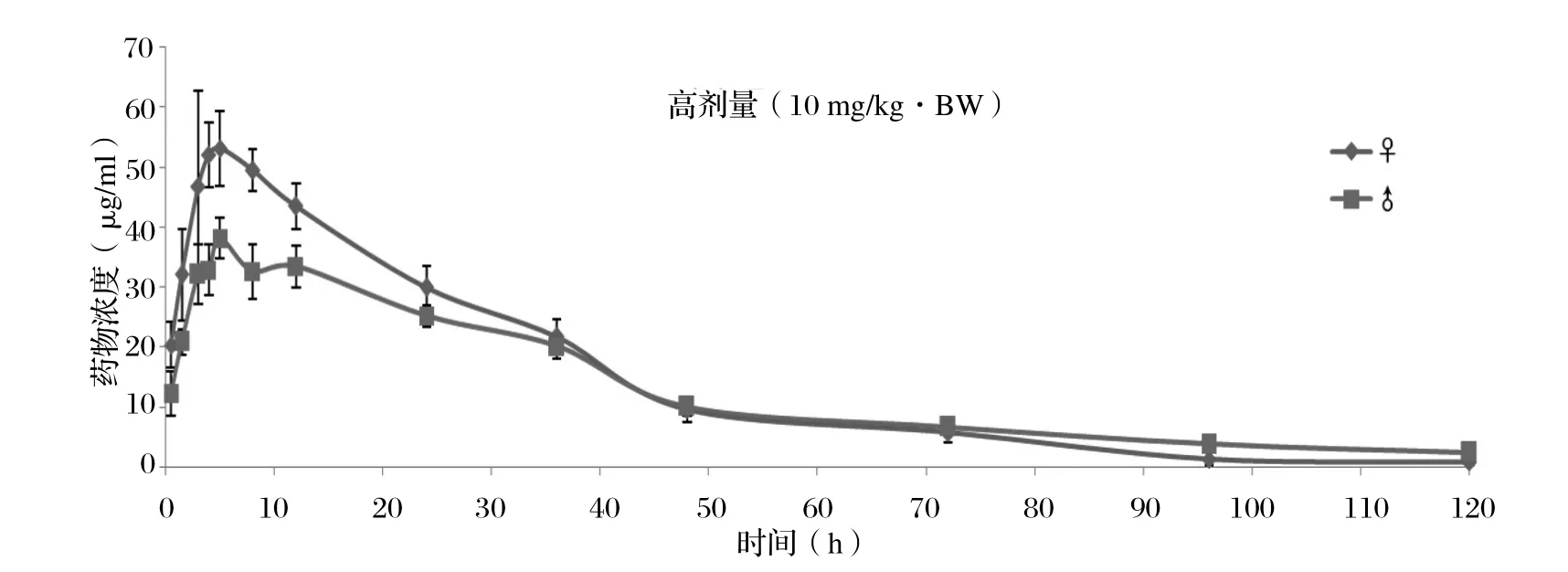
图5 雌、雄SD大鼠高剂量组血药浓度-时间曲线Fig. 5 The plasma concentration - time curve of female and male SD rat at a high-dose administration
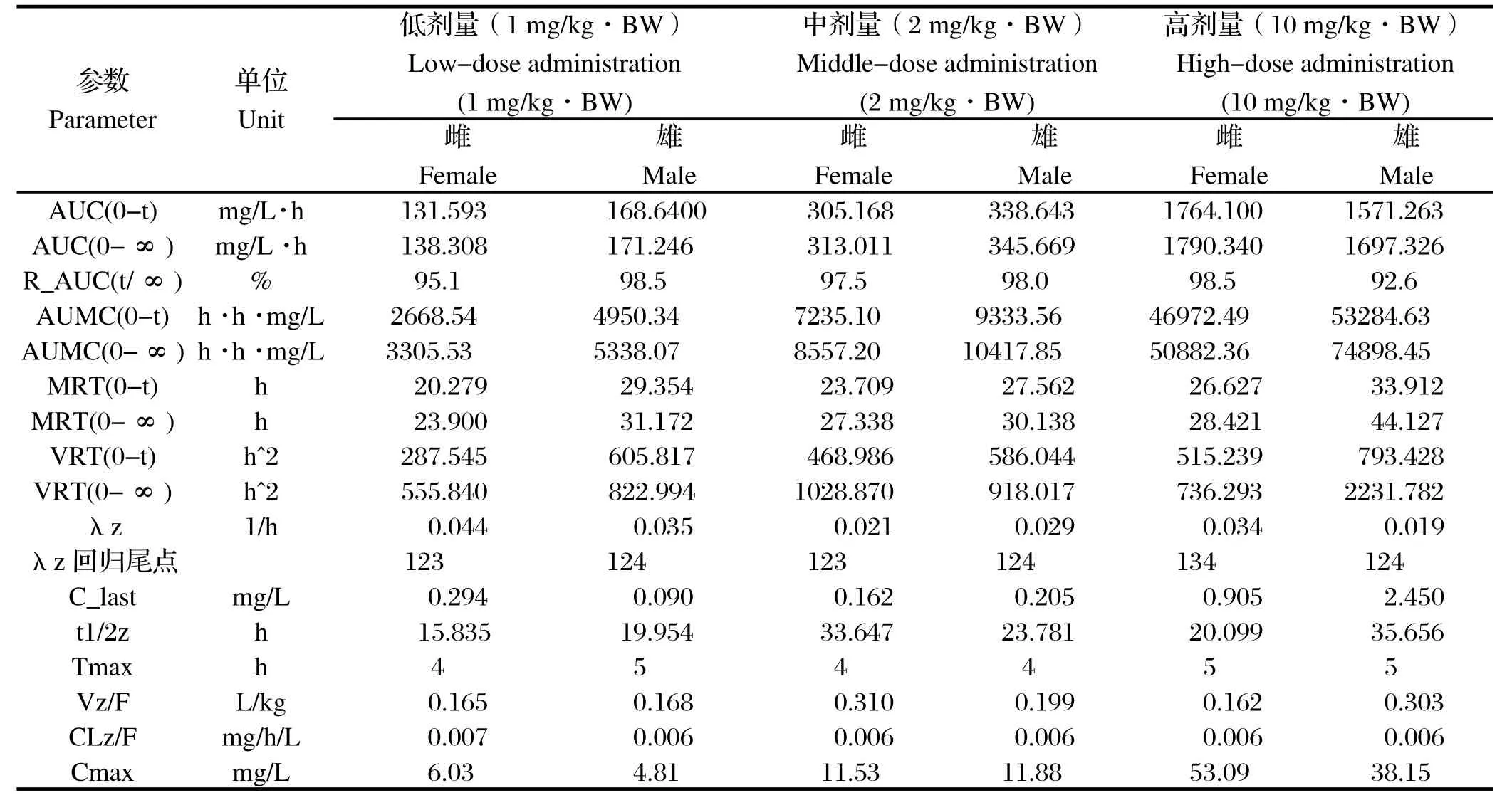
表5 雌雄SD大鼠高、中、低剂量组非房室模型统计矩参数Table 5 Non-compartmental model statistical moments parameters for SD rat after different doses administration
3 讨论
三嗪类抗球虫药物的代表药物是地克珠利和妥曲珠利,虽然地克珠利和妥曲珠利的抗球虫机理不尽相同,但都具有广谱、高效、低毒的特点,防治球虫病效果优异。随着现代分析和检测技术的发展,快速、简便、高灵敏度和准确度的检测并可量化生物组织内药物的方法得以出现,为药物在实验动物体内的药代动力学研究打下了基础[5]。
地克珠利的特点是进入血液循环后能够广泛的分布至禽类或哺乳动物的组织,一般具有较长的半衰期,通过粪便加以消除。地克珠利毒性非常低,没有遗传毒性、致癌性、胚胎毒性或致畸性,并且不致突变[5]。
张可煜等[6]对44羽雏鸡灌服地克珠利预混剂,分析实验数据后得知地克珠利在雏鸡体内代谢符合一级吸收的二室模型,血药浓度达峰时间为1.64 h,消除半衰期为24.29 h,属于快吸收、慢消除的药物。Dirikolu等[7]对口服剂量为2.5g/450 kg地克珠利的马进行了初步的药代动力学研究,结果显示给药后24 h时达到(1.077±0.174)μg/mL的峰浓度,平均半衰期为43 h,在马体内消除较慢。王国永等[8]研究了地克珠利在獭兔体内的药代动力学,发现地克珠利的药时数据符合一级吸收的二室模型,但消除半衰期仅有8.8 h,表明药物在不同种属动物的药动学参数具有差异性。
妥曲珠利以口服混悬剂的形式,可以对鸡、火鸡、猪和牛的球虫病起到防治作用。药理学研究表明,妥曲珠利在胃肠道能很好的被吸收[8],迅速代谢成妥曲珠利砜和妥曲珠利亚砜。妥曲珠利砜在鸡、火鸡、犊牛的体内消除缓慢,被认为是妥曲珠利残留的标志[9]。
郭永刚等[10]对妥曲珠利在健康和球虫感染肉鸡体内的药动学进行了研究,灌服2.5%妥曲珠利溶液后,两组的主要药动学参数为:分布半衰期为(4.31±0.85)h和(4.29±1.03)h,消除半衰期为(23.81±2.81)h和(23.76±3.31)h,药时曲线下面积为(174.15±34.09)μg·h/mL和(165.14±23.71)μg·h/mL,妥曲珠利的药动学参数在健康和感染球虫肉鸡间无明显差异,体内代谢都属于一级吸收二室开放模型。Kim等[11]研究了妥曲珠利和其两个代谢产物妥曲珠利砜、妥曲珠利亚砜口服后在肉鸡体内的药动学,结果表明妥曲珠利砜在肉鸡体内的消除(80.3 h±10.8 h)比妥曲珠利(10.6 h±1.2 h)和妥曲珠利亚砜(14.7 h±2.9 h)的消除要慢的多,这与Lim等[12]在猪体内得到的妥曲珠利及其代谢产物的药动学结果类似,妥曲珠利砜的长半衰期可能对妥曲珠利临床应用中持续的疗效有所贡献。除了对肉鸡、猪体内妥曲珠利的药动学研究以外,在大鼠、家兔[13]、马[14]、牛体内的药动学也已有研究报道,不同的药动学数据表明种属之间具有差异性。
本研究中药物AC4也存在不同种属之间的差异性。检测到的生物消除半衰期参数,最短的为雌鼠低剂量组(15.825 h),最长的为雄鼠高剂量组(35.656 h);AC4在雄鼠体内的平均滞留时间要大过雌鼠,雌鼠平均滞留时间为20.279~26.627 h,雄鼠为27.562-33.912 h;达峰时间上,各组之间相差不大,均在4~5 h;高剂量组,雌鼠的药时曲线下面积和最大血药浓度均明显比雄鼠大,表明三嗪类抗球虫药物在动物体内的药动学特征呈现出明显的性别差异和种属差异。
[1] 费陈忠, 韩春周, 林洋, 等. 抗鸡球虫病的三嗪类新化合物纳川珠利的药效试验[J]. 中国兽药杂志, 2010, (7): 11-12.
[2] Fei C, Fan C, Zhao Q, et al. Anticoccidial effects of a novel triazine nitromezuril in broiler chickens[J]. Vet Parasitol, 2013, 198(1): 39-44.
[3] 刘昌孝. 我国药代动力学研究发展的回顾[J]. 中国药学杂志, 2010, (2): 81-89.
[4] 唐峰, 杨焕民, 李剑勇, 等. 体内药物分析方法的研究进展[J]. 食品与药品, 2006, 8(9A): 27-30.
[5] Božić D, Bilandžić N, Varenina I, et al. Diclazurilapplication, pharmacokinetics and toxicology[J]. Vet Stan, 2012, 43(6): 473-484.
[6] 张可煜, 王国永, 赵振升, 等. 地克珠利在雏鸡体内的药动学研究[J]. 中国兽医寄生虫病, 2008, 16(2): 1-4.
[7] Dirikolu L, Lehner F, Nattrass C, et al. Diclazuril in the horse: its identification and detection and preliminary pharmacokinetics[J]. J Vet Pharmacol Ther, 1999, 22(6): 374-379.
[8] 王国永, 赵振升, 薛帮群, 等. 地克珠利在獭兔体内的药物动力学研究[J]. 中国养兔, 2007,(5): 22-25.
[9] Bilandžić N, Varenina I, Božić D, et al. Toltrazuriladministration and pharmacokinetics[J]. Vet Stan, 2012,43(2): 135-144.
[10] 郭永刚, 冯秀娟, 万荣峰, 等. 妥曲珠利在健康和球虫感染肉鸡体内的药动学研究[J]. 安徽农业大学学报, 2007,34(1): 79-81.
[11] Kim M S, Park B K, Hwang Y H, et al. Pharmacokinetics and metabolism of toltrazuil and its major metabolites after oral administration in broilers[J]. Poultry Sci, 2013,50(3): 257-261.
[12] Lim J H, Kim M S, Hwang Y H, et al. Pharmacokinetics of toltrazuril and its metabolites, toltrazuril sulfoxide and toltrazuril sufone, after a single oral administration to P1gs[J]. J Vet Med Sci, 2010, 72(8): 1085-1087.
[13] Kim M S, Lim J H, Hwang Y H, et al. Plasma disposition of toltrazuril and its metabolites, toltrazuril sulfoxide and toltrazuril sulfone, in rabbits after oral administration[J]. Vet Parasitol, 2010, 169(1): 51-56.
[14] Tobin T, Dirikolu L, Harkins J D, et al. Preliminary pharmacokinetics of diclazuril and toltrazuril in the horse[C]//Proceedings, Annual Meeting AAEP, 1997, 43: 15-16.
PHARMACOKINETICS OF A NEW COCCIDOISTAT AC4 IN RATS
WANG Chun-mei1, LIN Xi1, ZHANG Ke-yu1, ZHANG Li-fang1, TIAN Yu-zhu2, FEI Chen-zhong1,ZHANG Xiao-xiao1, ZHAO Juan1, XIAO Sui1, WANG Xiao-yang1, WANG Mi1,ZHENG Wen-li1, XUE Fei-qun1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Qilu Animal Health Products Co., Ltd, Jinan 250100,China)
The objective of the present study was to develop a measurement of AC4 within the plasmas of SD rats and examine the pharmacokinetics of AC4 in these animals. In the UPLC-UV method, ethylacetate was used as the extraction solvent and toltrazuril sulphoxide as an internal standard. The limits of detection and quantifi cation were 0.04 and 0.08 μg/mL, respectively. The line arrange of the standard curve was 0.08-80 μg/mL. In addition, the sample was stable after storage for 8 h at room temperature or 3 cycles of freezing and thawing. The method was sensitive, accurate and therefore suitable for detection of AC4 in SD rat plasma samples. In the pharmacokinetic study of AC4 in SD rats, doses of 0.45, 0.9 and 4.5 mg / kg·BW were examined in male and female SD rats. The results showed a dose-dependent manner of AUC and Cmax in both male and female SD rats. The AC4 peaked in the plasmas around 4 h post application. There were signifi cant differences of the biological elimination half-life of AC4 between genders and doses.
AC4; SD rat; UPLC-UV; pharmacokinetic
S859.795
A
1674-6422(2016)04-0064-08
2016-02-02
国家自然科学基金项目(31272607);上海自然科学基金项目(14ZR1449000);公益性行业(农业)科研专项(201303038)
王春梅,女,博士,助理研究员,主要研究方向为药物代谢动力学
薛飞群,E-mail:fqxue@shvri.ac.cn

