牛支原体(新疆株)灭活疫苗的制备及犊牛免疫保护性评价
杨铭伟,剡根强,王静梅,王树杰,王 学
(1. 石河子大学动物科技学院,石河子 832003;2. 新疆西部牧业股份有限公司中心牛场,石河子 832000)
·研究论文·
牛支原体(新疆株)灭活疫苗的制备及犊牛免疫保护性评价
杨铭伟1,剡根强1,王静梅1,王树杰2,王 学2
(1. 石河子大学动物科技学院,石河子 832003;2. 新疆西部牧业股份有限公司中心牛场,石河子 832000)
为研发用于预防犊牛支原体肺炎及关节炎灭活油佐剂疫苗并评价其免疫效果,本研究采用牛支原体(Mycoplasma bovis,M.bovis)新疆分离株做为制苗菌株,经牛支原体专用液体扩大培养基培养后进行膜分离浓缩、甲醛灭活,加入油佐剂乳化制备牛支原体灭活疫苗,经无菌检验、实验动物安全性检验及乳化效果检测后进行犊牛免疫效果测定。结果显示,免疫组犊牛在二免后14 d,血清中M.bovis抗体达到0.465(OD450),3头攻毒犊牛均保持良好的精神状态且体温变化不明显,临床症状综合评分为3,肺脏解剖学及病理组织学观察无异常,肺脏病变指数为2且肺脏中未分离回收到M.bovis;未免疫对照组犊牛同期血清M.bovis抗体为0.142(OD450),3头攻毒犊牛均先后出现体温升高、轻度咳喘、脓性鼻液、明显消瘦等症状,临床症状综合评分为11,肺脏病变指数为17,肺脏尖叶、心叶及部分膈叶均表现明显肝变,2头犊牛表现胸膜与肺脏黏连,1头犊牛整个尖叶广泛分布黄白色蚕豆状大小坏死性结节,与自然感染病例相同,病理组织学观察显示肺泡腔和支气管中有大量中性粒细胞浸润,支气管管壁充血、水肿,肺脏部分坏死灶呈均质红染,为典型的化脓性及坏死性肺炎变化,从病变肺组织中均分离回收到M.bovis。结果表明,本研究制备的牛支原体灭活疫苗给犊牛免疫后能产生良好的免疫应答反应,并能抵抗M.bovis感染所致的肺脏病变作用。
牛支原体;疫苗;犊牛;免疫保护;病理学
牛支原体(Mycoplasma bovis,M.bovis)是引起犊牛肺炎、关节炎和成年牛乳房炎的主要病原体之一。早在1961年牛支原体被鉴定为致乳腺炎的病原体,1976年首次被描述为引起呼吸道疾病的病因[1],此后在不同国家与地区相继暴发与流行,给全世界养牛业带来了巨大的经济损失[2,3]。目前已经证实M.bovis感染不仅导致牛肺炎、乳腺炎,还可导致关节炎、角膜结膜炎、耳炎、生殖道炎、流产与不孕等多种疾病,并可引发免疫抑制[4-6]。由于M.bovis对多种抗生素已表现出耐药性,并且与其他病原混合感染时,抗生素治疗难以奏效,因此应用疫苗进行免疫预防成为控制牛支原体病的主要措施之一。但目前除美国外,其他国家几乎无商品化疫苗应用于牛支原体病的预防。美国虽然将一些商品化疫苗(包括2株预防牛支原体肺炎的疫苗Pulmo-GuardTMMpB和Myco-BacTMB,1株预防乳腺炎的疫苗MycomuneTM)应用于牛群[7],但目前还未见到任何文献报道证实这些疫苗是否能有效控制牛支原体病的发生。
本研究采用课题组分离并鉴定的新疆分离株M.bovis[8]做为制苗菌株,制备牛支原体灭活油佐剂疫苗,通过对免疫及未免疫犊牛血清M.bovis抗体水平测定、攻毒后犊牛临床症状观察、肺脏病变指数统计及病理组织学观察和肺脏组织牛支原体带菌情况来评价疫苗的免疫效果,为疫苗的应用提供试验依据。
1 材料和方法
1.1试验菌株、培养基及实验动物 本实验室保存的M.bovis新疆分离株,2010年分离自新疆维吾尔自治区石河子市某牛场因肺炎及关节炎死亡的犊牛肺脏组织,经特异性PCR鉴定和oppF基因测序分析鉴定为M.bovis[8];牛支原体专用液体扩大培养基由本课题组自主研发;牛支原体间接ELISA检测试剂盒[9]由本实验室自主建立;犊牛为新西兰进口荷斯坦奶牛所产10~15日龄健康犊牛,由新疆西部牧业股份有限公司中心示范牛场提供。
1.2主要试剂及仪器设备 ISA 206佐剂购自法国Seppic公司;间接ELISA牛支原体抗体检测试剂由本实验室配制;膜分离设备购自成都泓润科技有限公司。
1.3菌液扩大培养及浓缩 将-80℃冻存的M.bovis菌株移入5 mL牛支原体专用液体扩大培养基中,37℃、5%CO2箱中培养3 d,按照1:10的体积比传代3次,待生长稳定后做为种子菌液,按照1:10的体积比接种新鲜培养基置于37℃、5% CO2培养箱中扩大培养4 d,将培养物进行膜分离浓缩,采用活菌计数法(colony-forming units,CFU)测定浓缩菌液浓度,菌落总数以 CFU/mL计,浓缩菌液经0.4%甲醛灭活并进行无菌检验后做为M.bovis抗原悬液。
1.4牛支原体灭活疫苗的制备及检测 牛支原体有效含量为108CFU/mL,牛支原体蛋白含量为2 mg/ mL。疫苗配制方法:油相(ISA 206佐剂):水相(灭活牛支原体菌悬液)= 54:46(V/V)。ISA 206佐剂使用前经121℃ 灭菌30 min。配苗前将两相预热至(31±1)℃,然后在搅拌状态下(150 r/min)将水相缓慢滴加入油相佐剂中,滴加完毕后置恒温震荡培养箱30℃、200 r/min循环乳化30 min,迅速降温10 min,4℃保存。疫苗先后经无菌检测、黏度检测、离心检测、稳定性试验及小鼠安全性检验合格后备用。
1.5疫苗免疫程序及抗体检测 随机选取10~15日龄健康犊牛20头,其中免疫组10头,未免疫对照组10头。免疫组犊牛肌肉注射牛支原体灭活疫苗3 mL,间隔10 d以相同剂量二免。分别于首免前、二免前及二免后14 d无菌分离血清,应用本课题组已建立的牛支原体间接ELISA方法检测免疫犊牛血清抗体[9]。对照组注射等剂量生理盐水,与免疫组犊牛在相同时间点采集血清测定其血清中M.bovis抗体。全部犊牛饲养于同一犊牛舍中,饲喂方式相同。
1.6攻毒保护试验与评价指标
1.6.1攻毒保护试验 随机选取二免后21 d(42~45日龄)免疫组犊牛3头和相近日龄未免疫对照组犊牛3头,运往实验动物室隔离饲养,所有犊牛饲养于同一室内,地面铺设清洁垫草。犊牛每天供给煮沸消毒后的鲜奶5~6 kg,同时补充犊牛全价颗粒饲料及优质苜蓿草,供其自由采食。攻毒前3 d每天测定并记录每头犊牛直肠体温、采食及精神状况,随后每头犊牛气管注射M.bovis新鲜培养浓缩菌悬液3 mL(浓度为1.8×109CFU/mL),鼻腔滴注2 mL[10]。
1.6.2攻毒保护试验评价指标
1.6.2.1临床症状评分 攻毒后每天测定每头犊牛体温,绘制体温变化曲线,观察其精神状态、食欲、粪便及呼吸表现,临床症状评分指标见表1。
1.6.2.2血清M.bovis抗体检测 攻毒后7、21、28 d测定所有攻毒犊牛血清M.bovis抗体。
1.6.2.3肺脏病变指数评价 攻毒剂量及评价指标参考文献[10]。攻毒28 d后剖检全部攻毒犊牛,观察并记录肺脏病理变化,肺脏病变评分标准见表2。
1.6.2.4肺脏病理组织学观察 采集每头攻毒犊牛病变肺脏组织,置于4%福尔马林固定,常规石蜡包埋、切片、HE染色镜检。
1.6.2.5病变肺组织M.bovis分离培养与PCR鉴定 采集每头攻毒犊牛病变肺脏组织进行M.bovis分离培养及PCR鉴定。

表1 攻毒犊牛临床症状评分指标Table 1 The standard of clinical symptoms in challenge experiment
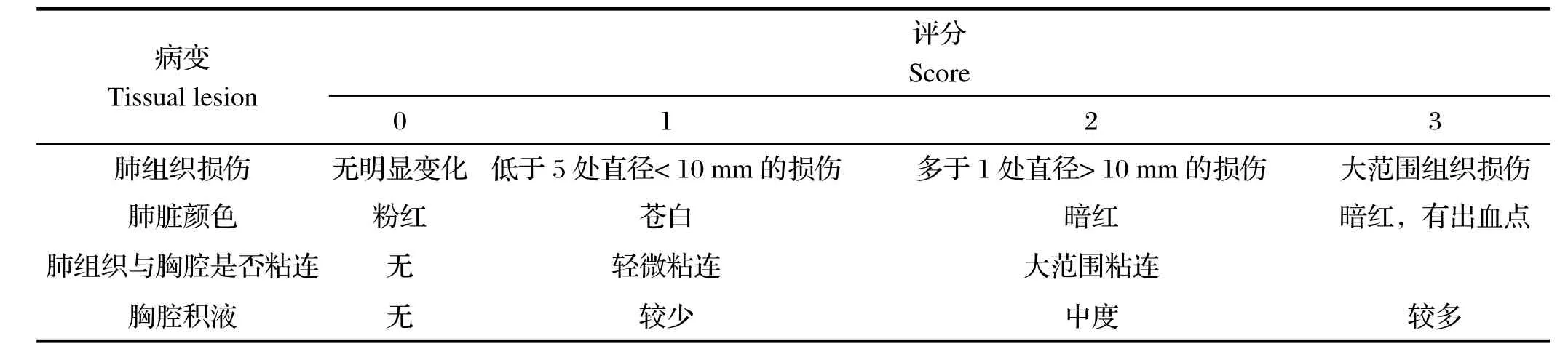
表2 攻毒犊牛肺脏组织病理变化评分标准Table 2 The standard of tissual lesion in challenge experiment
2 结果
2.1牛支原体灭活疫苗免疫犊牛后抗体检测 M.bovis血清抗体检测参照文献[9]进行,结果显示,犊牛在经免疫免疫后M.bovis血清平均抗体水平(OD450=0.465)显著高于未免疫组(OD450=0.142),免疫组与对照组相比差异具有极显著统计学意义(P<0.01),见表3。
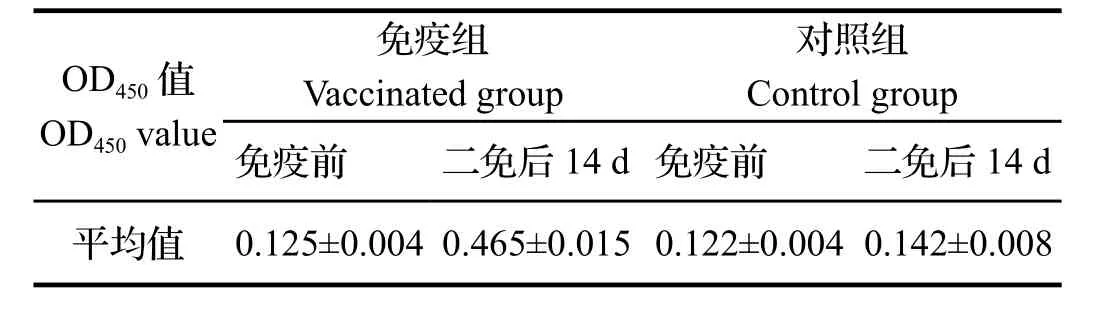
表3 牛支原体血清抗体检测结果Table 3 Result of M.bovis antibody in serums of calves
2.2犊牛攻毒后临床症状及体温变化 整个攻毒期,免疫组犊牛精神良好、食欲旺盛,未出现流鼻涕、咳喘等明显呼吸道症状(表4),体温波动范围较小,临床症状综合评分为3;未免疫组犊牛在攻毒后d2均表现体温明显升高,最高体温为40.3℃,1周后表现轻度咳嗽、流涕、厌食、腹泻,2周后被毛凌乱、明显消瘦,流脓性鼻液,咳嗽频繁,其中1头犊牛食欲废绝,卧地不起,呼吸困难。攻毒期间未免疫组犊牛出现较大范围的体温波动(图1),临床症状综合评分为11,与免疫组犊牛差异明显。
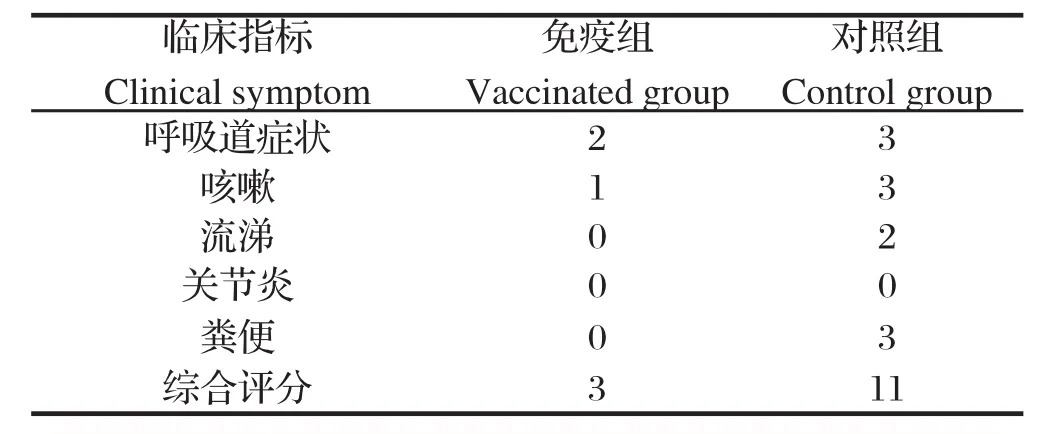
表4 攻毒犊牛临床特征得分Table 4 Clinical assessment of calves vaccinated with M.bovis
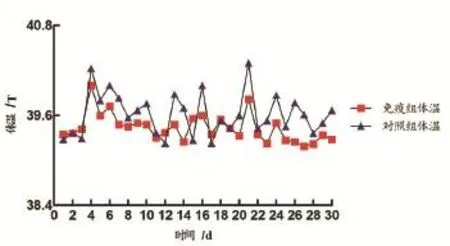
图1 攻毒后犊牛体温变化Fig. 1 The temperature fl uctuations of the calves vaccinated with M.bovis
2.3攻毒犊牛肺脏病理解剖学变化 将免疫组犊牛和未免疫组犊牛(共计6头)在攻毒28 d后全部放血致死,观察并统计两组犊牛肺脏病变指数。结果表明免疫组犊牛肺脏全部正常,呈粉红色,无任何病变,见图2-D。未免疫组3头犊牛肺脏均出现广泛的病变区,1头犊牛肺脏与胸膜发生不同程度粘连,有少量液体积聚(见图2-A、2-B);2头犊牛肺尖叶、心叶及部分膈叶的局部红色肝变(见图2-A、2-C),其中1头犊牛整个尖叶广泛分布有蚕豆大小的黄白色结节状坏死灶,与自然病例极为相似,如图2-E所示。未免疫组犊牛的肺脏损伤情况明显高于免疫组犊牛(表5)。
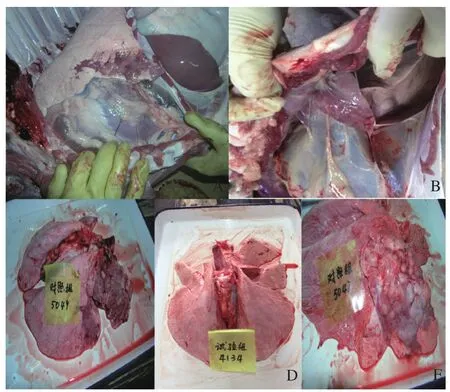
图2 攻毒后犊牛肺脏组织病理变化Fig. 2 The pathological change of lung tissue from calves vaccinated with M.bovis
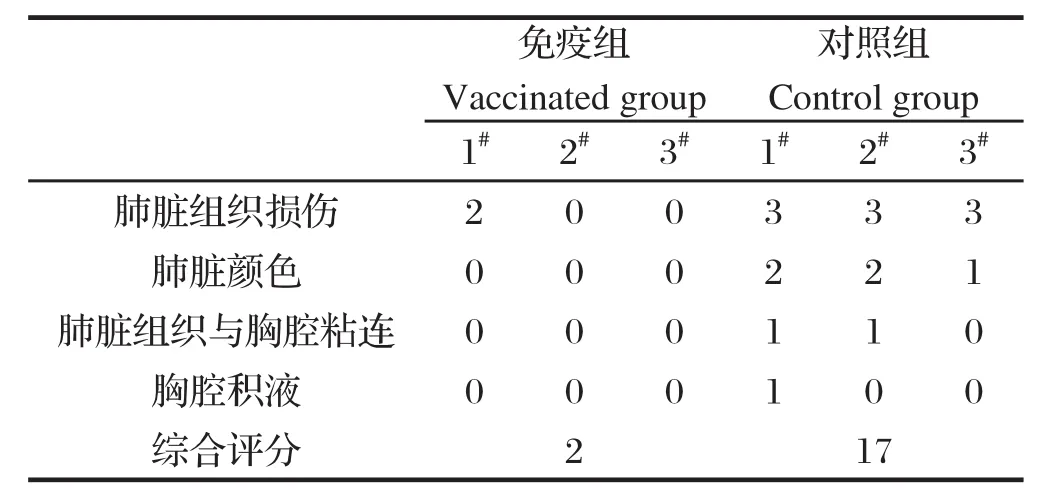
表5 攻毒后犊牛肺脏损伤统计结果Table 5 Histological examination of lung damage in calves
2.4攻毒犊牛肺脏病理组织学变化 肺病理切片观察显示,免疫组犊牛肺脏组织结构清晰可辨,肺泡结构完整,且肺泡囊内无异物,如图3-A、3-B。未免疫对照组肺脏组织表现出不同程度的病理损伤:细支气管管壁充血、水肿,并有较多的中性粒细胞浸润,管壁增厚;细支气管粘膜上皮细胞变性、坏死、脱落,官腔内聚集多量的浆液性渗出物,如图3-C、3-D所示;肺泡壁略微增厚,肺泡腔中充满大量中性粒细胞、巨噬细胞、多核巨细胞及坏死脱落的上皮细胞(见图3-E);在残存的正常肺泡中,出现大量中性粒细胞,巨噬细胞融合成多核巨细胞并开始吞噬坏死的中性粒细胞(见图3-F);肺部出现较大均质红染的坏死灶,坏死灶周围有大量中性粒细胞浸润并由成纤维细胞、纤维细胞构成的结缔组织包囊,与包囊相邻的肺泡发生萎缩(见图3-G、3-H)。
攻毒后病理解剖与病理组织学变化表明,免疫组犊牛肺脏组织损伤程度明显低于未免疫组,证明研制的牛支原体灭活油佐剂疫苗可有效预防犊牛支原体肺炎的发生。
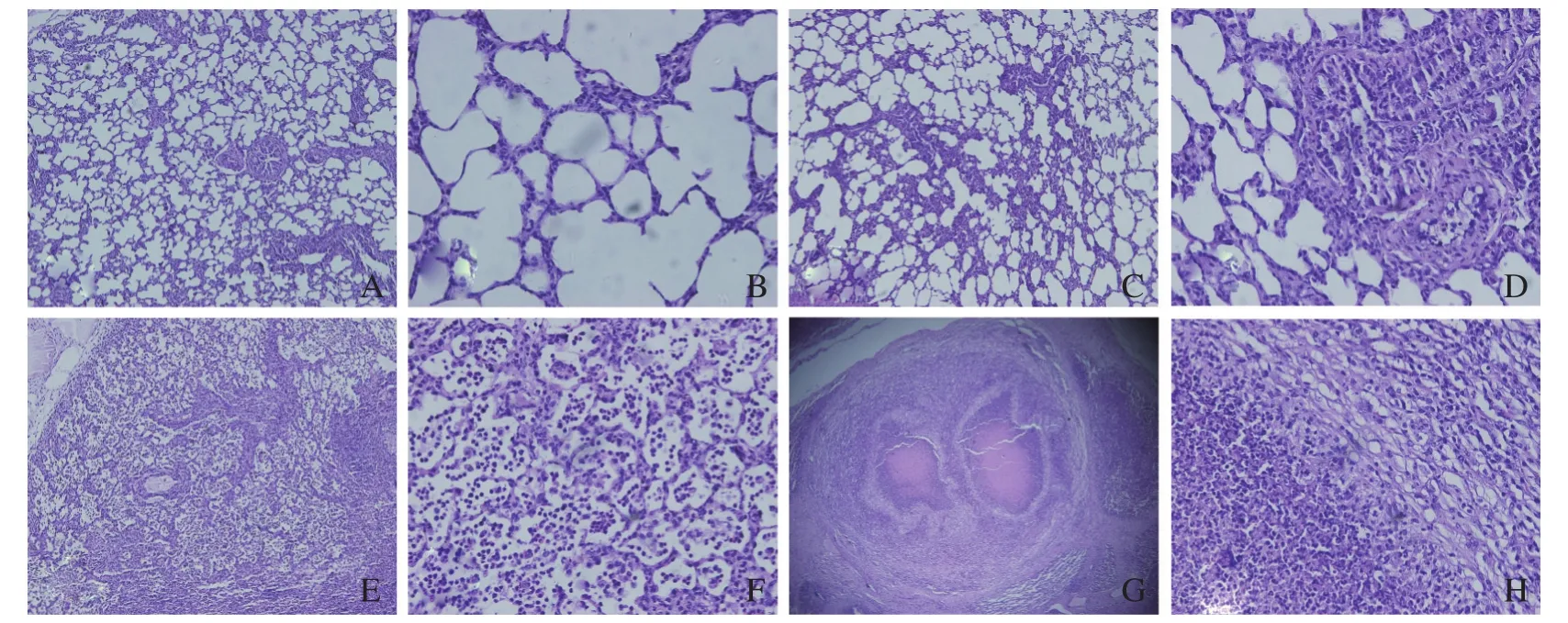
图3 攻毒后犊牛肺脏组织病理组织学观察(HE染色)Fig. 3 Histopathological observation of lung tissue from calves vaccinated with M.bovis (HE stain)
2.5攻毒犊牛血清牛支原体抗体水平变化 免疫组犊牛在首免后10 d血清中即可检测到抗体,在随后的二免及攻菌阶段一直保持较高水平;未免疫组(对照组)在攻菌后7 d虽表现出抗体水平上升,但远低于免疫组抗体水平。不同阶段血清抗体水平变化规律如图4所示。

图4 攻毒后犊牛血清支原体抗体水平变化规律Fig. 4 Dynamic change of antibody againast M.bovis from calves serum after challenge
2.6攻毒犊牛肺组织牛支原体分离结果 攻毒28 d后,将6头犊牛宰杀,无菌采集肺脏组织,经研磨后分别接种于牛支原体液体培养基进行分离培养。结果显示免疫组3头犊牛未分离到M.bovis,而未免疫组均分离到M.bovis,初步揭示免疫犊牛具有抵抗侵入体内病原体繁殖及清除病原体的能力。
3 讨论
我国研究者黎济申等[11]1983年首次从患乳腺炎的牛乳中分离到牛支原体。2008年辛九庆等[12]在国内首次从患肺炎的肉犊牛肺脏中分离得到牛支原体。自2008年开始,我国部分地区的肉牛及奶牛场先后暴发了由M.bovis引起的以坏死性肺炎为主要特征的“传染性牛支原体肺炎”疫情,随后相继在湖北省、贵州省、宁夏省、内蒙古自治区、广西壮族自治区、新疆维吾尔自治区、重庆市等地区发现该病,发病率为50%~100%,病死率高达10%~50%[13]。李岩等[14]对新疆9个地区15个规模化牛场牛支原体感染的调查表明,阳性率为100%,说明牛支原体感染已成为影响养殖业发展的重要疫病,因此开发有效疫苗和高效药物已成为行业关注的重要课题。
免疫预防是控制牛支原体病的有效手段之一,但目前国内尚无用于该病的商品化疫苗[15]。本研究在开展新疆主要规模化牛场M.bovis感染调查的基础上,采用自本地区M.bovis分离株做为制苗菌株,通过自主研究建立的扩大培养及抗原浓缩工艺制成牛支原体灭活油佐剂苗,免疫怀孕母牛及犊牛后可产生良好的抗体应答,无不良反应。免疫犊牛攻毒保护结果表明,该疫苗可有效抵抗M.bovis的感染,消除或缓解M.bovis感染后对犊牛肺脏的损伤作用,可作为防控规模化牛场牛支原体病的免疫制剂。由于本研究重点针对新疆地区规模化奶牛场牛支原体病的防控,制苗菌株为新疆分离株,该疫苗是否对其他地区分离株具有保护作用目前尚不清楚。
疫苗免疫保护试验是评定疫苗免疫效力唯一可信的方法。由于M.bovis引起的犊牛肺炎属近年来新发动物传染病,国内外有关M.bovis人工感染模型的研究报道较少,在攻毒保护试验中,如何选择动物的品种、日龄、感染剂量、途径以及评价指标等均缺乏可供参考的依据。本研究根据新疆犊牛M.bovis肺炎的流行特点,选择对该病易感的40~45日龄荷斯坦奶牛,以生物有效含量明显高于疫苗抗原含量的M.bovis新鲜培养物(1.8×109CFU/mL)做为感染剂量,仿照M.bovis肺炎呼吸道自然感染的途径采用鼻黏膜滴注及气管注射进行人工感染,选择以临床症状、靶器官病变指数、病理组织学变化、感染病原体在靶器官的定居及抗体动力学5个检测项目作为疫苗免疫保护试验的评价指标[7]。结果表明,选用的评定指标具有一定的借鉴意义,能够较客观地反应疫苗的免疫效力。由于此次攻毒属于探索性研究,初衷是在确定疫苗免疫效果的同时,研究建立较为科学的牛支原体疫苗免疫保护效果评价的方法。因此,有关疫苗最终的保护性评价还需进行一定规模的犊牛免疫保护试验加以确定。
本研究中人工感染未免疫犊牛虽表现体温变化、典型呼吸道症状及较典型的肉眼可见肺部病理变化及病理组织学变化,但未出现自然死亡,究其原因可能与攻毒后犊牛的饲养环境及饲养管理有关。攻毒犊牛饲养室温度均衡,昼夜温差小,通风良好,人工饲喂鲜牛奶,全价颗粒料及优质苜蓿草供其自由采食,每隔2 d更换垫草并进行环境消毒,为犊牛提供了一个良好的圈舍环境及足够的营养需求,使其抗病能力增强,继发感染的机会较少。这一结果间接说明,改善犊牛饲养环境,提供优质日粮,可降低犊牛感染M.bovis的发病率与病死率。而要建立人工感染模型并进行疫苗免疫保护试验需选择与自然发病犊牛相似的牛场环境中,但可能存在抗原扩散的风险。
有关牛支原体致病与免疫机制尚未见研究报道。本研究中,免疫和未免疫组犊牛在人工感染M.bovis后28 d,3头免疫犊牛肺脏组织中未检出M.bovis,而未免疫犊牛均检测出M.bovis,表明免疫犊牛所产生的特异性抗体发挥了作用,抗体与支原体结合后可能激活补体和激活巨噬细胞,从而发挥杀灭支原体作用[16],但免疫犊牛是如何清除牛支原体的明确机制还需进一步研究探明。
[1] Hale H H, Helmboldt C F, Plastridge W N, et al. Bovine mastitis caused by Mycoplasma species[J]. Cornell Vet,1962, 52: 582-591.
[2] Nicholas R A, Ayling R D. Mycoplasma bovis: disease,diagnosis and control[J]. Res Vet Sci, 2003, 74(2): 105-112.
[3] Caswell J L, Archambault M. Mycoplasma bovis pneumonia in cattle[J]. Anim Health Res Rev, 2008, 8(2): 161-186.
[4] Maunsell F P,Donovan G A. Mycoplasma bovis infection in young cattles[J]. Vet Clin North Am Food Anim Pract,2009, 25(1): 139-177.
[5] Stipkovits, L, Ripley P H, Varga J, et al. Use of valnemulin in the control of Mycoplasma bovis infection under field conditions[J]. Vet Rec, 2001, 148(13): 399-402.
[6] Poumarat, F, Le Grand D, Philippe S, et al. Efficacy of spectinomycin against Mycoplasma bovis induced pneumonia in conventionally reared calves[J]. Vet Microbiol, 2001, 80(1): 23-35.
[7] Nicholas R A, Ayling R D, Stipkovits L P. An experimental vaccine for calf pneumonia caused by Mycoplasma bovis: clinical, cultural, serological and pathological finding [J]. Vaccine, 2002, 20(29-30): 3569-3575.
[8] 姚永进, 剡根强, 王静梅, 等. 致犊牛肺炎和关节炎牛支原体新疆株的分离与鉴定[J]. 中国畜牧兽医, 2011,38(12): 76-79.
[9] 金云云, 剡根强, 王静梅, 等. 牛支原体间接ELISA检测方法的建立[J]. 畜牧与兽医, 2014, (2): 10-13.
[10] Nicholas R A, Ayling R D, Stipkovits L P. An experimental vaccine for calf pneumonia caused by Mycoplasma bovis: clinical, cultural, serological and pathological finding [J]. Vaccine, 2002, 20(29-30): 3569-3575.
[11] 黎济申, 陈嘉棣, 王兆久, 等. 牛霉形体的分离及其对犊牛的致病力[J]. 畜牧与兽医, 1984, (1): 8-10.
[12] 辛九庆, 李媛, 郭丹, 等. 国内首次从患肺炎的犊牛肺脏中分离到牛支原体[J]. 中国预防兽医学报, 2008, 30(9): 661-664.
[13] 石磊, 龚瑞, 尹争艳, 等. 肉牛传染性牛支原体肺炎流行的诊断[J]. 华中农业大学学报, 2008, 27(5): 629-633.
[14] 李岩, 姚永进, 范伟兴, 等. 新疆地区规模化奶牛场牛支原体流行病学调查[J]. 中国动物传染病学报, 2013,21(5): 68-71.
[15] 胡长敏, 石磊, 龚瑞, 等. 牛支原体病研究进展[J]. 动物医学进展, 2009, 30(8): 73-77.
[16] 蒋南, 翟研妮, 谷长勤, 等. 传染性牛支原体肺炎自然感染病牛的病理学观察[J]. 中国兽医科学, 2011, 41(9): 933-935.
[17] 吴移谋, 叶元康. 支原体学[M]. 2版. 北京: 人民卫生出版社, 2000: 50-53.
DEVELOPMENT AND EVALUATION OF INACTIVATED MYCOPLASMA BOVIS VACCINE IN CALVES
YANG Ming-wei1, YAN Gen-qiang1, WANG Jing-mei1, WANG Shu-jie2, WANG Xue2
(1. College of Animal Science and Technology, Shihezi University, Shihezi 832003, China; 2. Xinjiang Western Animal Husbandry Co.,Ltd. Shiheizi 832000, China)
The objective of the present study was to prepare Mycoplasma bovis vaccine and evaluate its protective immunity in calves. The inactivated M. bovis vaccine was developed using a series of procedures including massive propagation of the bacterial strain isolated from Xinjiang Province in the home-made artifi cial media, separation and concentration of the cellular membranes, inactivation with formalin and emulsion in oil ajuvant. Then, the vaccine was tested for inactivation, emulsifying effect and safety in calves. The calves were observed for fever and other clinical signs and serological responses for 4 weeks before termination. The vaccine did not cause adverse effects in calves. Post challenge, the vaccinated calves showed few clinical signs while all unvaccinated calves developed pneumonia. There was a signifi cant decrease in body weight in unvaccinated calves as compared to vaccinates but a signifi cant increasein lung lesions and rectal temperatures in unvaccinated calves. In conclusion, the inactivated M. bovis vaccine produced a signifi cant protection against the virulent challenge.
Mycoplasma bovis; vaccine; calf; protective immunity; pathology
S852.62
A
1674-6422(2016)04-0052-07
2015-12-31
国家科技支撑计划(2012BAD43B02)
杨铭伟,男,硕士研究生,预防兽医学专业
剡根强,E-mail:ygq58@shzu.edu.cn

