34株鸡大肠杆菌的分离鉴定及致病力分析
徐旺烨,樊 琛,乔薪瑗,唐丽杰,刘 敏,王 丽,徐义刚,姜艳平,崔 文,李一经
(1. 东北农业大学动物医学院,哈尔滨 150030;2. 聊城大学农学院,聊城 252059)
·研究论文·
34株鸡大肠杆菌的分离鉴定及致病力分析
徐旺烨1,樊 琛2,乔薪瑗1,唐丽杰1,刘 敏1,王 丽1,徐义刚1,姜艳平1,崔 文1,李一经1
(1. 东北农业大学动物医学院,哈尔滨 150030;2. 聊城大学农学院,聊城 252059)
本研究从鸡泄殖腔取样,分离大肠杆菌菌株,进行生化鉴定。结果显示34株菌株符合大肠杆菌的培养特性。将分离得到的34株大肠杆菌与购买的4株鸡大肠杆菌分别接种鸡胚,对致病力进行分析。结果采用数据处理软件SPSS分析90%置信区间,其中19株为致病力较强菌株(致死率大于上限38.4%),16株为致病力较弱或无致病力菌株(致死率小于下限25.1%),3株为中等致病力菌株(致死率在上限和下限之间)。通过套式PCR对38株菌的iss基因进行检测,阳性率为100%。结果表明,iss基因(increased serum survival gene)在鸡大肠杆菌中广泛存在,38株鸡大肠杆菌均有iss基因,但致病力大小不同,故推测致病力大小可能与iss基因的存在无关。
大肠杆菌;致病力;套式PCR;iss基因;分离;鉴定
禽大肠杆菌病(avian bacillosis)是由禽致病性大肠杆菌的某些血清型所引起的一类疾病的总称[1],病型多样,其中急性败血型危害最大[2]。大肠杆菌在自然环境中分布很广,在鸡舍的垫料、饲料、粪便及灰尘中广泛存在,是鸡肠道内常在菌。大肠杆菌(Escherichia coli,E.coli)是条件性致病菌,在正常情况下一般不会对机体造成影响,但在鸡体质下降,环境恶劣,应激强烈,或者与其他致病菌混合感染时会造成发病。临床症状主要为腹泻,可造成卵黄囊炎、全眼球炎、心包炎、脐炎、败血症、肉芽肿、滑膜炎、输卵管炎等,对养殖业造成一定的经济损失。iss基因(increased serum survival gene)是大肠杆菌的毒力基因之一[3],其作用是增强大肠杆菌在血清中的生存能力[4,5],从而增加其致病力。本研究从鸡的泄殖腔中分离鉴定出34株大肠杆菌,并对其进行iss基因检测和致病力的分析,以探求他们之间的关系。
1 材料与方法
1.1试剂 三糖铁琼脂、麦康凯培养基购自北京奥博星生物技术责任有限公司;伊红美蓝培养基购自青岛日水生物技术有限公司;微量生化反应管均购自杭州天和微生物试剂有限公司;过氧化氢溶液购自天津基准化学试剂公司;KOD-plus-NEO购自东洋纺生物科技有限公司;DL 2000 DNA marker 购自Takara公司。
1.2菌种 H L 1~3 4为分离的鸡大肠杆菌,CVCC1553、CVCC1562、CVCC1568、CVCC1551购自中国兽药监察所。
1.3大肠杆菌的分离 将采集的泄殖腔拭子置于5 mL LB培养基中,37℃震荡培养6~8 h后,用该菌液于伊红美蓝固体培养基上划线,37℃培养8~12 h,挑取深紫色带有金属光泽的单菌落于麦康凯固体培养基上划线培养,反复多次,进行革兰氏染色,镜检,观察菌落形态。
1.4生化试验 将初步分离到的可疑菌落进行吲哚试验、MR试验、VP试验、淀粉酶试验、枸橼酸盐利用试验,乳糖、麦芽糖、蔗糖、木糖、葡萄糖、甘露糖、甘露醇发酵试验,产硫化氢试验、尿素酶试验,触酶试验,运动性试验,三糖铁斜面穿刺试验,观察试验结果。
1.5鸡胚致死试验 参考文献[6]将待测大肠杆菌分别划板,挑取平板上的单菌落,于LB液体培养基中37℃摇床过夜培养,然后离心,经PBS洗2次,并用PBS悬浮,进行倍比稀释。取0.1 mL稀释液经尿囊腔接种12日龄SPF鸡胚(购自聊城阳谷孵化厂),大约100~300 CFU/只,每组10只。同时取0.1 mL稀释液涂板,做细菌计数。对照组分两组,一组注射PBS,一组不注射。计每日死亡数,至d 4,计胚胎致死率。
1.6套式PCR 使用套式PCR,引物序列参考文献[7]。上游引物1:5'-AGCTATCGTTTAATTATTATC AC-3',下游引物1:5'-GTAGGGAGCCCA GAAGTAT-3'。上游引物2:5'CGCGGATCCAGGAT TCTGCCGTTTTTA-3',下游引物2:5'-CGCGTCGA CCATATCGATGGGCAACTA-3'。PCR反应体系:5×buffer 5μL、dNTP 4 μL、MgSO44 μL、上下游引物各1.5 μL、KOD-plus-NEO 0.5 μL、ddH2O 30.5 μL、模板3 μL。第一轮程序:97℃预变性5 min;94℃变性 1 min,47℃退火 1 min,68℃延伸0.5 min,9个循环;95℃变性 1 min,68℃ 0.5 min,25个循环;68℃终延伸10 min。第二轮程序:95℃预变性 5 min;95℃ 变性1 min,47℃退火 1 min,68℃延伸 0.5 min,28个循环;68℃终延伸10 min。
2 结果
2.1分离结果 分离的34株细菌在伊红美蓝培养基上呈紫黑色并带金属光泽,在麦康凯培养基上呈桃红色,符合大肠杆菌的培养特性,镜检可以观察到革兰氏阴性、两端钝圆小杆菌,散在或成对出现,并无其他形态菌,可以初步鉴定为大肠杆菌的纯培养物。
2.2生化试验结果 将分离出的34株大肠杆菌分别命名为HL1~34。34株细菌三糖铁斜面穿刺试验均为上下一致黄色,琼脂分层,产气。生化试验中34株菌均能发酵乳糖、葡萄糖、麦芽糖、甘露醇,26株发酵蔗糖,31株发酵木糖,33株发酵甘露糖。运动性试验中仅有1株菌运动性呈阴性,其他均为阳性。IMViC试验中,吲哚(I)试验均为阳性,甲基红(M)试验均为阳性,VP(V)试验均为阴性,枸橼酸盐(C)利用试验均为阴性。产硫化氢(H2S)试验均为阴性,尿素酶试验均为阴性,触酶试验均为阳性(表1,2)。

表1 大肠杆菌HL1~17分离株的生化特性Table 1 Results of biochemical characteristics of HL1~17
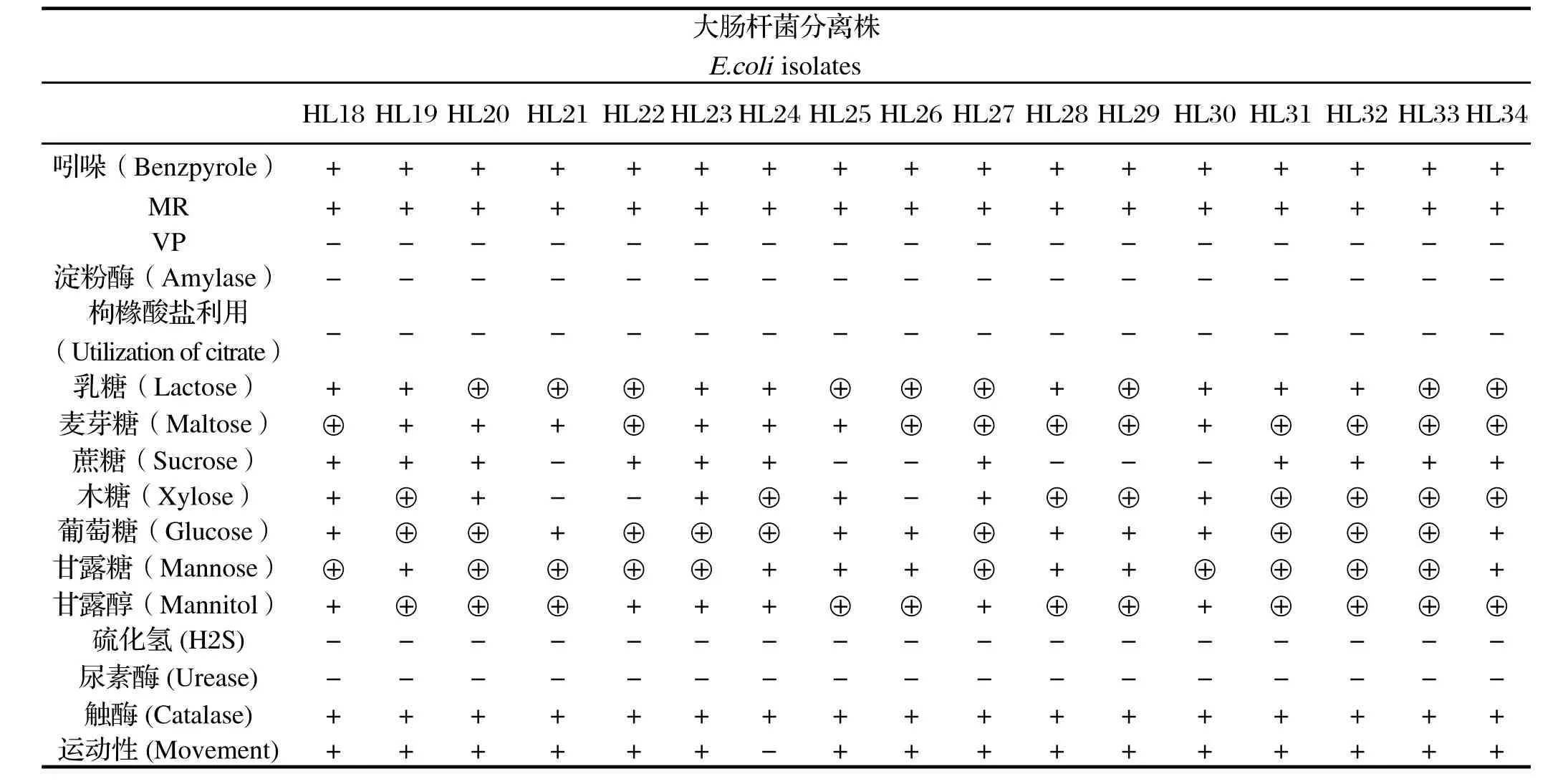
表2 大肠杆菌HL18~34分离株的生化特性Table 2 Results of biochemical characteristics of HL18-34
2.3鸡胚致死试验 38株大肠杆菌鸡胚致死试验中,6株致死率为0%,5株致死率为10%,5株致死率为20%,3株致死率为30%,6株致死率为40%,5株致死率为50%,4株致死率为60%,2株致死率为70%,2株致死率为80%,对照PBS组、未注射组均无死亡,具体结果见表3。
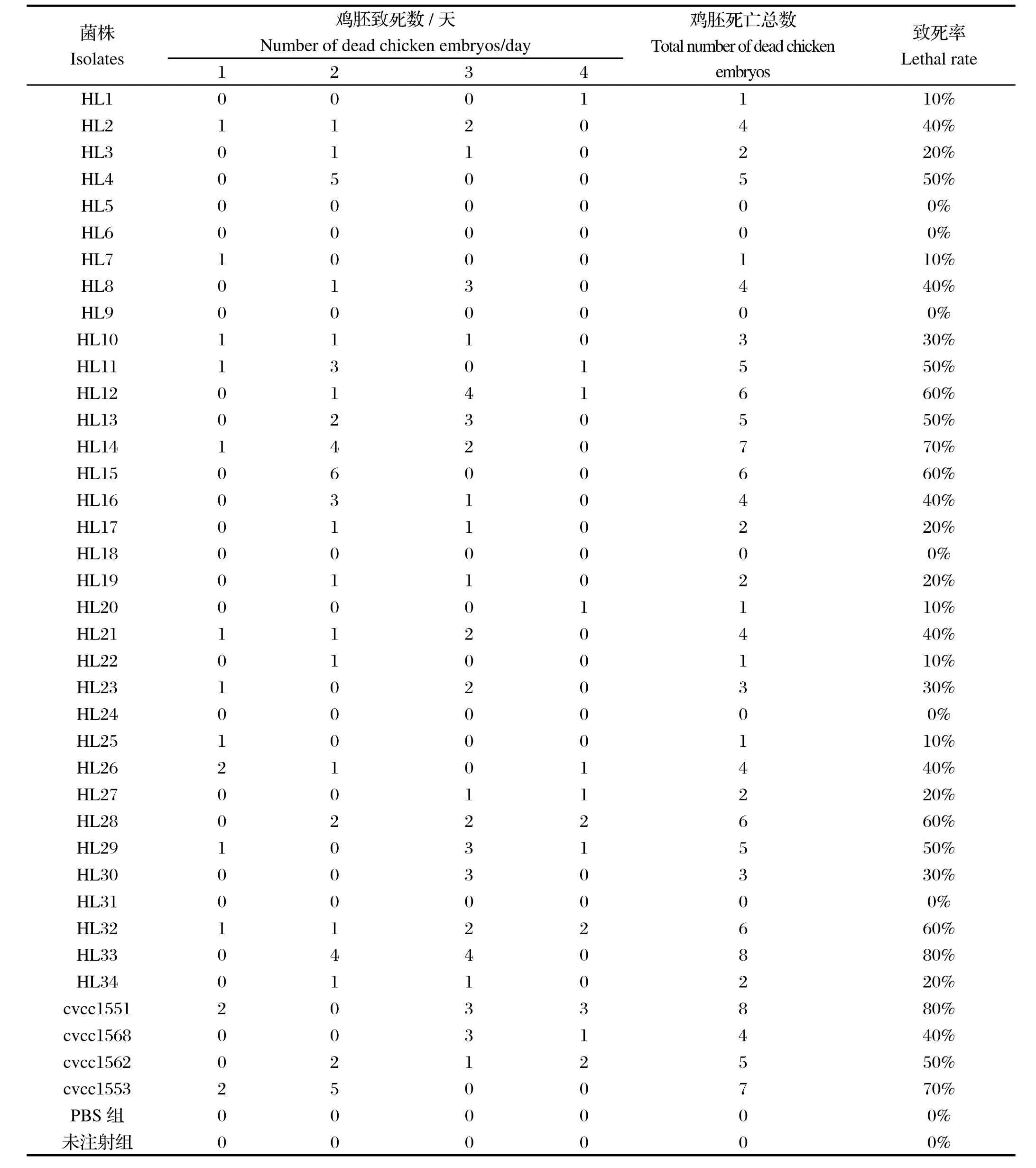
表3 大肠杆菌分离株鸡胚致死结果Table 3 Results of lethality test of E.coli isoloates in chicken embryos
用SPSS19.0进行分析,90%置信区间为(25.1%,38.4%),其中19株为致病力较强菌株,分别为HL2、HL4、HL8、HL11、HL12、HL13、HL14、HL15、HL16,HL21、HL26、HL28、HL29、HL32、HL33、CVCC1551、CVCC1553、CVCC1562、CVCC1568;16株为致病力较弱或无致病力菌株,分别为HL1、HL3、HL5、HL6、HL7、HL9、HL17、HL18、HL19、HL20、HL22、HL24、HL25、HL27、HL31、HL34;3株为中等致病力菌株,分别为HL10、HL23、HL30。
2.4套式PCR检测结果 经第一轮PCR检测发现33株菌株第一轮PCR均可检测到大小为416 bp的iss基因扩增片段,5株菌在该位置条带模糊或不可见,但第二轮PCR均可扩增出大小为363 bp的iss基因片段,结果如图1、图2所示。
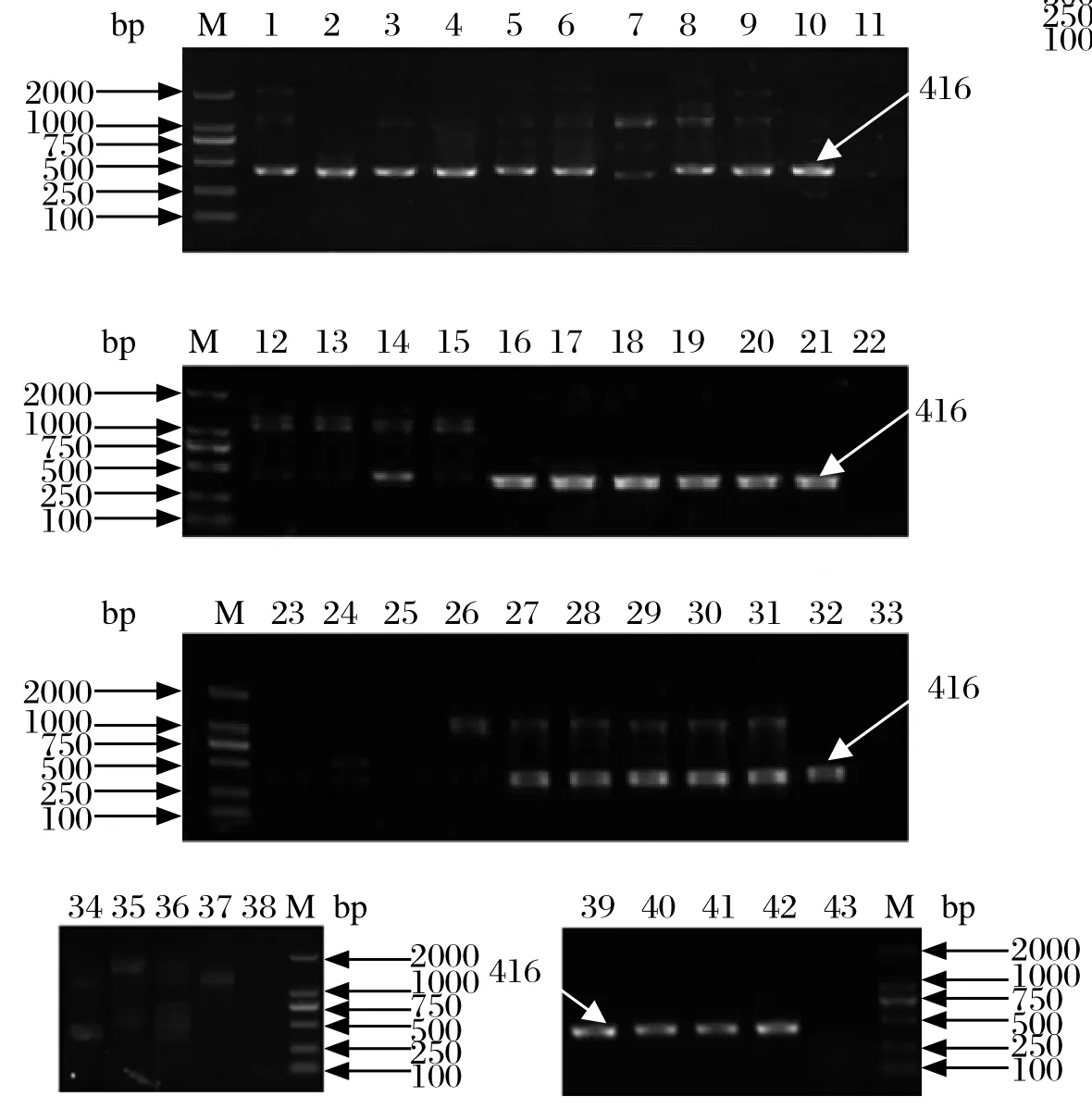
图1 大肠杆菌iss基因第一轮PCR扩增结果Fig. 1 Electrophoretogram of one step PCR amplifi cation for iss gene
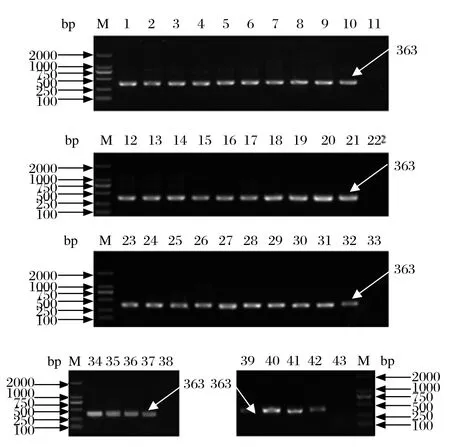
图2 大肠杆菌iss基因第二轮PCR扩增结果Fig. 2 Electrophoretogram of nested PCR amplifi cation for iss gene
3 讨论
本研究分离了34株大肠杆菌,其中有些菌株生化特性较特殊,与大多数菌株不同。HL4、HL7、HL21、HL25、HL26、HL28、HL29、HL30共8株不发酵蔗糖。王廷富等[8]分离的96株大肠杆菌有57株不发酵蔗糖;周继勇等[9]分离的13株大肠杆菌中有4株不发酵蔗糖。刘玉涛等[10]分离的12株大肠杆菌中有6株不发酵蔗糖。张遂平等[11]分离的50株大肠杆菌均不发酵蔗糖,HL21、HL22、HL26不发酵木糖。王廷富等[8]分离的96株大肠杆菌有1株不发酵木糖,共有15株运动性呈阴性。
iss基因是大肠杆菌的重要毒力因子,能够增强大肠杆菌在血清中的存活能力,有很多学者认为iss基因的存在与大肠杆菌的致病力高度相关[4,12]。本研究采用套式PCR对iss基因进行检测,大多数菌株均可由PCR检测出iss基因,仅少数菌株(HL24、HL31-34)第一轮PCR条带较为模糊或不可见,但是第二轮PCR均有明亮条带,iss基因检测阳性率为100%,因此我们推测iss基因在大肠杆菌中是广泛存在的。但是致病力试验结果表明,各大肠杆菌的致病力是有区别的,由此推断,iss基因的存在和大肠杆菌的毒力无关。不同菌株中iss基因的拷贝数是不同的[13]。这也可能是很多研究学者采用多重PCR或其他普通PCR方法检测大肠杆菌时,iss 基因检出率并未达到100%的原因之一。Jenog等[14]运用普通PCR方法检测101株大肠杆菌,发现其中78.2%的菌株可检测到 iss 基因。Catana等[7]通过多重PCR对121株大肠杆菌进行检测,发现63.6%的大肠杆菌能检测到iss基因。Mohamed等[15]通过普通PCR检测发现121株大肠杆菌中72.2%的菌株有iss基因。
胚胎致死试验可作为检验鸡大肠杆菌致病力强弱的一种方法[17]。Gibbs等[18]通过检测多种毒力因子与鸡胚致死结果相比较后发现,鸡胚致死试验可以提供一种判断大肠杆菌是否具有毒力的检测手段。Borst等[19]通过盲肠肠球菌接种雏鸡和鸡胚,发现鸡胚致死试验为理解毒力的遗传学基础提供了一种有效的手段,但鸡胚不能控制感染及表现典型的败血症特征。Oh等[20]研究了大肠杆菌毒力基因与其致病力的关系。本研究细菌稀释液经尿囊腔接种12日龄SPF鸡胚,连续观察4 d,结果用SPSS 19.0进行90%置信区间分析。其中50%为致病力较强菌株,42.1%的菌株为致病力较弱或无致病力菌株,7.9%为中等致病力菌株,未见鸡胚致死率达100%的菌株。致病力试验进一步证明了iss基因的存在与菌株毒力关系没有直接的关系。
综上所述,iss基因在大肠杆菌中可能是广泛存在的,大肠杆菌的毒力与iss基因的存在无关,但iss基因对毒力影响机制及iss基因序列差异对毒力影响还需进一步的研究验证。
[1] 冯元璋. 鸡大肠杆菌病[J]. 中国兽医科技, 1989, (1): 20-22.
[2] Bekal S, Brousseau R, Masson L, et al. Rapid identification of Escherichia coli pathotypes by virulence gene detection with DNA microarrays[J]. J Clin Microbiol, 2003, 41(5): 2113-2125.
[3] Dho-Moulin M, Fairbrother J M. Avian pathogenic Escherichia coli (APEC)[J]. Vet Res, 1999, 30(2-3): 299-316.
[4] Binns M M, Davies D L, Hardy K G. Cloned fragments of the plasmid ColV,I-K94 specifying virulence and serum resistance[J]. Nature, 1979, 279(5716): 778-781.
[5] Binns M M, Mayden J, Levine R P. Further characterization of complement resistance conferred on Escherichia coli by the plasmid genes traT of R100 and iss of ColV, I-K94[J]. Infect Immun, 1982, 35(2): 654-659.
[6] 樊琛, 刘桂芹, 李丹丹, 等. 鸡胚致死率作为检验鸡大肠埃希菌致病力指标的探讨[J]. 动物医学进展, 2010,31(6): 121-124.
[7] Catana N, Popa V, Fodor I. Binding of Congo Red,phenotypical marker for discrimination of apec strains[J]. Lucrari Stiintifice - Universitatea de Stiinte Agricole a Banatului Timisoara, Medicina Veterinara, 2009.
[8] 王廷富, 房海, 陈翠珍. 鸡大肠杆菌病的病原学研究[J].河北农业技术师范学院学报, 1987, (2): 25-32.
[9] 周继勇, 敖平. 四川部分地区雏鸡大肠杆菌病病原分离及鉴定[J]. 四川畜牧兽医, 1993, (3): 10-11.
[10] 刘玉涛, 吴学敏, 陈如敬, 等. 福建省鸡源大肠杆菌的分离鉴定及药敏试验[J]. 中国农学通报, 2014,(2): 65-68.
[11] 张遂平, 杨建春, 邵艳华. 鸡大肠杆菌分离及药敏试验研究[J]. 中国畜牧业, 2013, (2): 62-63.
[12] Gibbs P S, Maurer J J, Nolan L K, et al. Prediction of chicken embryo lethality with the avian Escherichia coli traits complement resistance, colicin V production, and presence of the increased serum survival gene cluster (iss)[J]. Avian Dis, 2003, 47(2): 370-379.
[13] 樊琛, 王宇, 王亚君, 等. iss基因与鸡大肠杆菌致病力的关系[J]. 中国兽医科学, 2010, (1): 55-60.
[14] Jeong Y W, Kim T E, Kim J H, et al. Pathotyping avian pathogenic Escherichia coli strains in Korea.[J]. J Vet Sci,2012, 13(2): 145-152.
[15] Mohamed M A, Shehata M A, Rafeek E. Virulence genes content and antimicrobial resistance in Escherichia coli from broiler chickens[J]. Vet Med Int, 2014, 2014: 195189.
[16] 樊琛, 王亚君, 李一经. iss基因与鸡大肠杆菌毒力相关性的分析[J]. 畜牧兽医学报, 2005,36(1): 58-61.
[17] Gibbs P S, Maurer J J, Nolan L K, et al. Prediction of chicken embryo lethality with the avian Escherichia coli traits complement resistance, colicin V production, and presence of the increased serum survival gene cluster (iss). [J]. Avian Dis, 2003, 47(47): 370-379.
[18] Borst L B, M Mitsu S, Shivaramu K, et al. A chicken embryo lethality assay for pathogenic Enterococcus cecorum.[J]. Avian Dis, 2014, 58(2): 244-248.
[19] Oh J Y, Kang M S, Yoon H, et al. The embryo lethality of Escherichia coli isolates and its relationship to the presence of virulence-associated genes[J]. Poult Sci,2012, 91(2): 370-375.
ISOLATION AND PATHOGENICITY OF 34 STRAINS OF ESCHERICHIA COLI FROM CHICKENS
XU Wang-ye1, FAN Chen2, QIAO Xin-yuan1, TANG Li-jie1, LIU Min1, WANG Li1,XU Yi-gang1, JIANG Yan-ping1, CUI Wen1, LI Yi -jing1
(1. College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China; 2. Agricultural College of Liaocheng University, Liaocheng 252059, China)
A total of 34 E.coli trains were isolated and identifi ed from chicken cloacal samples. These strains along with other 4 strains purchased from China Institute of Veterinary Drugs Control were inoculated into chicken embryos to examine their virulence. The software SPSS 19.0 was applied to calculate a 90% confi dence interval. Among tested 38 strains, 19 strains were virulent strains as their rates of lethality were higher than the upper limit 38.4%, 16 strains were least or non-pathogenic as their rates of lethality were lower than the lower limit 25.1% and the remaining 3 strains were medium virulent as their rates of lethality were between the upper and lower limits. The iss (increase serum survival) gene was detected in nested PCR and the positive rate was 100%. The result showed that the presence of the iss gene in E.coli was ubiquitous while the virulence of these 38 strains was different, which suggested that the iss gene was not relevant to virulence of E.coli.
E.coli; pathogenicity; nested PCR; iss gene, isolation; identifi cation
S852.612
A
1674-6422(2016)05-0041-07
2016-01-28
国家自然科学基金(31302128);国家级大学生创新创业训练计划创新训练项目(201410447041);国家级大学生创新创业训练计划创新训练项目(201410447039)
徐旺烨,女,硕士研究生,预防兽医学专业
李一经,E-mail:yijingli@163.com

