中华蜜蜂触角特异蛋白AcerASP4结合特性研究
邓培渊, 李俊杰, 李玉华, 王林青, 李长看
(1.郑州师范学院生物物种资源研究中心,河南 郑州 450044;2.郑州市生物物种资源研究重点实验室,河南 郑州 450044;3.郑州市电子信息工程学校,河南 郑州 450007)
中华蜜蜂触角特异蛋白AcerASP4结合特性研究
邓培渊1,2, 李俊杰3, 李玉华1, 王林青1, 李长看1
(1.郑州师范学院生物物种资源研究中心,河南 郑州 450044;2.郑州市生物物种资源研究重点实验室,河南 郑州 450044;3.郑州市电子信息工程学校,河南 郑州 450007)
运用反转录RT-PCR克隆和正确表达了中华蜜蜂AcerASP4基因,通过荧光竞争结合实验测定重组AcerASP4蛋白与29种配基结合特性,发现其与辛醛、苯甲醛、顺-茉莉酮、吲哚、苯基乙醇和十六酸甲酯结合,解离常数分别为7.91、10.49、11.89、13.93、26.10、37.31 μmol·L-1,据此推测AcerASP4参与了中华蜜蜂对这6种气味分子识别的生理过程。
中华蜜蜂;气味结合蛋白;荧光竞争结合实验;解离常数
中华蜜蜂Apisceranacerana(简称中蜂)是生活于中国境内东方蜜蜂的地理品种,其嗅觉灵敏并具有强烈的排异性,抗螨能力强,能够利用零星分散的蜜粉源,是中国重要的饲养蜂种之一。中蜂的优良性状和抗螨能力与敏锐嗅觉系统密不可分[1],昆虫嗅觉的敏感性与对其气味信息物质的精确识别及信号传导相关[2],而气味结合蛋白(Odorant Binding Proteins,OBPs)和化学感受蛋白(Chemosensory Proteins,CSPs)直接参与了嗅觉感器与外界气味分子的化学反应[3]。已有的研究表明,OBPs是一类低相对分子质量水溶性酸性蛋白,典型结构具有6个保守的半胱氨酸[4],OBPs主要存在于昆虫嗅觉感受器(触角)胞外的淋巴液中,其作用是结合并转运脂溶性的气味分子通过亲水性的淋巴液到达嗅觉神经树突末梢[5],根据其结合的配体类型、同源性和感受器上表达类型OBPs进一步分为性信息素结合蛋白质(Pheromone-Binding Protein,PBPs)、普通气味结合蛋白质(General Odorant-Binding Proteins,GOBPs)和其他类型的触角气味结合蛋白[6]。DANTY等[7]首次发现了3种触角特异蛋白ASP(Antenna Special Protein):ASP1,ASP2和ASP3,后来的研究发现ASP1为性信息素结合蛋白PBP[8],ASP2为普通气味结合蛋白GOBP[9],ASP3为化学感受蛋白CSP[10],但未见对中华蜜蜂ASP4的研究报道。为此,本研究运用反转录RT-PCR方法克隆中华蜜蜂AcerASP4基因,在细菌中表达后纯化,以1-NPN为荧光探针,进行荧光竞争结合实验,测定AcerASP4蛋白与主要绿色植物挥发物和虫害诱导植物挥发物[11]的结合特性,以期为阐明中华蜜蜂嗅觉发生的分子机制提供参考。
1 材料与方法
1.1主要试剂、材料和仪器
中华蜜蜂工蜂触角cDNA为重庆医科大学卢楠博士惠赠;限制性内切酶、TaqDNA聚合酶、T4 Ligase连接酶、IPTG和低分子量蛋白标准品购自大连宝生物;荧光探针1-NPN和配基化合物为Sigma公司产品;DE-52柱材料为Whatman产品,AKTA蛋白纯化系统和分子筛Superose-12预装柱为GE公司产品,荧光光谱仪为Jasco FP-750;pET-30b(+)、DH10B和BL21(DE3)菌株为郑州市生物物种资源研究重点实验室保存。其他试剂均为国产分析纯。
1.2AcerASP4基因的克隆、表达和纯化
1.2.1 引物的设计与合成 从NCBI查取AcerASP4(ID:AY392756.1)的CDS序列,运用在线软件http://www.cbs.dtu.dk/services/SignalP/预测其信号肽序列,依据成熟编码区序列设计引物如下:AcerASP4-Forward(5’-3’):ATcatatgCGTCCA
GACGAATCT;AcerASP4-Reverse(5’-3’):GCgaa
ttcTTAACATTAATGCGC。小写字母为酶切位点序列,酶切位点之前为保护碱基,引物由苏州金唯智生物科技有限公司合成。
1.2.2AcerASP4的克隆、表达和纯化AcerASP4扩增体系如下:10×PCR Buffer 2 μL,dNTP mix 1.6 μL,cDNA 约50 ng,Taq酶(5 U·μL-1)0.2 μL,上、下游引物(10 μmol·L-1)各1 μL,ddH2O补至20 μL。反应程序:94 ℃预变性4 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,共35个循环,72 ℃保温10 min,ddH2O替代cDNA作空白对照。
扩增产物纯化后用Nde I和EcoR I双酶切,与经同样双酶切的表达载体pET-30b(+)连接,产物转化DH10B感受态细胞,经菌液PCR检测后得到重组表达载体pET/30b-AcerASP4,并送苏州金唯智生物科技有限公司测序验证;正确的pET/30b-AcerASP4转化BL21(DE3)感受态细胞,挑取单克隆在含10 μg·mL-1,卡纳青霉素的LB培养基中37 ℃过夜培养,再以1∶100的比例加入新鲜培养基,震荡培养到OD600值为0.7时,加入IPTG(浓度为0.6 mmol·L-1)诱导,3 h后SDS-PAGE检测。
扩大培养pET/30b-AcerASP4,经离心后收集菌体,超声破碎后检测重组蛋白的表达形式,若为包涵体用Urea+DTT裂解,用50 mmol·L-1, Tris-HCl (pH 7.4)透析3次复性。依次经阴离子交换树脂(DE-52柱材料)和分子筛(Superose-12柱材料)进行纯化。
1.3荧光竞争结合试验
1.3.1 测定AcerASP4蛋白与1-NPN解离常数 参照LI等[12]和QIAO等[13]的方法,设置荧光光谱仪337 nm激发光,扫描300~500 nm范围的波谱范围,在5 μmol·L-1AcerASP4蛋白中依次加入1-NPN,终浓度为2~10 μmol·L-1,反应3 min,稳定后记录荧光峰值的蓝移在5 μmol·L-1AcerASP4蛋白中加为入5 μmol·L-1的1-NPN,放置3 min,加入0~40 μmol·L-1的外源配基(表1),扫描350~500 nm范围,荧光强度稳定后记录峰值荧光强度。所得数据3次测定的平均值。
1.3.2 测定AcerASP4蛋白与配基的解离常数 在5 μmol·L-1AcerASP4蛋白中加入10 μmol·L-1的1-NPN,放置2 min,加入0~40 μmol·L-1的外源配基(表1),扫描350~500 nm范围,荧光强度稳定后记录强度值。所得数据均为3次数据的平均值。
1.3.3 数据的统计与分析 运用GraphPad Prism 5软件统计AcerASP4蛋白与荧光探针1-NPN的解离常数K[1-NPN]。
运用SPSS Statistics 17.0软件统计配基与AcerASP4蛋白结合的IC50值。
假定AcerASP4蛋白活性为100%,与配基饱和结合的比例是1∶1,根据IC50值计算竞争配基的解离常数。
公式:Ki=IC50/(l+[1-NPN]/K[1-NPN])
其中,[1-NPN]为游离状态的1-NPN浓度。
2 结果与分析
2.1AcerASP4基因的扩增和表达载体的构建
分别以工蜂触角cDNA和清水为模板扩增AcerASP4基因,结果如图1所示。从图1可以看出,以cDNA为模板扩增有单一条带出现,清水则无此条带,说明AcerASP4基因正确扩增。AcerASP4与pET-30b(+)连接结果经PCR检测和测序验证均表明AcerASP4完整且连接成功。
M:Maker DL200;1:AcerASP4基因扩增结果;2:空白对照。
M:Maker DL200;1:Amplification product ofAcerASP4 gene;2: Blank.
图1AcerASP4基因扩增结果
Fig.1AmplificationproductofAcerASP4gene
2.2AcerASP4基因在细菌中的表达和纯化
pET/30b-AcerASP4经IPTG诱导后,SDS-PAGE分析发现在14.3 kD左右有一条特异性条带出现(图2泳道2),而IPTG诱导的空载体pET-30b(+)则无此条带(图2泳道1),表明AcerASP4基因在细菌中正确表达。
重组AcerASP4蛋白经检测大部分以可溶性形式存在于上清液中,经离子交换层析和分子筛纯化后得到重组蛋白,结果如图2泳道3所示:蛋白的
相对分子质量大小正确且无明显的杂带,说明重组AcerASP4纯化质量较高,可以用于下一步的荧光竞争结合试验。
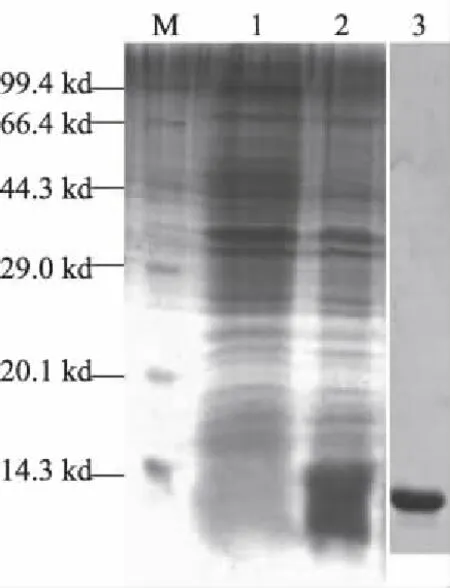
M:蛋白相对分子质量标准;1:诱导的pET-30b (+);2:诱导的pET/30b-AcerASP4;3:纯化后的AcerASP4蛋白。
2.3荧光竞争结合试验
在25 ℃恒温条件下,337 nm的发射光激发1-NPN,在475 nm处有小波峰,扫描AcerASP4蛋白无明显波峰,AcerASP4蛋白与1-NPN混合物,在约400 nm处出现波峰,峰值明显增强。在5 μmol·L-1,AcerASP4蛋白中加入2~10 μmol·L-11-NPN后400 nm处波峰强度逐渐增加(图3),计算得AcerASP4蛋白与1-NPN的解离常数K[1-NPN]为7.75 μmol·L-1。
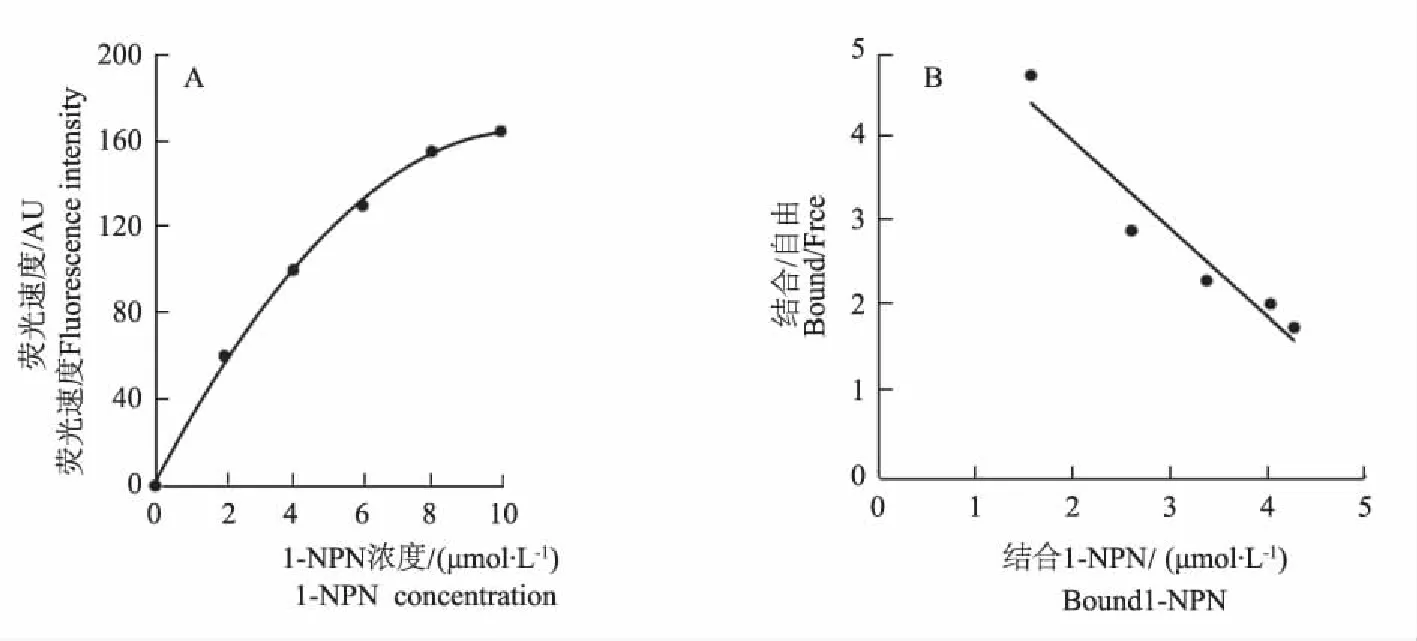
图3 AcerASP4蛋白与1-NPN结合曲线(A)和Scathard方程(B)Fig.3 Binding curse(A) and Scathard plot of AcerASP4 to 1-NPN
在25 ℃恒温条件下,测定AcerASP4蛋白与29种配基的结合能力如图4和表1所示,6种配基化合物与AcerASP4蛋白结合,其中辛醛结合能力最强,解离常数为7.91 μmol·L-1,苯甲醛、顺-茉莉酮和吲哚次之,解离常数分别为10.49、11.89、13.93 μmol·L-1,苯基乙醇和十六酸甲酯结合能力较弱,解离常数分别为26.10、37.31 μmol·L-1,其他配基化合物浓度为40 μmol·L-1时荧光强度无明显变化,如对甲基苯酚。
3 结论与讨论
昆虫气味结合蛋白能灵敏识别、筛选和转运外界的气味分子,在昆虫的寄主定位、寻找配偶等生理活动中起重要作用,其中对气味分子的选择性结合是关键的一步[14]。本研究克隆和表达了中华蜜蜂AcerASP4蛋白,纯化的重组蛋白运用荧光竞争结合实验分析其结合特性,由于AcerASP4蛋白中有一色氨酸Try131,在295 nm激发光作用下在337 nm处有内源荧光,表明该残基处于蛋白质结合腔内[15],加入1-NPN后外源荧光替代内源荧光并增强,说明1-NPN结合于色氨酸附近,位于蛋白质的结合腔内[16];荧光竞争结合试验基于配基取代1-NPN与蛋白结合从而分析蛋白结合特性。
注:当外源配基浓度达到40 μmol·L-1时荧光强度无明显变化,则IC50和Ki值标记为空白。
Note:If the flurorescence intensity has no obvious change when external ligand concentrations reached 40 μmol·L-1,theIC50andKiwas recorded as blank.
在荧光竞争结合试验中所用的29种气味分子包括绿叶植物挥发物、普通气味分子和虫害诱导挥发物3大类,试验结果发现与AcerASP4蛋白结合的有6种配基,其中辛醛、苯甲醛和十六酸甲酯为普通气味分子,顺-茉莉酮为绿叶植物挥发物,吲哚为虫害诱导挥发物[13],可见AcerASP4蛋白具有广谱结合特性;但醛类物质具有较强的结合能力,可能是醛基工蜂触角感受器淋巴液中溶解度较高,易于被中蜂识别,但对甲氧基苯甲醛却不结合,推测可能是由于苯环上的甲氧基团的存在改变了淋巴液的pH值和亲水性,使配基不能进入蛋白结合位点附近结合[17]。
JIANG等[18]研究发现,外源气味配基结合能力与碳原子数相关,而本研究中发现配基的结合能力与碳原子数不存在正相关关系,配基上的基团对结合能力的影响更大,这可能是由于不同的OBPs类型或者OBPs在不同物种间的作用方式存在差别,也可能是基团的性质影响了蛋白疏水性结合腔的微环境从而影响了配基的结合,部分研究也证实也这一点[19]。OBPs不同亚类具有不同的结合特性,PBPs主要结合昆虫性息素,GOBPs主要结合植物挥发物[20],本试验中3种结合能力强的配基(解离常数小于20 μmol·L-1)中辛醛能吸引寄生苹果蠢蛾Cydiapomouella的苍白宽口姬小蜂Hyssopuspallidus,其可能是一种昆虫信息素成份[21],苯甲醛和顺-茉莉酮为果实和绿色植物挥发物[14],之前有研究发现与中蜂AcerASP1为PBPs[8],AcerASP2为GOBPs[9],AcerASP3为CSPs[10]。可见AcerASP4具有部分PBP和GOBP的结合特征,推测其可能对AcerASP2和AcerASP2的生理功能起补充作用。
[1] TSURUDA J M, HARRIS J W, BOURGEOIS L, et al. High-resolution linkage analyses to identify genes that influence varroa sensitive hygiene behavior in honey bees[J]. PLoS ONE, 2012, 7(11):48-76.
[2] ARECHAVALETA-VELASCO M E, ALCALA C K, ROBLES R C, et al. Fine-scale linkage mapping reveals a small set of candidate genes influencing honey bee grooming behavior in response to varroa mites[J]. PLoS ONE, 2012, 7(11):47-69.
[3] KO H J, PARK T H . Enhancement of odorant detection sensitivity by the expression of odorant-binding protein[J]. Biosensors and Bioelectronics, 2008, 23 (7):1017-1023.
[4] KRIEGER J, BREER H. Olfactory reception in invertebrates[J]. Science, 1999, 286:720-723.
[5] PELOSI P, ZHOU J J, BAN L P, et al. Soluble proteins in insect chemical communication[J]. Cellular and Molecular Life Sciences, 2006, 63(14):1658-1676.
[6] VOGT R G, CALLAHAN F E, ROGERS M E. Odorant binding protein diversity and distribution among the insect orders, indicated by LAP, an OBP2-related protein of the true bugLyguslineolaris(Hemiptera, Heteroptera)[J].Chemical Senses,1999, 24(5): 481-495.
[7] DANTY E, ARNOLD G, HUET J C, et al. Separation, characterization and sexual heterogeneity of multiple putative odorant-binding proteins in the honeybeeApismelliferaL.(Hymenoptera: Apidea)[J]. Chemical Senses, 1998, 23(1): 83-91.
[8] DANTYE E, BRIAND L, MICHARD-VANHЁE C, et al . Cloning and expression of a queen pheromone-binding protein in the honeybee; an olfactory-specific, developmentally regulated protein[J]. J Neurosci, 1999, 19: 7468-7475.
[9] BRIAND L, NESPOULOUS C, HYET J C,et al. Ligand binding and physico-chemical properties of ASP2, a recombinant odorant-binding protein from honeybee (ApismelliferaL.)[J]. European Journal of Biochemistry, 2001, 268(3):752-760.
[10] LI H L, LOU B G, CHENG J A, et al. The chemosensory protein of Chinese honeybee,Apisceranacerana: Molecular cloning of cDNA, immunocytochemical localization and expression[J].Chinese Science Bulletin, 2007, 52(10):1355-1364.
[11] 祝传书,赵惠燕. 虫害诱导的植物挥发物[J]. 西北农林科技大学学报(自然科学版), 2003, 31(增刊):183-186.
[12] LI S, PICIMBON J F, JI S D, et al. Multiple functions of an odorant binding protein in the mosquitoAedesaegypti[J]. Biochemical and Biophysical Research Communications, 2008,372: 464-468.
[13] QIAO H L, DENG P Y, LI D D, et al. Expression analysis and binding experiments of chemosensory proteins indicate multiple roles inBombyxmori[J]. Journal of Insect Physiology, 2013, 59:667-675.[14] PELOSI P, MAIDA R. Odorant-binding proteins in insects[J]. Comp Biochem Physiol, 1995, 111:503-514.
[15] SANDLER B H, NOKONOVA L, LEAL W S, et al. Sexual alamaction in the silkworm moth structure of the pheromone binding protein bombykol complex[J]. Chemistry and Biology, 2000,7: 143-151.
[16] ZHOU J J, ROBERTSON G, HE X L , et al. Characterisation ofBombyxmoriodorant binding proteins reveals that a general odorant-binding protein discriminates between sex pheromone components[J]. J Mol Biol, 2009, 389:529-545.
[17] 孙红岩,尹娇,冯红林,等. 草地螟普通气味结合蛋白I ( LSti-GOBP1)蛋白表达纯化及结合特性分析[J].昆虫学报, 2011, 54 (4):381-389.
[18] JIANG Q Y, WANG W X, ZHANG Z D, et al, Binding specificity of locust odorant binding protein and its key binding site for initial recognition of alcohols[J]. Insect Biochemistry and Molecular Biology, 2009, 39:440-447.
[19] 邓培渊,乔惠丽,李丹丹,等. 家蚕化学感受蛋白BmCSP4表达谱及结合特性分析[J].昆虫学报, 2011, 54(8):869-876.
[20] 李卫华, 涂洪涛, 苗雪霞,等.昆虫嗅觉相关蛋白的研究进展[J]. 昆虫知识, 2006,43(6):757-762.
[21] ROTT A S, HCKERMANN J, BRAND N, et al . Parasitoid exploitation of the seasonal variation in host plant volatile emission for herbivore locanon[J].Entomologia Experimerrtalis et Applicata, 2005, 115 (1):199-205.
(责任编辑:蒋国良)
StudyonbindingspecificityofantennaspecialproteinAcerASP4inChineseHoneybee(Apisceranacerana)
DENG Peiyuan1,2, LI Junjie3, LI Yuhua1, WANG Linqing1, LI Changkan1
(1.Biological Species Resource Research Centre, Zhengzhou Normal University, Zhengzhou 450007, China;2.Zhengzhou Biological Species Resource Research Key Laboratory, Zhengzhou 450044, China;3.Zhengzhou Electronic and Information Engineering School, Zhengzhou 450007, China)
AcerASP4 gene ofApisceranaceranawas cloned using reverse transcription PCR and expressed correctly, and the binding specificity of AcerASP4 to 29 ligands were tested through fluorescence competitive binding assay. The results showed that octanal, benzaldehyde, cis-jasmone, indole, phenethyl alcohol and methyl palmitate could bind to AcerASP4 with the dissociation constants of 7.91, 10.49, 11.89, 13.93, 26.10 and 37.31 μmol·L-1respcetively, with suggests that AcerASP4 may be involved in the physiological process of discriminating those six odor molecules.
Apisceranacerana; odorant binding protein; fluorescence competitive binding assay; dissociation constant
2016-03-29
河南省科技攻关重点项目(132102110175)
邓培渊(1981-),男,河南登封人,讲师,博士,从事昆虫分子生物学方面的研究。
1000-2340(2016)06-0772-06
Q966
:A

