巴西橡胶树HbMlo1-1基因克隆及其表达
何海霞, 张 宇, 王 萌, 李晓娜, 杨 叶, 郑服丛
(1.海南大学环境与植物保护学院,海南 海口570228; 2.中国热带农业科学院科技信息研究所,海南 儋州571737)
巴西橡胶树HbMlo1-1基因克隆及其表达
何海霞1, 张 宇1, 王 萌1, 李晓娜2, 杨 叶1, 郑服丛1
(1.海南大学环境与植物保护学院,海南 海口570228; 2.中国热带农业科学院科技信息研究所,海南 儋州571737)
为探究Mlo基因在巴西橡胶树(HeveabrasiliensisMuell. Arg.)中的功能,利用橡胶树‘热研7-33-97’的叶片转录组文库,扩增得到橡胶树Mlo基因,并对其进行基因表达分析。该基因推导的蛋白质大小为57.76 kD,由510个氨基酸编码组成。蛋白结构分析发现其具有一个Mlo蛋白特征性的Mlo Superfamily保守结构域,含有7个跨膜结构域,无信号肽,无核定位信号,定位在内质网膜上。这与HbMlo1和AtMlo1的结构相似性很高,被命名为HbMlo1-1。基因表达分析发现,该基因主要在橡胶树的树皮中表达,其表达量在机械伤害、白粉菌作用下显著上调。干旱诱导HbMlo1-1基因表达水平显著下降。IAA、ETH、JA、H2O2均能诱导HbMlo1-1基因上调表达。说明HbMlo1-1参与橡胶树植物激素信号传导途径和抗逆响应机制,但不具有抗白粉病的功能。
巴西橡胶树;HbMlo1-1;基因克隆;基因表达;逆境
巴西橡胶树(Heveabrasiliensis)是一种非常重要的热带经济和能源作物,但在生长过程中受多种病虫害的影响,中国橡胶生长过程中危害最为严重和普遍的是白粉菌病害。目前对它的防治主要依靠化学防治,但对于橡胶树这一高大乔木而言,化学防治操作不便、成本高、环境污染严重。干旱和机械损伤对橡胶树的生长影响较大,可导致巴西橡胶树病虫害发生率、死皮率增加,灾害预报和管理成本增加[1-2]。作为植物激素,乙烯利(ETH)能够刺激橡胶树死皮率的增加[3]。茉莉酸(JA)信号途径对植物生长发育和植物应对逆境的反应有重要的调节作用[4]。Mlo(Mildew resistance locus o)基因是植物中特有的一类与白粉病抗病相关的基因,具有负向调控防卫功能[5]。该基因首先在大麦中发现[6],随后人们又陆续在拟南芥、烟草、水稻、高粱、小麦、黄瓜和葡萄等植物中找到相应的Mlo基因[7-8]。目前,Mlo基因的功能研究主要集中在大麦和拟南芥中,大麦Mlo蛋白具有7个跨膜结构[5],定位于细胞质膜上,同时还含有一个由20个氨基酸组成的钙调蛋白结合域(CaM-binding domain,CaMBD)[9-10]。研究表明,Mlo基因是大麦抗白粉病的负调控因子,其突变体mlo(纯合体)表现出对大麦白粉菌的持久、广谱抗病性[6]。此外,小麦Mlo基因家族成员还参与植物不同发育和生物、非生物应激反应相关通路[11]。橡胶树中Mlo基因的功能研究未见报道。本研究利用橡胶树‘热研7-33-97’的叶片转录组文库,通过RT-RCR进行克隆,获得橡胶树Mlo基因,并对其进行特征性分析和基因表达分析。研究具有负向防卫调控功能的Mlo基因在橡胶树中的功能对天然橡胶产业的经济发展具有重要的理论价值和实践意义。
1 材料与方法
1.1材料
基因克隆和不同组织的基因表达分析使用海南大学环境与植物保护学院教学基地的巴西橡胶树(Hevea brasiliensis)无性系‘热研7-33-97’的正常割胶的成龄树为材料。白粉病侵染处理试验使用海南大学环境与植物保护学院试验基地种植的巴西橡胶树GT1实生苗为材料。机械伤害、干旱、过氧化氢和植物激素的处理试验,使用海南大学环境与植物保护学院试验基地种植的巴西橡胶树‘热研7-33-97’芽接苗为材料。
1.2方法
1.2.1 总RNA的提取以及 cDNA 的合成 将收集好的不同处理下的叶片进行RNA提取[12],获得的RNA使用超微量核酸蛋白分析仪检测其浓度和纯度,再利用甲醛变性凝胶电泳检测RNA的完整性[13]。再将RNA反转录成cDNA,方法依照RNA反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit, Fermentas)。
1.2.2 橡胶树叶片Mlo1-1部分序列的EST克隆 根据GenBank上公布的拟南芥、木薯和蓖麻等物种的Mlo家族蛋白序列,在橡胶树EST和转录组数据库中做blastx搜索同源的EST片段,通过拼接得到橡胶树Mlo1-1基因的cDNA序列。采用Primer5.0软件设计基因特异引物HbMlo1-1-F(5′-AGGAGAACAAGGAAGAAGAAGAGAT-3′)和HbMlo1-1-R(5′-AAGCAAGCAAGCTATGATTACAAGT-3′),用反转录得到的cDNA为模板,扩增橡胶树Mlo1-1的cDNA序列。
1.2.3 巴西橡胶树HbMlo1-1基因结构分析HbMlo1-1基因的编码区序列以及氨基酸序列使用在线分析工具NCBI ORF Finder,该基因的蛋白相对分子质量、等电点、亲水性等理化性质通过ExPASy 的ProtParam在线分析软件进行分析。HbMlo1-1蛋白的结构分析主要使用:NCBI Conserved Domains数据库和SMART在线分析软件分析其结构保守域,TMHMM Server V.2.0分析其跨膜结构,用SignalP 4.1 Server分析信号肽结构,PSORT Prediction分析亚细胞定位。蛋白的同源性比对利用NCBI蛋白数据库blastp搜索,获取其它物种的Mlo同源蛋白序列,再使用DNAMAN6.0软件进行比对和系统发育树的建立。
1.2.4 巴西橡胶树HbMlo1-1基因表达分析 收集‘热研7-33-97’正常割胶的成龄树上胶乳、花、叶和树皮作为基因在不同组织中的表达的分析材料。在生长到两蓬叶的巴西橡胶树GT1实生苗上接种白粉菌,采集接种后白粉病菌盛发期(孢子大量萌发)和后期(孢子死亡)时的叶片[14]。机械伤害的芽接苗分别在处理的0、0.5、1、2、6、12 h采集叶片[15],在断水处理的芽接苗上连续采集叶片11 d[16]。喷施200 μmol·L-1ABA体积分数,1.0% ETH、200 mmol·L-1JA和体积分数2% H2O2处理芽接苗,所有药剂用体积分数0.05%乙醇进行溶解,对照植株喷施体积分数0.05%乙醇水溶液,在处理后0、0.5、2、6、10、24、48、72 h采集叶片[17]。将收集到的样品置于-80℃下保存备用。
根据HbMlo1-1序列设计荧光定量PCR的引物HbMlo1-1-QF(5′-AGGTAGTGACCTGTTTACAAGC-3′)和HbMlo1-1-QR(5′-ACCCTATTCACAAGAGAGGAAG-3′),以反转录的cDNA为模板,橡胶树HbACTIN(F: GATGTGGATATCAGGAAGGA和R: CATACTGCTTGGAGCAAGA)、Hb18sRNA(F: GCTCGAAGACGATCAGATACC和R: TTCAGCCTTGCGACCATAC)和HbUBC4基因(F: TCCTTATGAGGGCGGAGTC和R: CAAGAACCGCACTTGAGGAG)为内参,利用实时荧光定量PCR技术分析HbMlo1-1基因在不同组织中,以及机械伤害、干旱、白粉菌、激素和过氧化氢(H2O2)处理下的表达模式[18]。
1.2.5 统计分析 使用SAS9.1.3软件进行统计分析,采用单因素方差分析和Duncan检验分析。Origin2015科技绘图软件和Adobe Photoshop CS5作图。
2 结果与分析
2.1巴西橡胶树HbMlo1-1基因克隆与生物信息学分析
利用木薯MeMlo和葡萄VvMlo蛋白序列在橡胶树EST和转录组中做tblastn搜索后,克隆得到的cDNA序列全长为1 792 bp,5′端非编码区长度为48 bp,3′端非编码区长度为254 bp,编码区1 533 bp,编码510个氨基酸(图1)。分子式为C2679H4126N690O709S13,总原子数为8 217,推导的氨基酸理论相对分子质量为57.76 kD,等电点为9.08。根据HbMlo1-1基因的cDNA序列推导出来的蛋白与其他植物麻风树JcMlo1(Jatrophacurcas,XP_012070330.1)、甜瓜CmMlo1(Cucumismelo,XP_008460095.1)、黄瓜Cs1Mlo(Cucumissativus,XP_004145008.1)、可可树TcMlo(Theobromacacao,XP_007029886.1)和蓖麻RcMlo(Ricinuscommunis,XP_002523965.1)的蛋白进行同源性分析发现,它们的相似性分别为85%、75%、74%、74% 和82%(图2)。该基因同7种植物的Mlo蛋白的聚类分析结果发现:该蛋白与HbMlo1,AtMlo1属于同一分支(图3),因此,将该基因命名为HbMlo1-1。
植物的Mlo含有一个特征性结构域(图4-A):Mlo Superfamily,从8-484位氨基酸。通过亚细胞定位分析发现HbMlo1-1蛋白在内质网膜、内质网囊腔、质膜和高尔基体中存在的几率分别是0.685、0.100、0.640和0.460,表明HbMlo1-1主要定位在内质网膜上(图4-B)。通过SMART和TMHMM Server V. 2.分析发现HbMlo1-1蛋白分别在第15-37,64-86,163-185,284-306,310-327,369-391,和411-433位氨基酸处形成7次跨膜(图5)。通过TargetP 1.1和USC MLEG Group分析发现,HbMlo1-1蛋白无信号肽和核定位信号。
2.2HbMlo1-1基因的表达分析
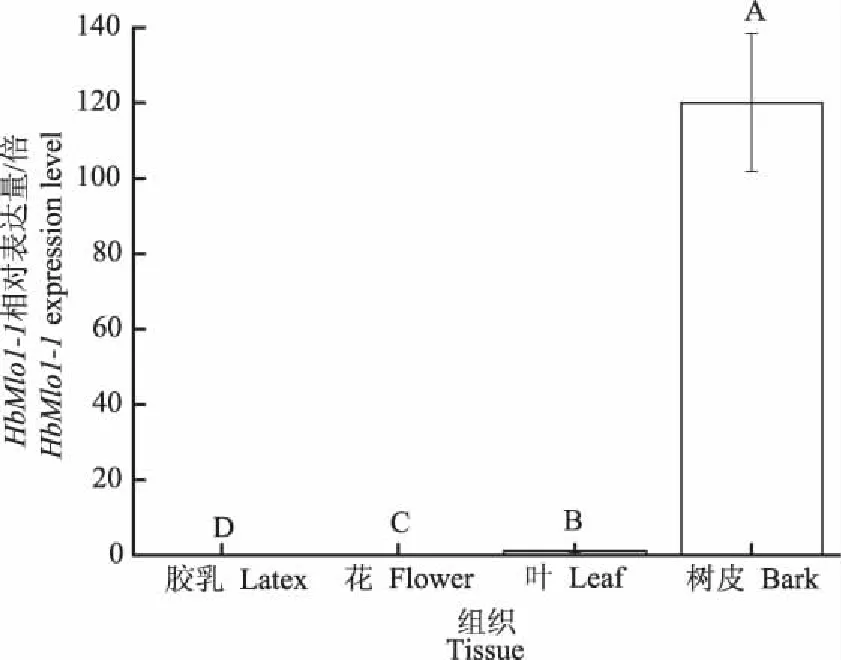
HbMlo1-1基因在橡胶树不同组织中的表达结果如图6所示。HbMlo1-1基因在花、叶中表达量极少,在树皮中表达量最高,相当于叶片中的120倍。表明HbMlo1-1基因主要在橡胶树的树皮中表达,具有组织表达特异性。
白粉菌侵染橡胶树后,HbMlo1-1基因的表达情况如图7所示。当白粉菌侵染达到1级病害时,橡胶树HbMlo1-1基因显著上调,达到处理前的4.6倍。橡胶树达到3级病害时,HbMlo1-1基因表达量相对1级时的显著下降,但相对处理前基因仍处于上调表达。随着病害级别的升高,基因表达量没有明显变化。表明白粉菌侵染会导致HbMlo1-1基因表达量显著性上升。
机械伤害作用下,HbMlo1-1基因在处理0.5 h,其表达水平显著上调,是处理前的1.4倍。随着机械伤害处理时间的延长,基因的表达水平呈现显著下降的趋势。说明HbMlo1-1基因在橡胶树机械伤害的早期起到调节作用。
图9为橡胶树中HbMlo1-1基因在干旱处理的10 d中其表达量的变化规律。在干旱处理第3天HbMlo1-1基因表达量开始显著下降。在处理的第5天,HbMlo1-1基因表达量达到最低,是处理前的0.18倍,且随着干旱时间的延长,基因的表达量一直处于下调水平。

图1 HbMlo1-1基因编码的核酸及其氨基酸序列Fig.1 Nuclear and amino acid sequences of HbMlo1-1 coding area

图2 HbMlo1-1氨基酸序列与其它植物Mlo氨基酸序列比对Fig.2 Sequence alignment of HbMlo1-1 deduced amino acid sequence with Mlo amino acid from other plants
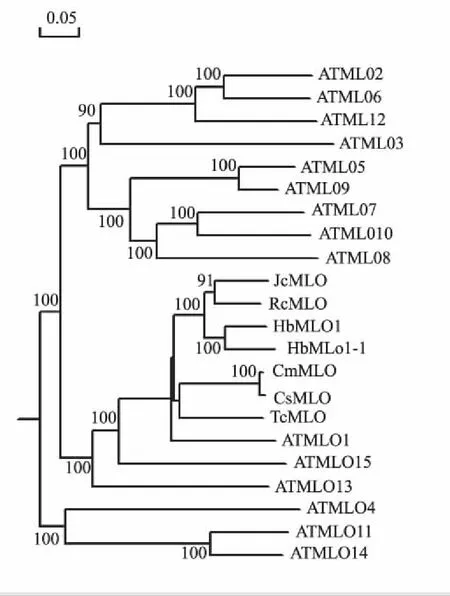
图3 HbMlo1-1与不同物种同源蛋白的系统进化关系分析Fig.3 Phylogenetic analysis of HbMlo1-1 withhomologous protein from various species
H2O2的作用下,橡胶树HbMlo1-1基因在处理0.5 h表达量显著上调,随后显著性下降,但仍高于处理前的表达量。在其处理72 h,HbMlo1-1基因再次显著上调表达,表达量达到处理前的6.5倍。在脱落酸(ABA)、乙烯利(ETH)和茉莉酸(JA)作用下,橡胶树HbMlo1-1基因的表达量在处理0.5 h均呈显著上调现象。但随后在ETH处理下,HbMlo1-1基因表达量便显著下调,处理10 h达到表达量最低点。在ABA处理下,在0.5 h表达量达到处理前的3.8倍,随后,表达水平在整体上保持不变。JA在处理的10 h前,HbMlo1-1基因持续显著性上调,最高达到处理前的8.5倍。10 h后,HbMlo1-1基因表达量显著下降(图10)。表明HbMlo1-1基因的表达水平受ABA、JA、ETH和H2O2的诱导影响。
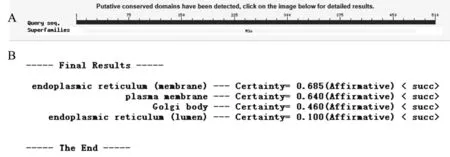
图4 HbMlo1-1推导的氨基酸的保守结构域和亚细胞定位Fig.4 The conserved domain and subcellular localization of HbMlo1-1 deduced amino acid sequence
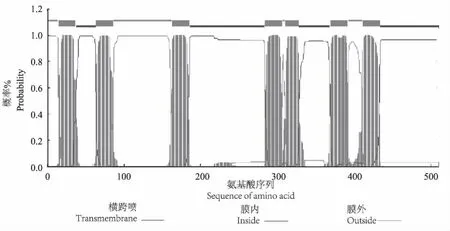
图5 HbMlo1-1基因推导的蛋白跨膜结构Fig.5 transmembrane domians of HbMlo1-1 deduced amino acid sequence
注:不同大写字母表示差异显著P<0.01,下图同。
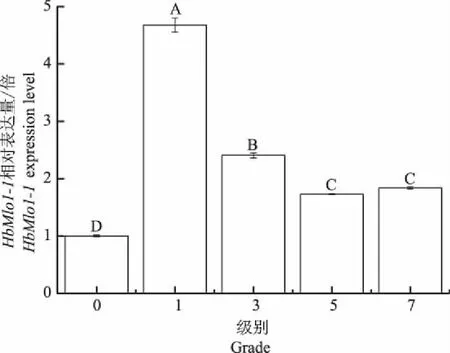
图7 HbMlo1-1在白粉菌侵染下表达分析Fig.7 HbMlo1-1 expression analysis underpowdery mildew infection
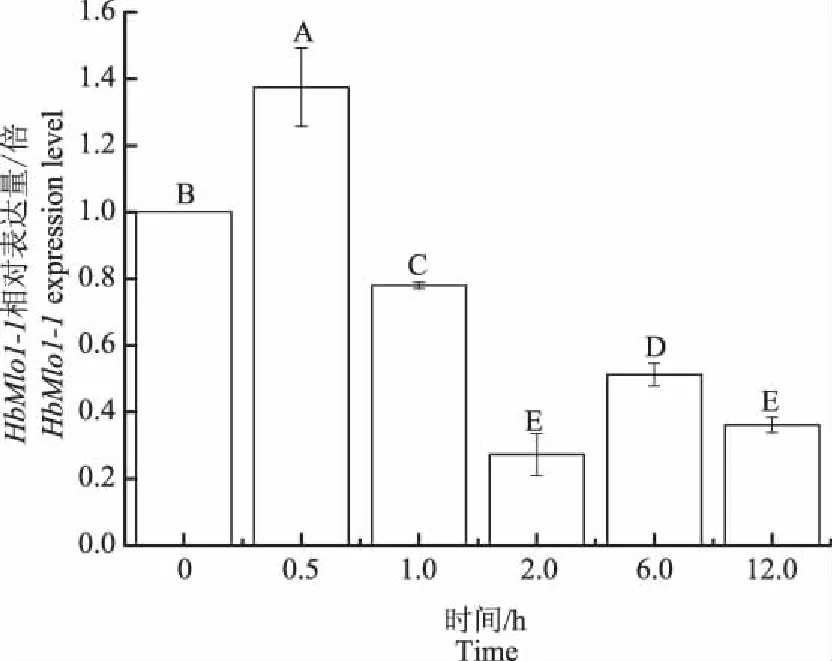
图8 机械伤害处理下HbMlo1-1基因的表达分析Fig.8 HbMlo1-1 expresion analysis undermechanical wounding treatment
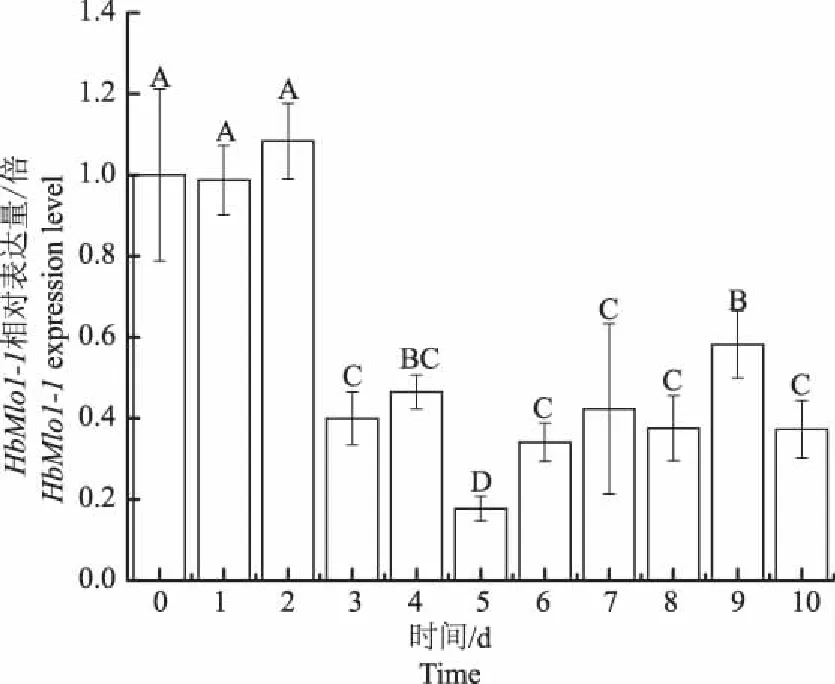
图9 HbMlo1-1基因在干旱处理条件下的表达分析Fig.9 HbMlo1-1 expression analysisunder drought treatment
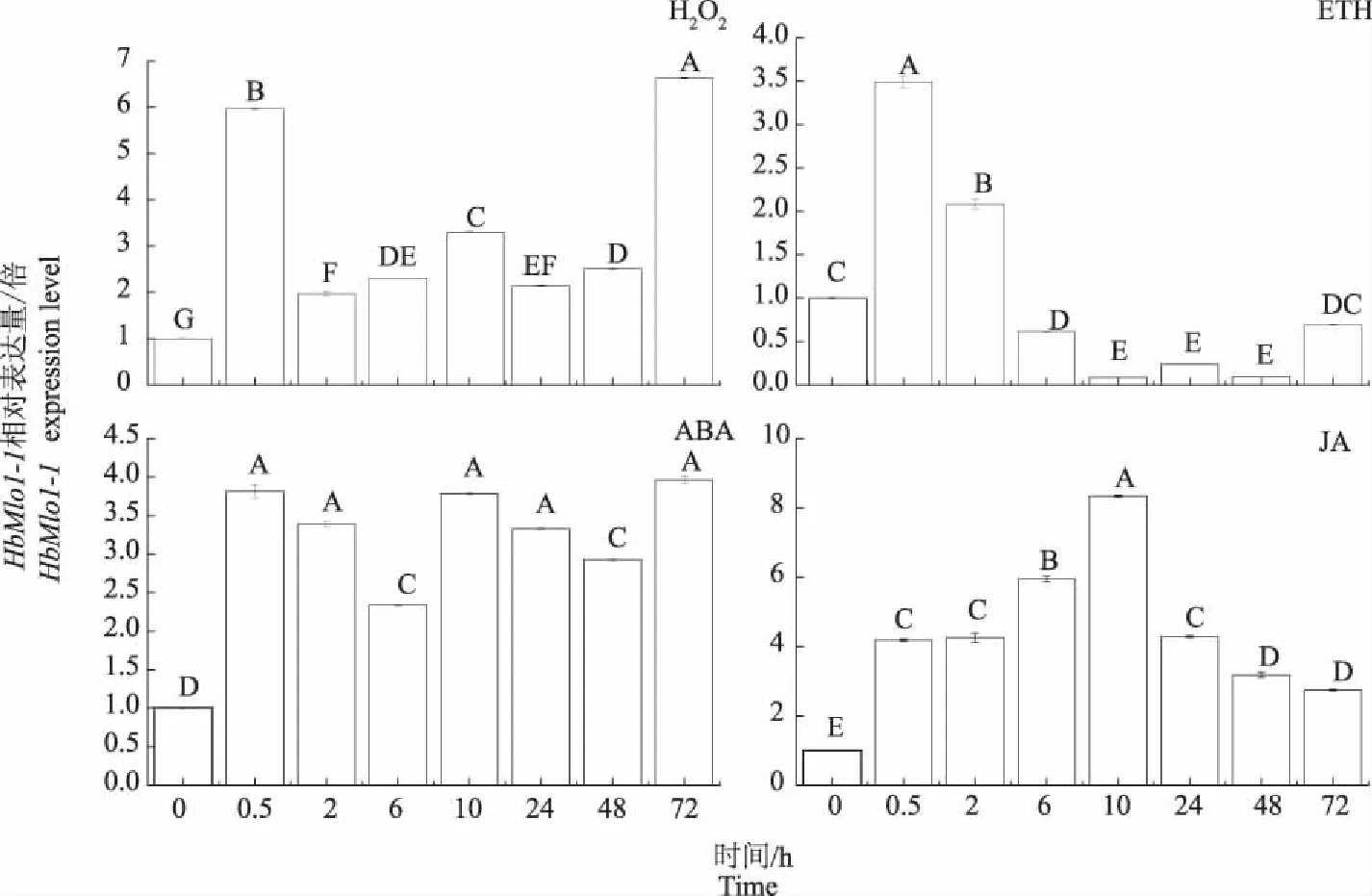
图10 HbMlo1-1在不同激素和过氧化氢处理下的表达分析Fig.10 HbMlo1-1 expresion analysis under different hormones and H2O2 treatment
3 讨论
Mlo基因是一个大家族,通过将拟南芥、葡萄、大麦和小麦等植物中的Mlo基因进行系统发育树分析,可将它们划分为7个不同的分支[19]。分析发现HbMlo1-1属于第Ⅱ分支,与拟南芥AtMlo1和HbMlo1在同一支。该基因编码的蛋白在8~484位氨基酸存在一个特征性结构域,在这段序列中含有7次跨膜螺旋区。拟南芥AtMlo1(登录号:NP_192169.1)和橡胶树HbMlo1(登录号:AIZ94062.1)分别编码526个和516个氨基酸,在5~485位和12~504位分别存在一个保守区域,均存在7次跨膜螺旋区域。在对HbMlo1-1基因进行细胞定位时发现,其主要定位于内质网膜上,而大多数Mlo家族成员定位在细胞质膜上[20],如大豆GmMlo和大麦HvMlo[5,11]。不同于大麦、小麦、水稻和番茄等作物[21],HbMlo1-1蛋白无信号肽和核定位信号,同AtMlo1和HbMlo1的情况一致。
结构决定功能。通过基因表达分析发现HbMlo1-1基因在树皮中表达量最高,叶片中次之。AtMlo1主要在叶片的维管束、根的维管组织以及花粉粒中表达[22]。在用白粉菌侵染橡胶树的研究中,发现橡胶树在感染白粉病初期,HbMlo1-1基因显著上调表达,表达量达到处理前的4.6倍,随着病害程度的加重,其表达量显著下调。这与AtMlo1和HbMlo1在受到白粉病菌侵染下基因的表达情况不同,它们的表达量并不受白粉菌的诱导[19,23]。白粉菌的侵染本身会导致叶片组织的结构受损,进而引起H2O2的大量爆发。橡胶树在机械伤害和H2O2处理下HbMlo1-1基因的表达量均呈现显著上升,随后又逐渐下降的现象,这与白粉菌侵染下基因的表达量变化趋势相同,由此可以判断HbMlo1-1基因在白粉菌作用下基因表达水平产生变化并不是由于白粉菌本身的诱导作用所引起的。干旱和机械伤害都能够诱导HbMlo1-1基因显著下调表达,推测该基因参与了橡胶树的胁迫应答过程。JA处理下HbMlo1-1基因的表达量在初期显著性上升,随后显著性下降,在ETH的作用下,橡胶树HbMlo1-1基因的表达情况同JA作用下类似。推测HbMlo1-1基因可能参与JA、ETH在植物体内的信号传导过程。JA能够调节植物生长发育[4],ETH在浓度过高时能够刺激橡胶树死皮率的增加[3]。研究HbMlo1-1基因同JA和ETH的关系,有利于促进橡胶树更好的生长发育,提高经济发展。越来越多的证据表明,H2O2在植物面临环境胁迫反应中发挥着重要的作用,比如应对逆境产生抗病防御反应、调控植物的生长发育、参与保卫细胞气孔运动等诸多生理过程[24],ABA在植物干旱、高盐、低温和病虫害等逆境胁迫反应中起重要作用[25]。本研究中发现H2O2和ABA能够诱导HbMlo1-1基因的表达量显著上升,推测HbMlo1-1基因可能参与植物体内H2O2的产生和ABA的信号传导过程,进而影响橡胶树在逆境中的生长状况。本研究为探究HbMlo1-1基因在橡胶树的生长发育和胁迫应答中的功能奠定理论基础,对天然橡胶产业的经济发展具有重要的理论价值和实践意义。
[1] 李新梅.干旱期橡胶树的管理[J].致富天地,2010(5):31.
[2] 温福光.物候因子干旱灾害长期预报[J].灾害学,1991,6(1):89-94.
[3] 张云霞,陈守才,邓治.橡胶树死皮病研究进展[J].热带农业科学,2006,26(5):56-61,65.
[4] 赵悦.巴西橡胶树乳管细胞茉莉酸信号途径对橡胶生物合成调节的研究[D].海口:海南大学,2011.
[5] DEVOTO A, PIFFANELLI P, NILSSON I, et al. Topology, subcellular localization, and sequence diversity of theMlofamily in plants [J]. J BiolChem, 1999, 274(49):34993-35004.
[6] BUSCHGES R, HOLLRICHER K, PANSTRUGA R, et al. The barleyMlogene: a novel control element of plant pathogen resistance [J].Cell,1997,88(5):695-705.
[7] 夏礼如,钱春桃.黄瓜MLO型基因家族成员的鉴定及生物信息学分析[J].江苏农业科学,2013,41(2):17-20.
[8] 邬晓勇,潘智慧,李萍,等.一个烟草Mlo基因的电子克隆及其序列特性分析[J].成都大学学报(自然科学版),2012,31(2):103-107.
[9] KIM M C, LEE S H, KIM J K, et al. Mlo, a modulator of plant defense and cell death, is a novel calmodulin-binding protein. Isolation and characterization of a riceMlohomologue [J]. J Biol Chem, 2002, 277(22):19304-19314.
[10] KIM M C, PANSTRUGA R, ELLIOTT C, et al. Calmodulin interacts with MLO protein to regulate defence against mildew in barley [J]. Nature, 2002, 416:447-451.
[11] DESHMUKH R, SINGH V K, SINGH B D. Comparative phylogenetic analysis of genome-wideMlogene family members from Glycine max and Arabidopsis thaliana[J].Mol Genet Genomics,2014,289(3):345-359.
[12] 卢利方.橡胶氨同化关键酶GDH基因的克隆及其表达分析[D].海口:华南热带农业大学,2007.
[13] 张福城.天然橡胶生物合成限速酶基因Hmg1启动子的克隆与功能鉴定[D].海口:华南热带农业大学,2006.
[14] WANG L F, WANG M, ZHANG Y. Effects of powdery mildew infection on chloroplast and mitochondrial functions in rubber tree [J]. Trop Plant Pathol, 2014, 39(3):242-250.
[15] PIFFANELLI P, ZHOU F Z, CASAIS C, et al. The barley MLO modulator of defense and cell death is responsive to biotic and abiotic stress stimuli [J]. Plant Physiol,2002,129(3):1076-1085.
[16] WANG L F. Physiological and molecular responses to drought stress in rubber tree (HeveabrasiliensisMuell. Arg.)[J].Plant Physiol Biochem,2014,83:243-249.
[17] QIN B, ZHANG Y, WANG M. Molecular cloning and expression of a novel MYB transcription factor gene in rubber tree[J].Mol Biol Rep,2014,41:8169-8176.
[18] 康桂娟,黎瑜,曾日中.巴西橡胶树HbNAC24基因克隆和表达分析[J].西北植物学报,2014,34(12):2374-2381.
[19] JOHANNA A G, STEFAN K, RALPH P. Magical mystery tour: MLO proteins in plant immunity and beyond [J]. New Phytol, 2014, 204(2):273-281.
[20] 韩德俊,李振岐,曹莉,等.大麦抗白粉病基因Mlo的研究进展[J].西北植物学报,2003,23(3):496-502.
[21] 覃碧,王萌,刘巧玲,等.蓖麻基因组Mlo基因家族成员的鉴定及其序列特征分析[J].中国农学通报,2014,30(15):268-273.
[22] CHEN Z Y, HARTMANN H A, WU M J. et al. Expression analysis of theMLOgene family encoding plant-specific seven-transmembrane domain proteins [J]. Plant Molecular Biology, 2006, 60:583-597.
[23] QIN B, ZHENG F C, ZHANG Y. Molecular cloning and characterization of aMlogene in rubber tree (Heveabrasiliensis) [J]. J Plant Physiol, 2015, 175:78-85.
[24] 宋喜贵,佘小平.植物体内过氧化氢的产生及其生理作用[J].连云港师范高等专科学校学报, 2010,12(4):99-103.
[25] 刘红娟,刘洋,刘琳.脱落酸对植物抗逆性影响的研究进展[J].生物技术通报,2008(6):7-9.
(责任编辑:蒋国良)
CloningandexpressionofHbMlo1-1geneinHeveabrasiliensisMuell.Arg.
HE Haixia1, ZHANG Yu1, WANG Meng1, LI Xiaona2, YANG Ye1, ZHENG Fucong1
(1.Environment and Plant Protection College, Hainan University, Haikou 570228,China; 2.Information Institute of Chinese Academy of Tropical Agricultural Sciences, Danzhou 571737, China)
In order to research the function ofMlogenes in rubber trees, we used transcriptome library of leaf of ‘Reyan 7-33-97 to cloneMlogene, then analyzed the expression of this gene. TheMlogene deduced a protein with a molecular mass of 57.76 kD, encoding by 510 amino acid. The protein structure analysis revealed that the protein had a characteristic Mlo superfamily conserved domain, seven transmembrane domains, no signal peptide, no nuclear localization signal, located on endoplasmic reticulum, and shared the highest similarity to theHbMlo1andAtMlo1. Therefore, the gene was namedHbMlo1-1. The expression analysis indicated thatHbMlo1-1 expressed mainly in the bark of the rubber tree. The expression level ofHbMlo1-1 was significantly upregulated under the wounding and powdery mildew infection treatment. Drought treatment induced the expression level ofHbMlo1-1 to have declined significantly. IAA, ETH, JA and H2O2can all induce the geneHbMlo1-1 to upregulate significantly. The results suggested thatHbMlo1-1 was involved in signal transduction pathway of plant hormones and response mechanisms of stress resistance, but didn’t have the function of the resistance to powdery mildew.
Heveabrasiliensis;HbMlo1-1; gene cloning; gene expression; stress environment
2016-04-29
国家自然科学基金项目(31460197);国家天然橡胶产业技术体系项目(CARS-34-GW8);海南省自然科学基金项目(314059);海南省研究生创新科研项目(Hys2015-11)
何海霞(1991-),女,安徽安庆人,硕士研究生,从事分子植物病理学研究。
张 宇(1974-),女,河北昌黎人,副教授,博士。
1000-2340(2016)06-0739-09
S432.1
:A

