根际低氧对不同抗性牡丹植株呼吸代谢的影响
周 勃,郁 敏,米银法
(1.河南城建学院建筑与城市规划学院,河南 平顶山 467036; 2.中原工学院信息商务学院,河南 郑州 451191;3.河南科技大学林学院,河南 洛阳 471003 )
根际低氧对不同抗性牡丹植株呼吸代谢的影响
周 勃1,郁 敏2,米银法3
(1.河南城建学院建筑与城市规划学院,河南 平顶山 467036; 2.中原工学院信息商务学院,河南 郑州 451191;3.河南科技大学林学院,河南 洛阳 471003 )
以牡丹品种“洛阳红”,“胡红”为试材,研究了根际低氧胁迫下两牡丹品种呼吸代谢应答机制及差异。结果表明,胁迫前期根系苹果酸脱氢酶(MDH)活性降低;丙酮酸脱羧酶(PDC),乙醇脱氢酶(ADH)和乳酸脱氢酶(LDH)活性前期升高,后期降低;葡萄糖-6-磷酸脱氢酶(G-6-PDH)、乳酸、乙醇、乙醛及丙酮酸含量显著增加。根 PDC、ADH 和 LDH 活性最大值时,“洛阳红”,“胡红”根 PDC、ADH和LDH活性分别比各自对照增加103.1%,76.3%;125.6%,91.3%;238.6%,157.7%。乳酸,乙醛及丙酮酸含量分别比各自对照增加151.1%,119.6%;284.8%,421.5%;75.8%,105.6%。表明根际低氧胁迫时“洛阳红”比“胡红”具备更完善的无氧呼吸代谢调节机制,更耐低氧。
牡丹;幼苗;根际低氧胁迫;呼吸代谢
氧作为线粒体电子传递链的末端受体,是植物正常代谢的必须条件。但土壤紧实、灌溉不均、洪水[1]、降水过多等常诱发根际低氧。根际低氧下,无氧呼吸代谢酶乙醇脱氢酶(ADH)、丙酮酸脱羧酶(PDC)和乳酸脱氢酶(LDH)、葡萄糖-6-磷酸脱氢酶(G-6-PDH)、苹果酸脱氢酶(MDH)活性增强[2],且此过程伴生许多糖酵解末端产物,如乙醛、乙醇、乳酸、丙酮酸等。而植物缺氧环境下乙醇、乙醛积累是造成细胞伤害的主要原因[3]。另外,乳酸过多积累致使植物细胞pH下降,细胞质酸化也是伤害细胞的另一主要原因[4]。低氧胁迫下的呼吸代谢研究在许多植物上都有报道。如淹水胁迫诱导玉米根系ADH,PDC和LDH活性显著升高,且抗性强的“登海662”增幅高于抗性弱的 “浚单20”[5]。较高的LDH活性可维持厌氧下植株的乳酸发酵过程,协同乙醇发酵途径在不损失碳的情况下维持体内的氧化还原平衡。黄瓜土壤紧实胁迫条件下,根系中ADH,PDC和LDH活性及无氧呼吸主要产物( 乙醇、乙醛和乳酸) 含量显著提高;参与有氧呼吸的苹果酸脱氢酶、琥珀酸脱氢酶和异柠檬酸脱氢酶活性下降。黄瓜根系有氧呼吸受抑,无氧呼吸代谢加强[6]。低氧胁迫下,网纹甜瓜根呼吸速率极显著低于对照。ADH,PDC和LDH活性显著升高,而哈密大枣苹果酸脱氢酶MDH活性显著降低[7-8]。厌氧条件下三叶草(Trifoliumsubterraneum)ADH活性升高,较高的ADH可以缓解植物厌氧胁迫的伤害[9]。淹水胁迫下,樱桃根系中PDC,LDH活性呈先升后降趋势,ADH活性在生长根中先升后降,在褐色木质根中为上升趋势。东北山樱桃ADH和LDH活性增幅大于马哈利,但PDC活性则相反。东北山樱桃MDH活性降幅大于马哈利。与马哈利相比,东北山樱桃对淹水更敏感[10]。根际低氧胁迫时,黄瓜幼苗根系中ADH,LDH活性显著提高,乙醇和乳酸含量增加。抗性较强的绿霸春4号比不耐低氧的中农8号幼苗根系ADH活性增幅和乙醇含量较高,LDH活性增幅和乳酸含量较低,这是2个黄瓜品种抗性差异的主要原因[11-12]。 牡丹(Paeoniasuffruticosa)为中国重要的传统名花,人工栽培已有2 000多年。但牡丹生长耐旱怕涝,栽培中水涝时易造成根际缺氧,致使烂根,阻碍生长,影响产量及观赏价值。为此本试验利用水培通氮气驱氧处理的方法,研究了2种不同抗性的牡丹植株呼吸代谢变化,以揭示其抗逆机制及生理差异,为牡丹的栽培管理和抗性育种提供理论依据和生产指导。
1 材料与方法
1.1试验材料
选取较耐淹水的牡丹“洛阳红”(Paeoniasuffruticosacv. Luoyanghong)和不耐淹水的“胡红”(P.suffruticosacv. Huhong)3 a生植株为试材[13],两种牡丹材料均为实生苗,由洛阳国际牡丹园提供。试验于河南科技大学园林试验室进行。
1.2试验设计与方法
2015-03-05进行牡丹盆栽。2015-06-20选生长一致的健壮植株,转入室内水培,定植于 1/2 倍Hoagland 营养液(pH值5.5~6.5)的水槽中。水培室内保持14 h光照,光照度为 8 000~9 000 lx,昼温 20~25 ℃,夜温 15~20 ℃。每个处理 30 株,预培养 3 d。用溶氧调节仪(华东理工大学FC680型)控制营养液,溶氧质量浓度(DO)维持在0.9~1.1 mg·L-1(低氧胁迫),对照用气泵正常通气(30 min·h-1),维持营养液 DO 值为8.0~8.5 mg·L-1(通气对照)。试验共设4个处理,即:“洛阳红”对照(Luoyanghong-CK)、“洛阳红”低氧(Luoyanghong-hypoxia)、“胡红”对照(Huhong-CK)、“胡红”低氧(Huhong-hypoxia)。每 2 d 换1次营养液。2015-06-23—2015-06-28进行低氧处理,参照孔祥生等[13]的方法。处理第1天开始,每天上午8:00取幼根冰盒保存,带回实验室进行指标测定,各指标 3 次重复。
1.2.1 LDH,ADH和PDC酶活性测定 LDH,ADH和PDC酶液提取及活性的测定参照僧珊珊等[5]方法。
MDH,G-6-PDH酶液提取及活性测定参照欧阳光察等[14]方法。
1.2.2 乳酸、乙醛、乙醇、丙酮酸浓度测定 呼吸代谢产物乳酸、乙醛、乙醇、丙酮酸的提取参照 GOOD 等的方法[15]进行,测定参照 BERGNERGER 等的方法[16]进行。
试验所需试剂均需购自于Sigma公司。
2 结果与分析
2.1低氧胁迫对牡丹根系丙酮酸脱羧酶(PDC)活性的影响
PDC是乙醇发酵途径中的关键酶,能催化丙酮酸生成乙醛。图1结果表明,牡丹遭受根际低氧胁迫时,PDC活性在前4 d随胁迫时间的延长而活性增强,之后逐渐下降,但在整个胁迫过程中,较耐低氧的“洛阳红”活性均高于较不耐低氧的“胡红”。第4天时,“洛阳红”和“胡红”根PDC分别比对照增加103.1%和76.3%。
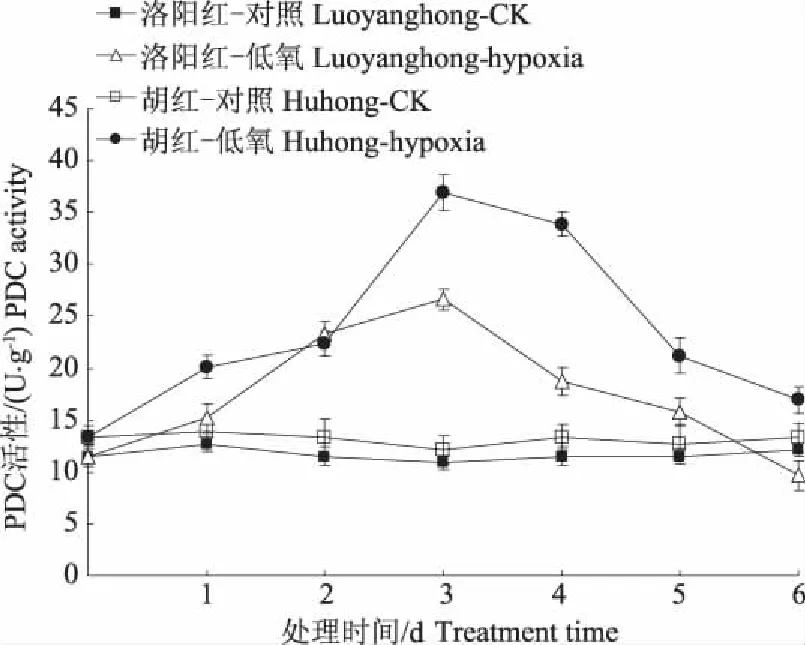
图1 低氧胁迫对牡丹根系PDC变化的影响Fig. 1 Effect of hypoxia stress on activities of PDCin roots of two peony varieties
2.2低氧胁迫对牡丹根系乙醇脱氢酶(ADH)活性的影响
图 2 表明,低氧胁迫条件下两牡丹根系ADH活性被激活,呈先升后降的趋势,且“洛阳红”ADH活性显著高于“胡红”。第3天最大值时“洛阳红”和“胡红”分别比对照增加125.6%和91.3%。表明此时牡丹生存所需能量主要依赖于乙醇无氧呼吸途径,该途径除产生大量乙醇积累、诱发根毒害的同时,反过来又会抑制ADH活性的提高。所以牡丹根ADH活性表现为前期升高后期又下降的变化趋势。
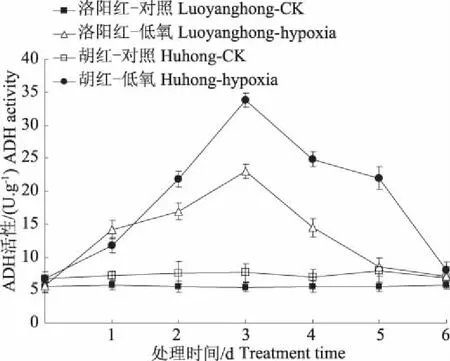
图2 低氧胁迫对牡丹根系ADH变化的影响Fig. 2 Effect of hypoxia stress on activities of ADHin roots of two peony varieties
2.3低氧胁迫对牡丹根系乳酸脱氢酶(LDH)活性的影响
图 3 表明根际低氧下,牡丹根系LDH活性显著增加,但耐低氧能力较弱的“胡红”增加的幅度大于“洛阳红”。最大值时,“胡红”和“洛阳红”根 LDH 活性分别比对照增加238.6%和157.7%。表明“胡红”根内有更多的丙酮酸被转化成乳酸,致使根细胞质 pH 迅速下降,引起细胞质酸中毒。“洛阳红”根内 LDH 活性保持较低水平的增幅和含量,更利于其维持低水平的乳酸含量,减轻根细胞质内 pH 降低遭受的酸毒害,利于提高根系对低氧逆境的忍耐性。
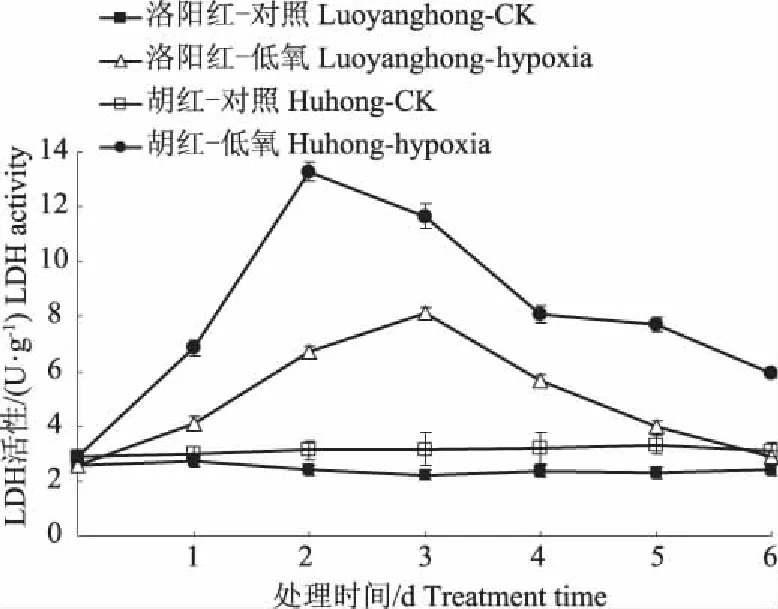
图3 低氧胁迫对牡丹根系LDH变化的影响Fig. 3 Effect of hypoxia stress on activities of LDHin roots of two peony varieties
2.4低氧胁迫对牡丹根系苹果酸脱氢酶(MDH)活性的影响
图 4 表明,低氧胁迫过程中,2种牡丹根内MDH活性均呈下降趋势,且在整个过程中“胡红”下降幅度高于“洛阳红”。第 6 天时,“洛阳红”和“胡红”分别比对照下降48.7%和53.0%。
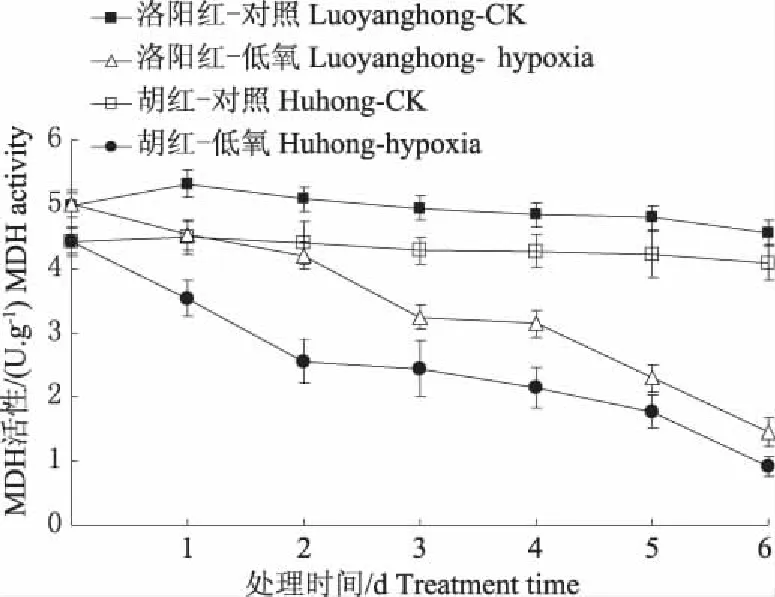
图4 低氧胁迫对牡丹根系MDH变化的影响Fig. 4 Effect of hypoxia stress on activities of MDHin roots of two peony varieties
2.5低氧胁迫对牡丹根系葡萄糖-6-磷酸脱氢酶(G-6-PDH)活性的影响
图5表明,根际低氧胁迫下两种牡丹根内G-6-PDH活性变化均随胁迫时间的延长而逐渐升高,但较耐低氧的“洛阳红”高于“胡红”,最大值时分别比对照增加121.0%和83.6%。可见根际低氧胁迫时“洛阳红”尚能维持较高的G-6-PDH活性,以便能够及时催化戊糖磷酸途径产生更多的NADPH和ATP,增强了其抵抗低氧胁迫的能力。
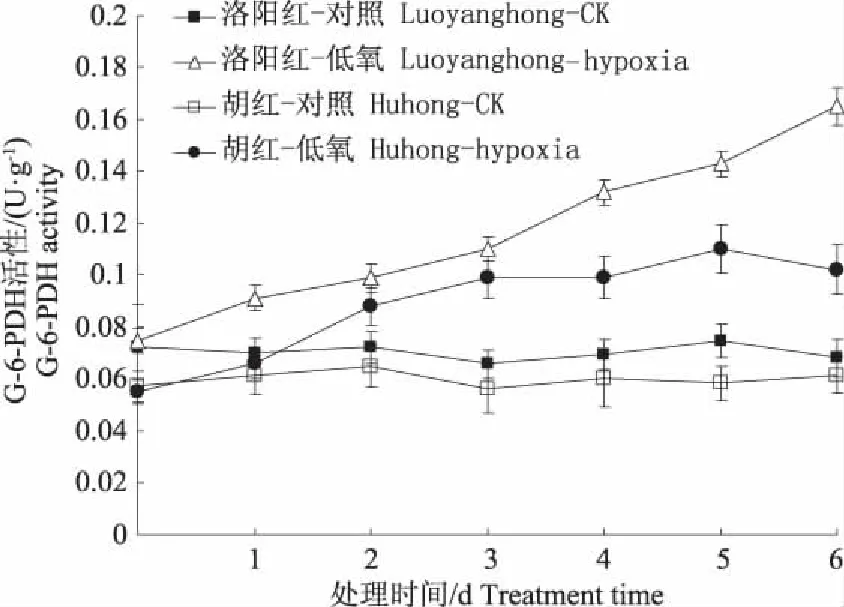
图5 低氧对牡丹根系G-6-PDH变化的影响Fig. 5 Effect of hypoxia stress on activities ofG-6-PDH in roots of two peony varieties
2.6低氧胁迫对牡丹根系呼吸代谢产物乳酸的影响
图6 结果表明,两牡丹在根际低氧胁迫过程中,代谢产物乳酸含量随胁迫时间的延长呈不断升高趋势。乳酸的过多积累将引起细胞质的酸性化[17],严重时液泡H+外渗导致细胞质酸中毒,这可能是低氧胁迫引起牡丹伤害的主要原因。第3天最大值时,“胡红”、“洛阳红”分别比对照增加151.1%和119.6%。两种牡丹在整个低氧胁迫过程中,对低氧较敏感的“胡红”无论在含量还是在增幅度上均高于“洛阳红”。说明在相同的胁迫条件下“胡红”遭受乳酸细胞质酸性化的程度和毒害甚于“洛阳红”。
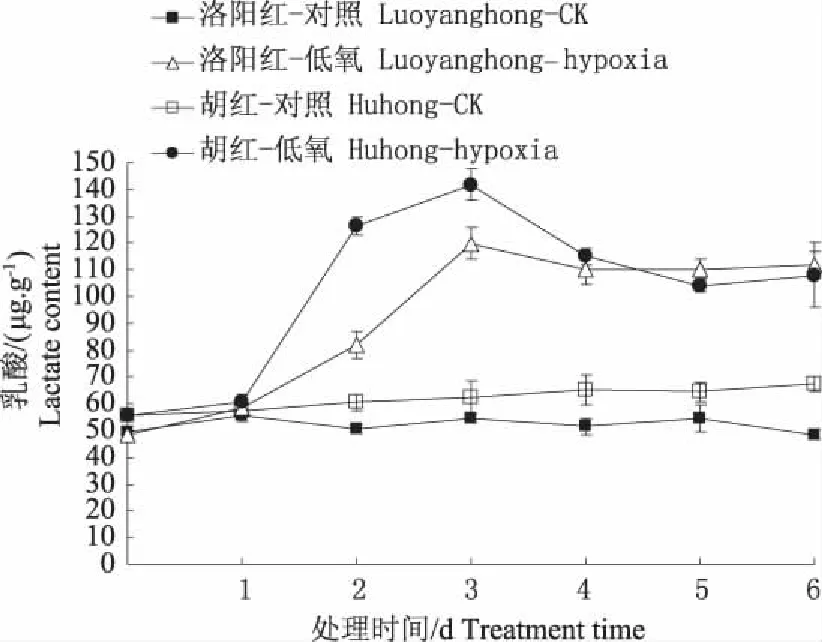
图6 低氧对牡丹根系代谢产物乳酸的影响Fig. 6 Effects of hypoxia stress on lactate contentin roots of two peony varieties seedlings
2.7低氧胁迫对牡丹根系呼吸代谢产物乙醇、乙醛的影响
本研究结果表明,低氧胁迫诱发了两牡丹根内乙醇(图7)、乙醛(图8)含量的增加。在胁迫过程中,“洛阳红”根内乙醇含量均显著高于“胡红”。这可能与“洛阳红”根内高活性的ADH有关(图2)。
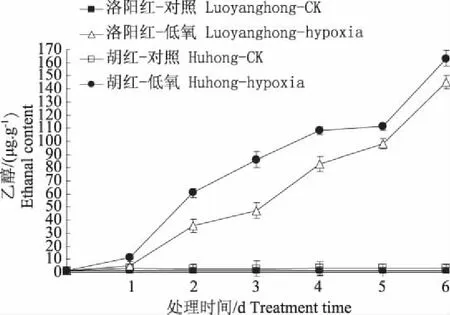
图7 低氧对牡丹根系代谢产物乙醇的影响Fig. 7 Effects of hypoxia stress on ethanol contentin roots of two peony varieties seedlings
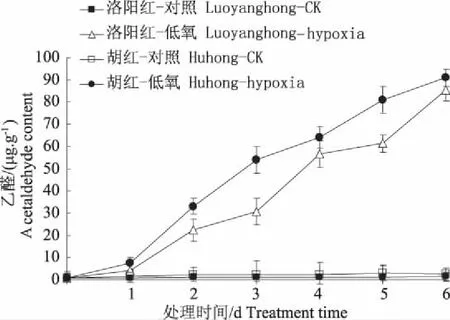
图8 低氧对牡丹根系代谢产物乙醛的影响Fig. 8 Effects of hypoxia stress on acetaldehyde content inroots of two peony varieties seedlings
根际低氧胁迫时,两牡丹根内乙醛含量在前1天上升幅度较为平缓,第2天后急剧增加。两牡丹第1天根内乙醛含量差异不显著,但第2天后“胡红”显著高于“洛阳红”。第3天时“洛阳红”、“胡红”分别比对照增加284.8%和421.5%倍。可见,低氧胁迫时“胡红”根遭受乙醛危害更重。
2.8低氧胁迫对牡丹根系呼吸代谢产物丙酮酸的影响
图9结果表明,两牡丹根内丙酮酸含量在整个胁迫过程中均呈上升趋势,且在整个过程中“洛阳红”含量低于“胡红”,可能是因为低氧条件下,抗性较强的“洛阳红”有更多的丙酮酸参与了无氧代谢供能途径,以便获得延长存活所需的能量。遭受胁迫前 2 天内,两牡丹根内丙酮酸含量上升趋势较为缓慢,第3 天时达到最大值后增加幅度趋于平稳。最大值时“洛阳红”和“胡红”丙酮酸含量分别比对照增加75.8%和105.6%。
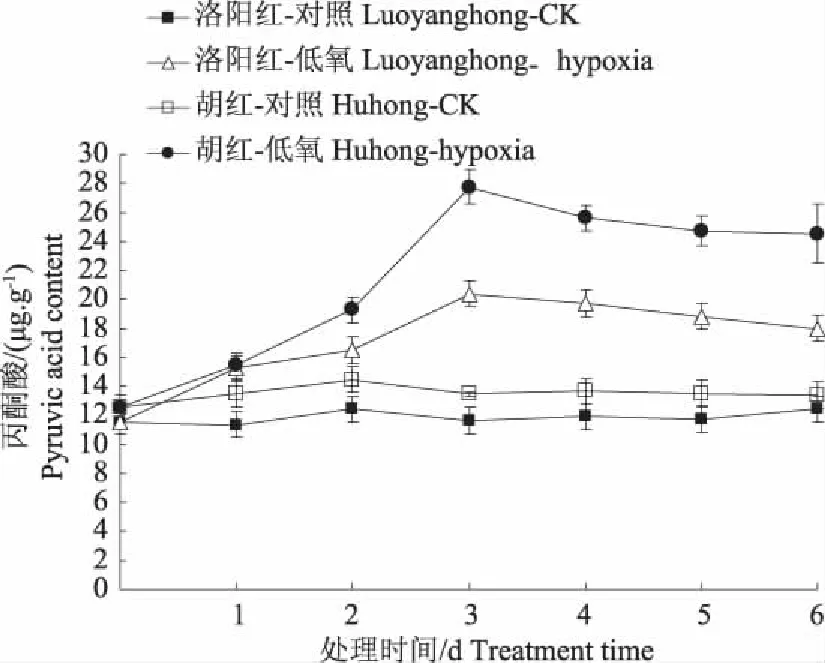
图9 低氧对牡丹根系代谢产物丙酮酸的影响Fig. 9 Effects on pyruvic acid content in roots of twopeony varieties seedlings under hypoxia stress
3 结论与讨论
厌氧诱导蛋白 (ADH) 是无氧呼吸的关键诱导酶,主要催化乙醛和乙醇间的氧化还原反应,它通过巴斯德效应维持较高的能荷来延长植株缺氧时的存活时间[18]。其活性高低和缺氧时植物的生存密切相关。因此在缺氧条件下,ADH 活性可作为植物种缺氧特异敏感性的定量指标。本研究结果表明,低氧胁迫条件下的牡丹根系因缺氧诱导了ADH 的表达,利于无氧呼吸。抗低氧较强的“洛阳红”ADH 活性高于抗性较差的“胡红”,这与根际低氧下的黄瓜[11]、涝渍下的玉米[5]结论一致。说明遭受低氧胁迫时,“洛阳红”更有利于根系维持较高的乙醇发酵能力,利于 NAD+再生,以保证糖酵解途径能量 ATP 的生成,供应植株,这可能是“洛阳红”较耐低氧的一个重要原因。
乙醇和乙醛积累是根际低氧胁迫危害细胞的主要原因。本试验中,根际低氧胁迫促使两种牡丹根内乙醇和乙醛含量显著增加,这可能是低氧诱导牡丹根系 PDC 和 ADH 酶活性升高,致使厌氧产物积累的结果。但在相同的胁迫条件下,两种抗性不同的牡丹体内乙醇和乙醛的含量差异显著。较耐低氧的“洛阳红”根内乙醛含量明显低于不耐低氧的“胡红”,而乙醇含量却显著高于“胡红”,这与“洛阳红”根内 ADH 的高活性有关。因为,ADH 主要在乙醇与乙醛相互转化中起催化作用,其作用方向主要取决于 NAD 与 NADH 的相对浓度。由于“洛阳红”根系 ADH 活性较高,可加速更多的乙醛向乙醇转化[12],因而导致其比“胡红”根内乙醛含量低,维持较高的乙醇含量。同时,抗性较弱的“胡红”丙酮酸含量高于“洛阳红”(图9),较高的丙酮酸含量又能在 PDC 的催化下形成更多的乙醛,同样也会导致“胡红”乙醛含量增加。
无氧代谢过程中,LDH 功能主要是将丙酮酸转化为左旋乳酸[19],乳酸是引起细胞质酸化的原因之一。本研究结果表明,抗性弱的“胡红” LDH 活性(图3)显著高于抗性较强的“洛阳红”,表明“胡红”有更多的 LDH 参与了丙酮酸转化为乳酸的过程,进入乙醇发酵途径,消耗了较多的呼吸底物[20],因而相同条件下“胡红”根内乳酸含量显著高于“洛阳红”(图6),表明“胡红”的乳酸发酵高于“洛阳红”,这可能是敏感品种低氧耐性较弱的一个重要原因。
本研究发现,牡丹在遭受低氧胁迫时根内 LDH 活性前期升高后期下降,这可能是由于后期严重缺氧致使乳酸含量增加,细胞质pH值下降,LDH 活性又受到抑制的结果[10]。遭受根际低氧胁迫时,牡丹根内 MDH 活性下降(图4),G-6-PDH 活性升高(图5)。可见,根际胁迫时牡丹根系MDH在调节抗低氧能力方面不起主导作用。而G-6-PDH活性的升高却能够及时催化牡丹株内的戊糖磷酸途径,获得较多的代谢中间产物(如核酮糖-5-磷酸和赤藓糖-4-磷酸),为蛋白质、脂肪酸、氨基酸、固醇类等物质的合成提供反应底物,并产生较多的 NADPH,在线粒体中氧化产生 ATP 还原力,增强了其抵抗低氧胁迫的能力。可见,牡丹根际低氧下的呼吸代谢调节是一个较为复杂的机制。
[1] KIRK G J D,GREENWAY H,ATWELL B J,et al. Adaptation of rice to flooded soils[J].Progress in Botany, 2014,75(7):215-253.
[2] ZHOU J,TIAN X L,QIAO L F,et al.Respiratory enzyme activity and regulation of respiration pathway in seashore mallow (Kosteletzkyavirginica) seedlings under waterlogging conditions[J].Australian Journal of Crop Science,2012, 6(4):756-762.
[3] VODNIK D,STRAJNAR P,JEMC S, et al.Respiratory potential of maize (ZeamaysL.) roots exposed to hypoxia[J]. Environmental and Experimental Botany,2009, 65(1): 107-110.
[4] SAIRAM R K,DHARMAR K,CHINNUSAMY V, et al. Waterlogging-induced increase in sugar mobilization, fermentation, and related gene expression in the roots of mung bean (Vignaradiata)[J].Journal of Plant Physiology,2010,166(6): 602-616.
[5] 僧珊珊,王 群,李潮海,等.淹水胁迫下不同玉米品种根结构及呼吸代谢差异[J].中国农业科学,2012,45(20):4141-4148.
[6] 郑俊鶱,孙艳,韩寿坤,等.土壤紧实胁迫对黄瓜根系呼吸代谢的影响[J].应用生态学报,2013,24(3): 74-76.
[7] 刘义玲,李天来,孙周平,等.根际低氧胁迫对网纹甜瓜生长、根呼吸代谢及抗氧化酶活性的影响[J].应用生态学报,2010,21(6): 1439-1445.
[8] 张艳艳,陈恺,于宁,等.不同浓度CO2及O2处理对哈密大枣无氧呼吸代谢的影响[J].食品工业科技,2013,34(9):315-319.
[9] MEGURO N,TSUJI H,TSUTSUMI N, et al. Involvement of aldehyde dehydrogenase in alleviation of post-anoxic injury in rice[J]. Springer Netherlands,2006, 13(4) : 111-119.
[10] 陈强,郭修武,胡艳丽,等.淹水对甜樱桃根系呼吸强度和呼吸酶活性的影响[J].应用生态学报,2008,19(7):1462-1466.
[11] 胡晓辉,郭世荣,李璟,等.低氧胁迫下钙调素拮抗剂对黄瓜幼苗根系多胺含量和呼吸代谢的影响[J]. 应用与环境生物学报,2007,13(4):475-480.
[12] 康云艳,郭世荣,段九菊.根际低氧胁迫对黄瓜幼苗根系呼吸代谢的影响[J].应用生态学报,2008,19(3):583-587.
[13] 孔祥生,张妙霞,王学永,等.水分胁迫下2个牡丹品种生理生化差异比较[J].林业科学,2011,47(9):162-167.
[14] 欧阳光察.植物生理学实验手册[M].上海:上海科学技术出版社,1985:179-184.
[15] GOOD A G, MUENCH D G. Long-term anaerobic metabolism in root tissue: Metabolic products ofpyruvatemetabolism[J]. Plant Physiol, 1993, 101(4): 1163-1168.
[16] BERGMEGER H U. Methods of enzymatic analysis [M].3rd Vol Ⅲ.Verlag Chemse; Weinhein Press, 1983:598-616.
[17] ROBERTS J K M,ANDRADE F H,ANDERSON I C. Further evidence that cytoplasmic acidosis is a determinant of flooding intolerance in plants[J].Plant Physiol,1985, 77(2): 492-494.
[18] UMEDTA, UEHIMAIYA H. Differential transcript levels of genes associated with glycolysis and alcohol fermentation in rice plants(oryzasativeL.)under submergence stress[J]. Plant Physiol, 1994, 106(3):1015-1022.
[19] FELLE H. pH regulation in anoxic plants[J]. Annals of Botany, 2005, 96(4): 519-532.
[20] SAGLIO P H, PRADET A. Soluble sugars, respiration, and energy charge during aging of excised maize root tips[J]. Plant Physiol, 1980, 66(3): 516-519.
(责任编辑:李 莹)
EffectofrootzonehypoxiastressonrespiratorymetabolismbetweentwoPaeoniasuffruticosavarieties
ZHOU Bo1, YU Min2, MI Yinfa3
(1.College of Architecture and Urban Planning, Henan University of Urban Construction,Pingdingshan 467036, China; 2. Information Business College, Zhongyuan University of Technology,Zhengzhou 451191, China;3.Forestry College, Henan University of Science and Technology, Luoyang 471003, China)
TwoPaeoniasuffruticosavarieties ‘Luoyang Hong’and ‘Hu Hong’ were used as test materials in this study. The rhizosphere respiration metabolism and the difference between them were researched under root zone hypoxia stress. The results indicated that stress root MDH(malic dehydrogenase) activity decreased; PDC(pyruvate decarboxylase), ADH(alcohol dehydrogenase) and LDH(lactate dehydrogenase) activity increased in the early days, the latter reduced. G-6-PDH, lactic acid, ethanol, of acetaldehyde and pyruvate content increased significantly. Compared with the respective control, the maximum value of root PDC, ADH and LDH ‘Luoyang Hong’and‘Hu Hong’ were increased by 103.1% and 76.3%,125.6% and 91.3%,238.6% and 157.7% respectively. Contents of lactic acid, acetaldehyde and pyruvic acid were increased by 151.1% and 119.6%,284.8% and 421.5%,75.8% and 105.6% respectively. The results showed under root zone hypoxia stress, ‘Luoyang hong’ had better anaerobic respiration adjustment mechanism than ‘Hu Hong’ and was more resistant to hypoxia.
Paeoniasuffruticosa;seedling;hypoxia stress;respiratory metabolism
2016-04-20
国家自然科学基金项目(31101536); 国家重点实验室开放课题(20120630);河南科技大学博士科研基金项目 ( 09001473 )
周 勃(1983-),男,河南平顶山人,讲师,硕士,主要从事园林植物与观赏园艺等方面的研究。
1000-2340(2016)06-0734-06
S 685.11
:A

