传统中药中抗动脉粥样硬化PPARα激动剂的虚拟筛选
杜 霞,张鑫磊,李 晔*
(1.陕西省中医药研究院中药研究所,西安 710003;2.第四军医大学药学系,西安 710032)
·化学·
传统中药中抗动脉粥样硬化PPARα激动剂的虚拟筛选
杜霞1,张鑫磊2,李晔1*
(1.陕西省中医药研究院中药研究所,西安710003;2.第四军医大学药学系,西安710032)
目的 基于传统中药寻找抗动脉粥样硬化的先导药物分子。方法过氧化物酶体增殖物激活受体α(PPARα)是抗动脉粥样硬化的研究热点之一,以该受体为靶标,采用计算机辅助药物分子设计方法中的药效团筛选、分子对接和相互作用模式分析对传统中药数据库进行虚拟筛选。结果从含有37 170个化合物的传统中药数据库中优选出20个活性较好的化合物,通过进一步的氢键作用分析确认3个先导化合物。结论该研究为新型抗动脉粥样硬化PPARα激动剂的发现提供了新的方法和理论依据。
动脉粥样硬化;PPARα激动剂;药效团筛选;分子对接
动脉粥样硬化(atherosclerosis,AS)是一种严重危害人类健康的慢性炎症疾病[1-2]。1990年,英国科学家IssemannI等[3]发现了一种由配体调控的核激素受体——过氧化物酶体增殖物激活受体(peroxisomeproliferators-activatedreceptors,PPARs),这是一类由配体激活的核转录因子,主要包含3种亚型:α、δ和γ。近年来,大量实验表明,PPARα经配体激活后可以通过直接作用于动脉管壁,从而抑制单核细胞向血管内皮聚集并转化为巨噬细胞,抑制血管平滑肌细胞的增殖、迁移以及抑制泡沫细胞的形成等炎症细胞的趋化和浸润,是动脉粥样硬化治疗研究的热点之一[4-9]。
目前,临床使用的PPARα激动剂类药物主要为贝特类药物,如:氯贝特、苯扎贝特和环丙贝特等。该类药物的突出作用就是可以显著降低三酰甘油,通过纠正血脂异常来发挥抗动脉粥样硬化作用[10-11]。然而,这类药物与受体的结合能力较弱、选择性较低,服用一段时间后通常需要增大服用剂量来维持疗效,长期服用还可引起肝肾功能损害以及药物性横纹肌溶解症等不良反应[12-13]。因此,从传统中药出发,寻找更加安全有效的天然高选择性PPARα激动剂类药物成为抗动脉粥样硬化研究领域的重点和难点。本论文综合采用计算机辅助药物分子设计中药效团筛选和分子对接方法从传统中药数据库中快速筛选出PPARα的天然配体,为新型治疗动脉粥样硬化药物的研发提供先导化合物。
1 方法与计算
1.1数据库的选取及处理采用由台湾中国医药大学ChenCY教授建立的传统中药数据库TCMDatabase@Taiwan[14]进行虚拟筛选。该数据库是目前世界上最大、最全面的中药类数据库,包含352种中草药,共计37 170个化合物。使用Accelrys公司的PipelinePilot8.5软件对该数据库进行以下处理,去除重复分子,经处理后,共输出8 710个活性化合物,然后采用Lipinski的类药性五规则,用于对化合物库的初筛,最终得到5 324个候选化合物。
1.2药效团构建从蛋白质晶体的结构数据库中获得16个对PPARα有明确激动活性的小分子配体,按照结合位置比较挑选出5个与受体结合位点一致的配体作为训练集,使用DiscoveryStudio3.5软件中的DSCatalystConformation进行多构象化设置,对每个小分子产生最多255个构象用以表征小分子的构象空间,创建能量值在能量阈值20kcal·mol-1之内的构象。然后,由Receptor-LigandPharmacophoreGeneration(RLPG)模块进行PPARα激动剂药效团模型的构建。使用DSCatalystStructureBasedPharmacophore(SBP)生成具有4~8个特征元素的20种药效团模型。通过药效团特征元素聚类分析和与活性化合物的活性值匹配情况进行比较,选择最优的药效团模型进行后续的筛选。
1.3药效团筛选和分子对接利用上述得到的较优药效团模型5号药效团对5 324个候选化合物进行虚拟筛选,为了得到多样性良好的先导化合物,对所有候选化合物进行结构聚类分析,从中挑选出打分最好的化合物作为候选分子。分子对接是2个或多个分子之间通过几何匹配和能量匹配而相互识别的过程,是最重要的计算机辅助药物分子设计方法之一[15]。使用DSLigandFit模块,将上述药效团筛选后的20种候选化合物分别与PPARα受体进行分子对接,通过对打分函数分析及受体与配体之间的相互作用模式确定先导化合物。
2 结果与讨论
2.1药效团模型评估根据训练集化合物所含药效团特征构建出20个药效团模型。通过对已知的活性化合物建立测试集验证模型,区分活性化合物能力和筛选能力,从而优选出适合用于进一步筛选的药效团模型。通过对20种药效团模型进行评估,结果表明,Pharmacophore5, 8, 10, 12, 14, 16, 18, 19和20的SE均为0.800 00,较其他药效团模型得分较高。根据对几种得分较高药效团模型的综合比较,我们最终选定5号药效团作为后续筛选的药效团模型。5号药效团具有2个氢键受体(hydrogen-bondacceptor,HBA),4个疏水基团(hydrophobicpoint,HY)和27个排除体积(excludedvolumes,EV),其与阳性对照物BMS-687453的匹配图见图1。由图1可知,BMS-687453结构中的羧酸端羰基和羟基与氢键受体特征匹配,而结构中的2个芳香环、1个五元环及与酯基连接的甲基与疏水中心特征匹配。
Fig.1MappingofPPARαagonistpharmacophoremodel5#andcompoundBMS-687453inthetrainingset
2.2药效团筛选传统中药数据库TCMDatabase@Taiwan是由台湾中国医药大学建立的免费虚拟筛选数据库,包含352种中草药,共计约4万种中药成分化合物。利用所得较优的5号药效团模型,对该数据库进行虚拟筛选,通过除重、Lipinski的类药性五规则和药效团筛选等一系列操作,初步得到20个命中结构,见图2。
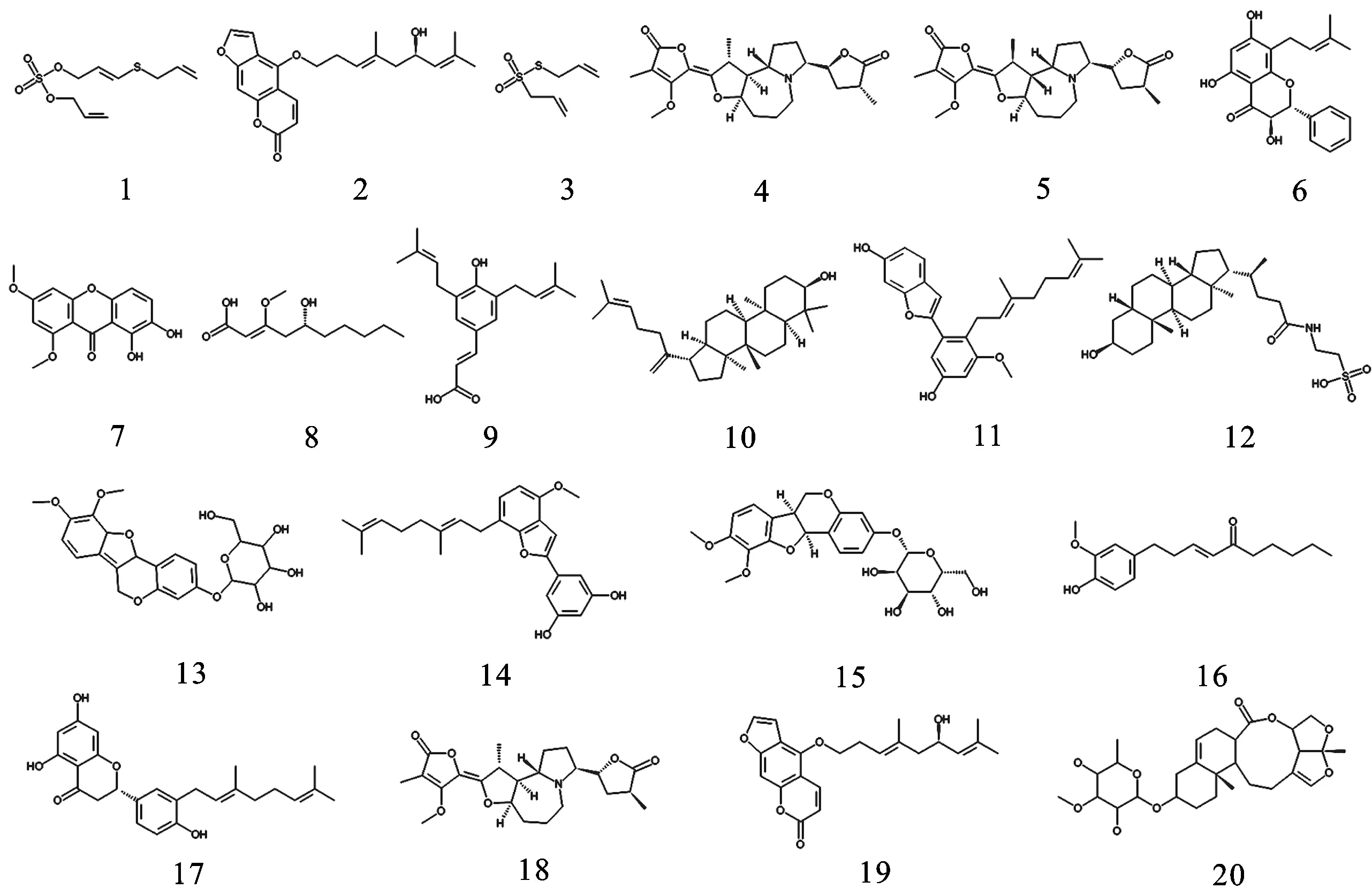
图2测试集化合物的结构示意图
Fig.2Thechemicalstructuresofthetestsetcompounds
2.3分子对接由于得到的活性化合物较多,为了进一步分析这些化合物与PPARα活性位点的相互作用,选取PDB数据库中的PPARα与BMS-687453复合物晶体结构中的蛋白作为受体(PDBID:3KDT)[16],利用DS中Libdock模块将这20个命中结构分别对接到受体的活性位点,提取对接构象后,采用ScoreLigandPose通过不同的打分函数对构象进行打分,主要包括:LigScore,PLP,PMF,Jain和Ludi等。为了合理地选择打分函数,绘制5种训练集化合物的所有打分函数与活性IC50值的散点图,计算各个模型的线性回归系数。结果表明,Jain和Ludi具有最高的线性系数,因此,我们选择这2种打分函数作为评判标准,列出了20种命中化合物的打分函数Jain和Ludi值,见表1。根据训练集化合物打分与富集率的关系,我们认为:化合物的Jain值在0.568 5~2.647 5之间,或其Ludi值的范围在820~1 030之间,可作为选择候选药物分子的依据。据此,化合物3,8,10,11,14,16和20可作为潜在的药物分子。
表120个测试集化合物的Jain和Ludi打分函数值
Tab.1ResultsofJainandLudiscoringfunctionsfor20testsetcompounds
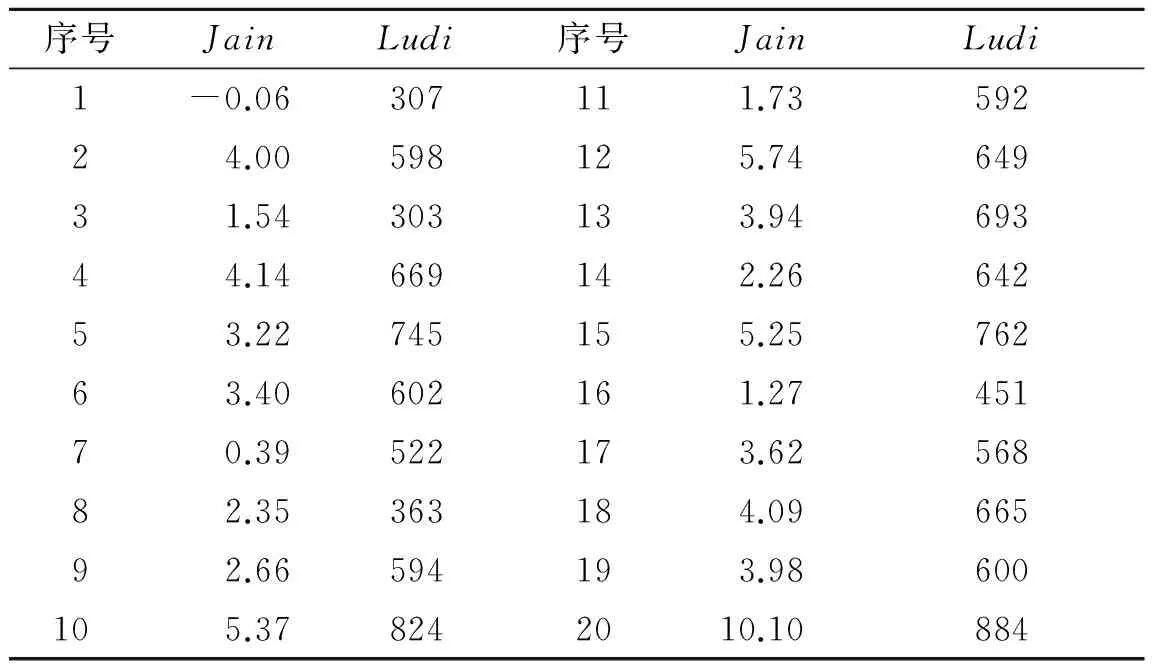
序号JainLudi序号JainLudi1-0.06307111.7359224.00598125.7464931.54303133.9469344.14669142.2664253.22745155.2576263.40602161.2745170.39522173.6256882.35363184.0966592.66594193.98600105.378242010.10884
2.4相互作用模式分析对PPARα的晶体结构进行分析可以看出,PPARα受体的13个α螺旋和1个小四链体的β片层共同组成1个“Y”型的疏水口袋,该疏水口袋即受体与配体的结合区域。PPARα激动剂大多含有1个酸性的头部基团、1个疏水的尾部基团和1个中间的连接部分,以训练集化合物BMS-687453为例,PPARα受体与BMS-687453结合区域及氢键相互作用的结构见图3。由图3可知,BMS-687453的酸性头部基团与尾部的疏水基团以1个“U”型结构与受体结合,见图3(a)。酸性端的O原子作为氢键受体,与PPAR受体上的残基Cys276、Ser280、Tyr314、His440和Tyr464形成5个氢键,见图3(b)和(c)。这种氢键在受体与配体的结合过程中起着至关重要的作用。另外几种训练集化合物与受体形成氢键的情况分别为:AZ242与受体上残基Tyr314(2个氢键)和Tyr464形成3个氢键;CTM与受体上残基Tyr314和Ser280形成2个氢键;GW6471与受体上残基Tyr314和Phe273形成2个氢键;NKS与受体上残基Cys276、Ser280、Tyr314和Tyr464形成4个氢键。根据训练集化合物与受体形成氢键的情况可以看出,PPARα受体的残基Cys276、Ser280、Tyr314和Tyr464是形成氢键的主要残基,这些氨基酸残基与配体形成的氢键网络可以使AF-2(Activationfunction-2)螺旋稳定于一种构象,从而使PPAR处于激活构象,实现基因表达的调控。另外,配体尾部疏水部分与受体的疏水臂形成较强的疏水作用,可增强化合物与受体的结合力。
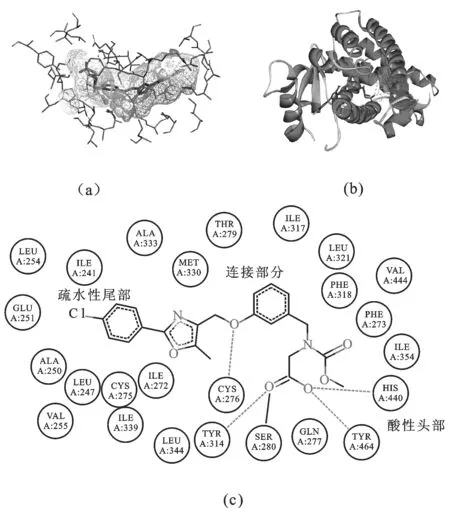
图3PPARα受体和阳性对照物BMS-687453的结构示意图
a.结合图;b.三维结构示意图;c.相互作用平面示意图
Fig.3ThestructuregraphsofthePPARαreceptorandBMS-687453a.bindingregion;b.three-dimensionalstructuregraph;c.planeschematicofinteractionbetweenthereceptorandligand
PPARα受体和阳性对照物BMS-687453的结构示意图见图4。由图4可知,经打分函数后确定的7种潜在药物先导化合物与PPARα受体的氢键作用图可以看出化合物3与残基Tyr314、SER280和TYR464形成3个氢键;化合物8与残基SER280、TYR314(2个)和TYR464形成4个氢键;化合物10与残基SER280形成1个氢键;化合物11与受体无氢键形成;化合物14和16均与残基TYR464形成1个氢键;化合物20与CYS276、SER280、TYR314和TYR464形成4个氢键。综合考虑打分函数及氢键的相互作用,化合物3,8和20与PPARα受体的结合能力较好。为了进一步证明这种结合体现的是配体对受体的激动作用,我们将化合物3,8和20分别与处于激活状态和非激活状态的受体进行分子对接,对接后与激活态的打分值分别为:66.22,95.32和152.66,与非激活态的打分值分别为:53.21,88.24和125.72。结果表明,这3种化合物与激活状态下的受体打分明显高于非激活状态下的受体。综上所述,经过计算机虚拟筛选获得的3种化合物可作为PPARα激动剂的候选药物分子,为今后的实验验证及临床研究奠定基础。
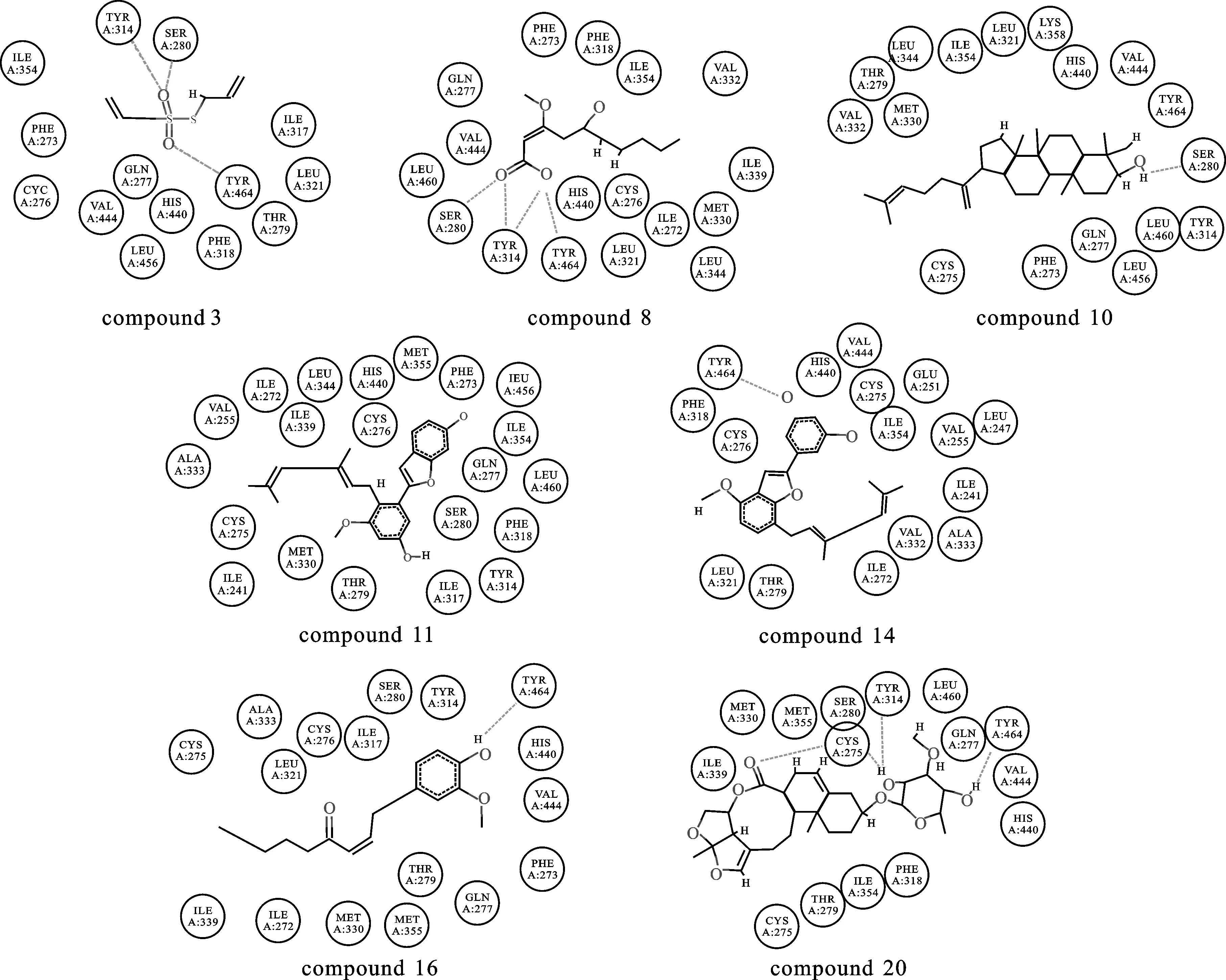
图4PPARα受体和7种先导化合物间氢键相互作用示意图
Fig.4TheschematicofthehydrogenbondinteractionsbetweenthePPARαreceptorand7leadcompounds
3 结论
本文通过对传统中药数据库进行虚拟筛选,从传统中药中获得具有潜在抗动脉粥样硬化作用的PPARα激动剂。通过虚拟筛选得到了20个结合模式合理的化合物,对这些小分子配体与PPARα受体结构进行了分子对接,通过比较打分函数及氢键的相互作用分析共得到了3个理论上与受体结合能力较好的、可作为PPARα受体激动剂的化合物。本文的结果可为研究从传统中药中寻找新型抗动脉粥样硬化药物提供可靠的理论依据。
[1]刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J].西安交通大学学报:医学版,2015,36(2): 141-152.
[2]吴洁,黄东成,申丽丽,等.抗糖尿病疫苗肽IA-2-P2对动脉粥样硬化的影响[J].西北药学杂志, 2014,29(4):373-376.
[3]IssemannI,GreenS.Activationofamemberofthesteroidhormonereceptorsuperfamilybyperoxisomeproliferators[J].Nature,1990,347: 645-650.
[4]ZandbergenF,PlutzkyJ.PPARαinatherosclerosisandinflammation[J].BiochimBiophysActa,2007,1771(8): 972-982.
[5]BouhlelMA,StaelsB,Chinetti-GbaguidiG.Peroxisomeproliferator-activatedreceptorsfromactiveregulatorsofmacrophagebiologytopharmacologicaltargetsinthetreatmentofcardiovasculardisease[J].JInternMed,2008,263(1): 28-42.
[6]WangY,WangY,YangQ,etal.Effectsofbezafibrateontheexpressionofendothelialnitricoxidesynthasegeneanditsmechanismsinculturedbovineendothelialcells[J].Atherosclerosis,2006,187(2): 265-273.
[7]LehmannJM,LenhardJM,OliverBB,etal.Peroxisomeproliferator-activatedreceptorsαandγareactivatedbyindomethacinandothernon-sterooidalanti-inflammationdrugs[J].JBioChem,1997,272(6): 3406-3410.
[8]BernadettePN,JeanF,BartS.Roleoftheperoxisomeproliferator-activatedreceptors(PPAR)inatherosclerosis[J].BiolPharm,2000,60: 1245-1250.
[9]WillsonTM,BrowmPJ,SternbachDD,etal.ThePPARs:fromorphanreceptorstodrugdiscovery[J].JMedChem,2000,43(4): 527-550.
[10]FruchartJC,StaelsB,DuriezP.Theroleoffibricacidsinatherosclerosis[J].CurrAtherosclerRep, 2001,3(1): 83-92.
[11]StaelsB,FruchartJC.Therapeuticrolesofperoxisomeproliferator-activatedreceptoragonists[J].Diabetes,2005,54(8): 2460-2470.
[12]KrysiakR,Gdula-DymekA,BachowskiR,etal.Pleiotropiceffectsofatorvastainandfenofibrateinmetabolicsyndromeanddifferenttypesofpre-diabetes[J].DiabetesCare,2010,33(10): 2266-2270.
[13]钱红霞,李新胜,王荣荣,等.苯扎贝特致严重横纹肌溶解症1例[J].中华临床医师杂志:电子版,2011, 5(20): 6187-6188.
[14]ChenCY.TCMDatabase@Taiwan:theworld’slargesttraditionalChinesemedicinedatabasefordrugscreeninginsilico[J].PLoSONE,2011,6(1):e15939.
[15]吴钉红,袁小红,朱伟,等.半柔性分子对接预测中药治疗银屑病的活性成分[J].西北药学杂志, 2012, 27(4): 299-302.
[16]LiJ,KennedyLJ,ShiY,etal.Discoveryofanoxybenzylglycinebasedperoxisomeproliferatoractivatedreceptorαselectiveagonist2-((3-((2-(4-chlorophenyl)-5-methyloxazol-4-yl)methoxy)benzyl) (methoxycarbonyl)amino)aceticacid(BMS-687453)[J].JMedChem,2010,53(7): 2854-2864.
The virtual screening of anti-atherosclerosis PPARα agonists in traditional Chinese medicines
DU Xia1,ZHANG Xinlei2,LI Ye1*
(1.Institute of Traditional Chinese Medicine,Shaanxi Academy of Traditional Chinese Medicine,Xi′an 710003,China;2.School of Pharmacy,the Fourth Military Medical University,Xi′an 710032,China)
ObjectiveTodiscoverthepotentialanti-atherosclerosisdrugsbasedonthetraditionalChinesemedicines.MethodsTheperoxisomeproliferators-activatedreceptorαagonist(PPARαagonist)isoneofthehotspotsfortreatingatherosclerosis.Inthispaper,acomputer-aideddrugdesign(CADD)methodwasusedtoperformthevirtualscreeningoftraditionalChinesemedicinedatabasebasedonthetargetPPARα ,suchaspharmacophorescreening,moleculardockingandanalysisoftheinteraction.ResultsWefound20compoundsfromthetraditionalChinesemedicinedatabase,whichcontains37 170compoundsinall,andweeventuallyconfirmed3leadcompoundsbyfurtherusingtheanalysisofthehydrogenbondinginteractions.ConclusionTheresultsprovideareferenceforthediscoveryofnewanti-atherosclerosisPPARαagonists.
atherosclerosis;PPARαagonist;pharmacophorescreening;moleculardocking
陕西省中医管理局中医药课题(编号:15-ZY017)
杜霞,女,博士
10.3969/j.issn.1004-2407.2016.05.019
R914
A
1004-2407(2016)05-0505-04
李晔,女,研究员
2015-11-02)
——以高中化学“氢键”的教学为例

