Ki-67与宫颈癌不同辅助治疗方案的远期疗效比较
赵丹洋, 刘美莲
Ki-67与宫颈癌不同辅助治疗方案的远期疗效比较
赵丹洋, 刘美莲
目的研究Ki-67不同表达指数下早期宫颈癌术后不同辅助治疗方案的预后情况。方法收集ⅠB1~ⅡA期宫颈鳞癌患者156例,分为术后单纯放疗方案组(94例)和同期放化疗方案组(62例)。采用免疫组织化学法检测Ki-67表达指数,并分析其不同表达情况下2种治疗方案与无病生存期和总生存期之间的关系。结果98例Ki-67阳性早期宫颈癌患者的无病生存期和总生存期的中位数分别为60月(95%可信区间43.3~76.7月)和62月(95%可信区间45.3~78.7月),其中单纯放疗方案组和同期放化疗方案组的无病生存期的中位数分别为52月(95%可信区间28.9~72.3月)和69月(95%可信区间42.6~95.4月)(P=0.047),总生存期的中位数分别为55月(95%可信区间37.7~75.1月)和71月(95%可信区间44.4~97.6月)(P=0.041);58例Ki-67阴性早期宫颈癌患者的无病生存期和总生存期的中位数分别为72月(95%可信区间54.7~89.3月)和75月(95%可信区间59.0~91.0月),其中单纯放疗方案组和同期放化疗方案组的中位无病生存期和总生存期差别均无统计学意义(P>0.05)。结论Ki-67阳性早期宫颈癌术后同期放化疗综合评价优于单纯放疗方案;Ki-67的表达能否成为早期宫颈癌术后辅助治疗方案的筛选指标之一,仍需进一步的研究证实。
宫颈肿瘤; Ki-67抗原; 放射疗法,辅助; 化学疗法,辅助
宫颈癌是女性最常见的恶性肿瘤之一,发病率位居第4位[1]。随着临床与科研的不断深入,宫颈癌的治疗方案得到了更新和优化。手术、放疗及化疗等治疗手段的发展及综合应用,尤其是术后放疗与化疗的有机结合,使宫颈癌患者的无病生存期(disease-free survival,DFS)与总生存期(overall survival,OS)明显延长。与此同时,Ki-67作为衡量肿瘤细胞增殖活性的敏感指标之一,一直以来被认为与恶性肿瘤、尤其是宫颈癌的恶性程度以及预后情况密切相关。在2013年妇科肿瘤学研究进展中,Ki-67被列为十大最新研究热点之一[2]。近年来,Ki-67能否作为宫颈癌术后辅助治疗方案的筛选指标之一,已引起国内外学者的广泛关注。本研究回顾性分析Ki-67不同表达下,宫颈癌术后不同辅助治疗方案与远期疗效的关系,判断Ki-67能否作为辅助治疗方案的筛选指标之一,进而为临床上选择个体化的辅助治疗方案提供参考依据。
1 对象与方法
1.1对象收集笔者医院病理科于2007年3月-2014年12月存档的宫颈癌石蜡标本共1 107例,年龄(44.65±7.62)岁(29~77岁)。按以下条件筛选出符合标准者156例:(1)无其他恶性肿瘤病史;(2)子宫颈经病理活检证实为鳞癌;(3)依据2009年国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)标准[3],临床分期为ⅠB1~ⅡA期;(4)患者术前未接受任何辅助放化疗;(5)手术方式:广泛性子宫切除术+盆腔淋巴结切除术;(6)术后于放疗科顺利完成全程规范化治疗;(7)具备完整随访资料。患者均经病理组织学确诊及证实具有中、高危因素;按FIGO标准:ⅠB1期67例(42.95%),ⅠB2期39例(25%),ⅡA期50例(32.05%)。
1.2材料以4 μm厚度制作的石蜡切片共156张。鼠抗人单克隆抗体Ki-67 0.1 mL(浓缩型,ZM-0166,南宁市金墨医疗科技有限公司)。SP试剂盒110 mL(通用型,PV-6000,由桂林医学院附属医院病理科提供)。
1.3方法
1.3.1单纯放疗方案外照射放疗(external-beam radiation therapy,EBRT):采用美国单光子瓦里安UNIQUE直线加速器6 MVX线标准分割放疗,放疗范围:上至第4腰椎下缘,下至闭孔下缘,前界为耻骨联合前缘,后界为骶2,3椎间隙,左右至真骨盆外缘外1.5 cm[4]。放疗剂量:每次1.8~2 Gy,每日1次,每周5次,放疗周期5~6周,总剂量50 Gy。根据临床病理特点,可依据淋巴结转移情况外延,经高度适形EB RT追加10~15 Gy。在单纯放疗期间,注意阴道卫生,定期阴道冲洗,防止感染。
1.3.2同步放化疗方案顺铂(cisplatin,DDP)50 mg/m2+氟尿嘧啶(fluorouracil,5-Fu)4 g/m2(96 h持续静脉滴注),放疗第1天和第22天静脉滴注;单药DDP 30 mg/m2静脉滴注,每周1次,放疗第1,8,15,22,29和36天滴注。同时,盐酸格拉司琼注射液3 mg溶于0.9%氯化钠注射液50 mL静脉注射(时间不小于5 min),每次化疗前30 min注射;胃复安20 mg,每日1次,肌内注射;地塞米松10 mg加入生理盐水250 mL,化疗第1,3,5天静脉滴注。化疗期间,患者均给予以上剂量,无用药剂量调整。同期的放疗方案与单纯放疗组相同。
1.3.3预后判断指标通过定期门诊和电话随访,了解患者预后情况,时间截止于2015年4月30日,预后评估的起始时间设为手术日期。终点事件包括失访、死亡以及随访截止。DFS定义为自手术日期起至首次复发及远处转移或死亡的时间[5];OS定义为自手术日期起至出现任何原因引起死亡的时间或末次随访的时间[5]。
1.3.4免疫组织化学法检测Ki-67的表达按照SP试剂盒说明书的操作步骤进行免疫组织化学染色。阴性对照组采用PBS液作为一抗,阳性对照组采用乳腺癌的阳性结果切片。高倍镜(×400)下随机选取10个镜下观察视野。每个视野下计数每100个肿瘤细胞中Ki-67染色阳性即胞核棕黄色的细胞数量,以百分比形式统计。0~10%计为(-),10%以上计为(+)。
1.4统计学处理采用SPSS 18.0版软件进行统计学处理。DFS和OS采用Kaplan-Meier法。计数资料采用χ2检验,计量资料采用t检验,生存率的比较采用Log-rank检验,Cox回归模型进行多因素分析,P<0.05为差别有统计学意义。
2 结 果
2.1影响早期宫颈癌预后中、高危险因素可比性分析该项研究收集早期宫颈癌广泛性子宫切除术+盆腔淋巴结切除术后行辅助治疗方案患者共156例,其中接受单纯放疗方案者94例(单纯放疗组),接受同期放化疗方案者62例(同期化放疗组)。2组患者的预后中、高危险因素均衡可比,差别无统计学意义(P>0.05,表1)。
2.2Ki-67不同表达情况下不同辅助治疗方案的临床特征分布Ki-67阴性表达时(图1A),单纯放疗组的死亡人数为1人,同期放化疗组无人死亡;Ki-67阳性表达时(图1B),单纯放疗组和同期放化疗组的死亡人数分别为3人和1人;Ki-67阳性和阴性表达时,单纯放疗组和同期放化疗组之间病例的确诊年份、年龄和病期分布比较,差别均无统计学意义(P>0.05,表2)。
表中数据为n(%).
2.3生存时间比较
2.3.1Ki-67阳性表达Ki-67阳性表达患者98例,其DFS的中位数为60月(95%可信区间43.3~76.7月),OS的中位数为62月(95%可信区间45.3~78.7月)。单纯放疗组57例,DFS的中位数为52月(95%可信区间28.9~72.3月),OS的中位数为55月(95%可信区间37.7~75.1月);同期放化疗组41例,DFS的中位数为69月(95%可信区间42.6~95.4月),OS的中位数为71月(95%可信区间44.4~97.6月);2组的DFS及OS中位数比较,差别均有统计学意义(P=0.047,P=0.041,图2)。
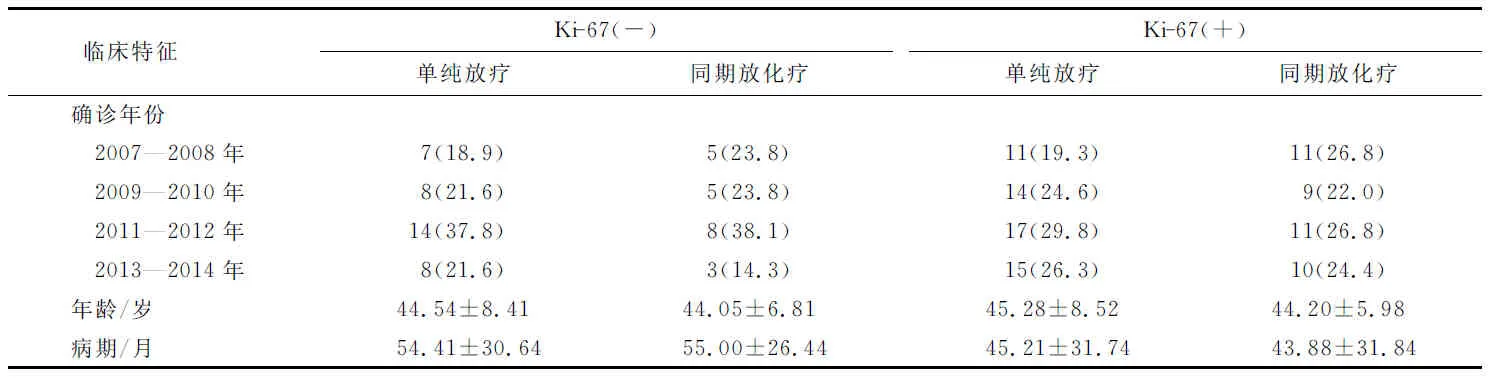
表2 接受不同辅助治疗方案宫颈癌患者的临床特征
表中确诊年份数据为n(%).
2.3.2Ki-67阴性表达Ki-67阴性表达患者58例,其DFS的中位数为72月(95%可信区间54.7~89.3月),OS的中位数为75月(95%可信区间59.0~91.0月)。单纯放疗组37例,DFS的中位数为59月(95%可信区间34.8~67.0月),OS的中位数为60月(95%可信区间53.0~83.2月)。同期放化疗组21例,DFS的中位数为82月(95%可信区间68.6~90.7月),OS的中位数为87月(95%可信区间73.3~105.4月);2组的DFS及OS的中位数比较,差别均无统计学意义(P>0.05)。
2.4结局指标Ki-67阳性表达下,单纯放疗组中局部复发患者11例,区域转移患者2例,远处转移患者3例,局部控制率为80.7%;同期放化疗组中局部复发患者2例,区域转移患者2例,远处转移患者1例,局部控制率为95.1%,2组差别有统计学意义(χ2=4.310,P=0.034)。Ki-67阴性表达下,单纯放疗组中局部复发患者4例,区域转移患者1例,远处转移患者1例,局部控制率为89.2%;同期放化疗组中局部复发患者5例,区域转移患者1例,远处转移患者2例,局部控制率为76.2%。2组比较,差别无统计学意义(χ2=1.727,P=0.174)。
2.5毒副反应主要毒副反应发生于骨骼造血系统、消化系统和泌尿系统。Ki-67阴性表达下,单纯放疗组各项毒副反应发生率均低于同期放化疗组,除腹泻症状发生率差别无统计学意义外,其他毒副反应发生率比较,差别均有统计学意义(表3);Ki-67阳性表达下,单纯放疗组白细胞减少发生率高于同期放化疗组,其他副反应发生率均低于同期放化疗组,2组之间恶心呕吐发生率差别有统计学意义,其他毒副反应发生率差别均无统计学意义(P>0.05,表3)。对于骨髓抑制患者,应用粒细胞集落刺激因子(2.5 μg/kg)升高白细胞;恶心呕吐患者给予格拉司琼止吐治疗;以上症状经用药后能明显缓解,可确保放化疗方案的顺利进行。
2.6预后影响因素分析单因素生存分析证实淋巴脉管间隙浸润、间质浸润、宫颈肿瘤直径、淋巴结浸润与早期宫颈癌术后患者总生存期之间存在相关性(P<0.05,表4);将以上因素指标进行多因素生存分析,经Cox比例风险模型统计显示:淋巴脉管间隙浸润、间质浸润和淋巴结浸润是影响早期宫颈癌术后患者总生存期的独立因素(P<0.05);淋巴脉管间隙浸润阳性者的死亡风险为阴性者的1.42倍;间质浸润达深1/3者的死亡风险为浅1/3者的1.32倍,淋巴结阳性者的死亡风险是阴性者的1.83倍(表4)。

表3 Ki-67不同表达下2组方案的毒副作用
表中数据为n(%).与Ki-67(-)单纯放疗组比较,▲:P<0.05;与Ki-67(+)单纯放疗组比较,#:P<0.05.
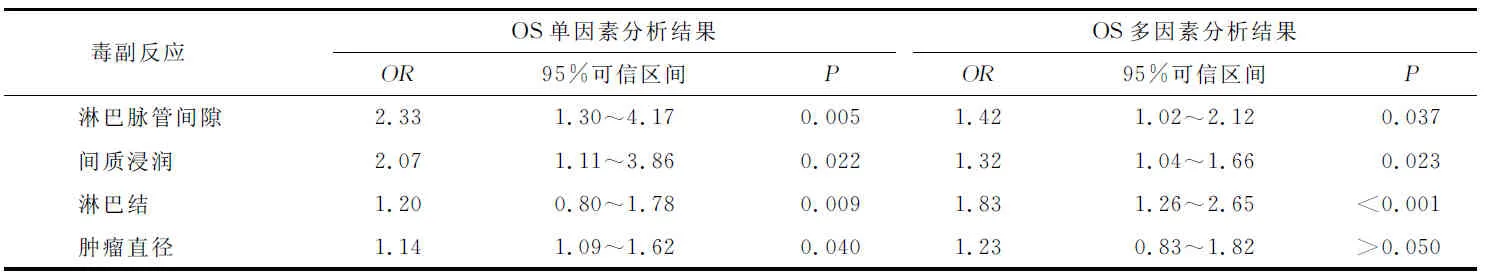
表4 早期宫颈癌术后患者总生存期的单因素分析和多因素分析
3 讨 论
Ki-67在众多研究中被证实是一种反映肿瘤细胞增殖活性的敏感生物学指标[6];其机制是在细胞分裂周期中,Ki-67的表达指数随着分裂间期胞内蛋白质合成的开始而逐渐升高,直至分裂期(M期)达高峰,并随即在分裂静止期(G0期)无表达[7]。由于放疗对于处在细胞分裂M期的肿瘤细胞最敏感,因此近年来众多学者针对Ki-67的表达与宫颈癌放疗敏感性之间的关系进行研究。Nakano等通过对宫颈癌放疗后生存情况的分析,表明Ki-67表达指数>33%的宫颈癌患者,其放射性改变明显,提出Ki-67的表达与宫颈癌的放射敏感性呈正相关[8]。李玲的研究显示,Ki-67的表达率在58.3%时,宫颈癌对放射高度敏感,并提出与Nakano等一致的结论[9]。上述研究结论从分子水平上可以理解为放疗对于Ki-67高表达的G2期和M期肿瘤细胞的敏感性最高。然而,宫颈癌术后通过辅助放疗后,仍存在肿瘤的复发甚至转移,造成放疗疗效不佳。这种肿瘤细胞再增殖现象的本质是尚存的肿瘤克隆源性干细胞在放疗期间持续增殖的过程[10],是导致肿瘤放疗疗效下降的主要原因之一。Huang等首次利用线性二次方模型证实宫颈癌术后辅助放疗过程中存在肿瘤细胞再增殖,并指出肿瘤细胞再增殖发生在放疗开始后19天[11]。Lauber等认为以常规放疗为基础的调强放疗可以诱导细胞凋亡,从而激活半胱氨酸天冬氨酸蛋白酶3,后者促进前列腺素E2的产生,致使肿瘤细胞再增殖[12]。放疗与化疗恰当地结合,能较好地控制肿瘤局部复发和远处转移,改善患者远期预后[13]。化疗的作用机理与放疗不同,它将处在G0期的肿瘤细胞过渡到M期,使其同步化于放疗敏感的细胞周期,并降低乏氧细胞的数量,提高肿瘤细胞的氧合指数,从而增强放疗敏感性;同时阻碍放疗期间受损肿瘤细胞的修复,抑制其再增殖,缩小肿瘤体积[14];另外,化疗对于放疗耐受的S期细胞以及复发和远处转移的肿瘤细胞具有直接杀伤力,进而降低肿瘤细胞的侵袭力,提高远期疗效。除此之外,细胞的增殖活性越强,对细胞毒药物的敏感性越高。为此,众多学者对宫颈癌术后同期放化疗方案的疗效进行了研究。Ryu等研究表明早期宫颈癌根治术后同期放化疗与单纯放疗相比,更能提高3年无瘤生存率与总生存率,降低肿瘤复发率和远处转移率[15];与芦芸等研究结果基本一致[16]。
本研究结果显示:Ki-67阳性表达下,术后单纯放疗组与同期放化疗组之间生存指标存在显著差别(P<0.05),同期放化疗组DFS与OS均明显高于单纯放疗组;而在Ki-67阴性组中,同期放化疗组DFS和OS虽均高于单纯放疗组,但二者差别无统计学意义(P>0.05),原因可能是影响预后的淋巴脉管间隙浸润、间质浸润和淋巴结浸润等因素的混杂,影响了2组方案之间DFS和OS的差别,该研究结果与上述Ki-67与放疗和化疗之间敏感性的研究结果基本一致。Song等的研究证实,早期宫颈癌术后同期放化疗能够明显减少盆腔复发率(P=0.012)和远处转移率(P=0.027)[17],与Takeshita等提出的结论相似[18]。本研究证实Ki-67阳性表达下,同期放化疗组局部控制率明显高于单纯放疗组,与上述结论基本一致;而Ki-67阴性表达下,结果恰好相反,两方案差别无统计学意义,可能原因为Ki-67阴性表达的病例数量较少,肿瘤复发、转移及死亡事件发生数量较少。Eifel等和戚世芳等的研究表明,放化疗毒副反应中,胃肠道反应和膀胱炎等泌尿系统反应方面,同期放化疗组发生率高于单纯放疗组[19-20];同时,Takeshita等和戚世芳等研究提出同期放化疗组的骨髓抑制发生率高于单纯放疗组(RR=2.30,95%可信区间1.67~3.15,P<0.001)[18,20]。本研究结果与上述结论基本一致,Ki-67阳性表达下,单纯放疗组白细胞减少发生率虽高于同期放化疗,但差别并无统计学意义。
综上所述,当间质浸润、淋巴脉管间隙阳性或淋巴结阳性时,结合Ki-67阳性表达,采用同期放化疗方案可在提高DFS和OS的同时降低局部复发率;但同时会增加毒副反应发生率,尤其是胃肠道反应。在临床工作中,医生做到提前预防,积极对症治疗,能缓解不良反应,确保治疗方案的顺利进行。而Ki-67阴性时,同期放化疗组的DFS和OS与单纯放疗组并无统计学差别,而且局部控制率要低于单纯放疗组。因此笔者认为,Ki-67阳性早期宫颈癌术后同期放化疗综合评价优于单纯放疗方案。但由于回顾性研究的局限性,样本量较少,随访时间不及时,且Ki-67虽为集中检测,但存在操作差别、实验环境的改变及阅片判读标准等因素的影响,故Ki-67的表达能否成为早期宫颈癌术后辅助治疗方案的筛选指标之一,仍需进一步的研究证实。在随后的研究中,应统一指标规范检测,同时增加病例数量,并以更加严谨的前瞻性随机对照试验作为首选研究方法,以其为临床提供客观参考依据。
[1]Torre L A,Bray F,Siegel R L,etal. Global Cancer Statistics,2012[J].CACancerJClin,2015,65(2):87-108.
[2]Snh D H,Kim J W,Kang S,etal. Major clincal research advances in gynecologic cancer in 2013 [J].JGynecolOncol,2014,25(3):236-248.
[3]Pecorelli S. Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium[J].IntJGynaecolObstet,2009,105(2):103-104.
[4]任锦霞,赵林,吉宏,等.宫颈癌根治术后常规放射治疗与三维适形放射治疗的临床观察[J]. 兰州大学学报:医学版,2012,38(3):61-64.
[5]魏素菊,胡波飞,洪雷,等. Ki-67阳性或阴性表达乳腺癌不同辅助治疗方案的远期疗效比较[J]. 临床肿瘤学杂志,2012,17(10):889-893.
[6]Ladstein R G,Bachmann I M,Straume O,etal. Ki-67 expression is superior to mitotic count and novel proliferation markers PHH3,MCM4 and mitosin as a prognostic factor in thick cutaneous melanoma[J].BMCCancer,2010,10:140.
[7]侯宝洲,孙剑经.β-catenin、TopoⅡ和Ki-67在恶性肿瘤中的作用研究进展[J]. 河北北方学院学报:自然科学版,2013,29(5):109-113.
[8]Nakano T,Kuniyuki O. Differential values of Ki67 index and mitotic index of proliferating cell population: an assessment of cell cycle and prognosis in radiation therapy for cervical cancer[J].Cancer,1993,72(8):2401-2408.
[9]李玲. 宫颈癌放疗敏感相关因子的初步研究[J].临床和实验医学杂志,2010,9(4):253-254.
[10]Kendal W S. Extinction kinetics for metastatic cancer stem cells[J].IntJRadiatBiol,2010,86(11):918-926.
[11]Huang Z,Mayr N A,Gao M,etal. Onset time of tumor repopulation for cervical cancer:first evidence from clinical data[J].IntJRadiatOncolBiolPhys,2012,84(2):478-484.
[12]Lauber K,Munoz L E,Berens C,etal. Apoptosis induction and tumor cell repopulation:the yin and yang of radiotherapy[J].RadiatOncol,2011,19(6):176.
[13]Mossa B,Mossa S,Marziani R. Adjuvant chemotherapy versus radiation therapy after radical surgery in high-risk positive node stage ⅠB/ⅡA cervical cancer[J].EurJGynaecolOncol,2010,31(5):545-550.
[14]陈涛利,卞翠翠,杨雷,等.早期高危宫颈癌患者术后不同治疗方案的临床疗效[J]. 中国老年学杂志,2015,35(1):55-57.
[15]Ryu S Y,Park S I,Nam B H,etal. Is adjuvant chemoradiotherapy overtreatment in cervical cancer patients with intermediate risk factors[J].IntJRadiatOncolBiolPhys,2011,79(3):794-799.
[16]芦芸,毕学汉,杨永秀. 宫颈癌根治术后辅助放化疗有效性和安全性的Meta分析[J]. 国际妇产科杂志,2013,40(1):84-87.
[17]Song S,Song C,Kim H J,etal. 20 year experience of postoperative radiotherapy in ⅠB~ⅡA cervical cancer patients with intermediate risk factors:impact of treatment period and concurrent chemotherapy[J].GynecolOncol,2012,124(1):63-67.
[18]Takeshita S,Kita T,Motoike Y,etal. Postoperative concurrent chemoradiotherapy for the high-risk uterine cervical cancer[J].JObstetGynaecolRes,2010,36(5):1009-1014.
[19]Eifel P J,Winter K,Morris M,etal. Pelvic irradiation with concurrent chemotherapy versus pelvic and para-aortic irradiation for high-risk cervical cancer:an update of radiation therapy oncology group trial(RTOG)90-01[J].JClinOncol,2004,22(5):872-880.
[20]戚世芳,刘华,田晓予.早期高危宫颈癌术后同步放化疗的临床研究[J]. 中国实用医药,2010,5(34):5-6.
(编辑:张慧茹)
Long-Term Response of Different Adjuvant Therapies in Uterine Cervical Cancer with Ki-67
ZHAO Danyang, LIU Meilian
Department of Radiotherapy, Affiliated Hospital of Guilin Medical College, Guilin 541004, China
ObjectiveTo investigate the prognosis of different post-operative adjuvant therapies in patients of early-stage cervical cancer with different expressions of proliferating cell nuclear antigen (Ki-67).MethodsOf 156 postoperative patients with stageⅠB1~ⅡA cervical squamous cell carcinoma, 94 received radiotherapy and 62 received chemoradiotherapy.The expression of Ki-67 was detected by immunohistochemistry at diagnosis.Two clinical outcomes, being disease-free survival (DFS) and overall survival (OS) after either adjuvant treatment schemes in relationship with the status of Ki-67 repression were statistically analyzed.ResultsFor the 98 cases of early-stage cervical cancer with Ki-67 positive expression, the median DFS and OS were 60 months (95% confidence internal:43.3~76.7 months) and 62 months (95% confidence internal:45.3~78.7 months).Of those 98 cases, ones who accepted radiotherapy and chemoradiotherapy, had median of DFS of 52 months (95% confidence internal:28.9~72.3 months) and 69 months(95% confidence internal:42.6~95.4 months) (P=0.047),and had median OS of 55 months (95% confidence internal:37.7~75.1 months) and 71 months(95% confidence internal:44.4~97.6 months) (P=0.041). For the 58 cases of early-stage cervical cancer with Ki-67 negative expression, the median of DFS and OS were 72 months (95% confidence internal:54.7~89.3 months) and 75 months (95% confidence internal:59.0~91.0 months), with no significant difference statistically in the median DFS and OS between radiotherapy and chemoradiotherapy (P>0.05).ConclusionFor early-stage cervical cancer post-operatively, chemoradiotherapy is superior to radiotherapy in patients with Ki-67 positive expression, based on our comprehensive analysis.Whether the expression of Ki-67 after operation can be used as a screening index to choose the postoperative adjuvant therapy for patients with early-stage uterine cervical cancer needs to be further studied.
uterine cervical neoplasms; Ki-67 antigen; radiotherapy, adjuvant; chemotherapy, adjuvant
2015-12-19
桂林市科学研究与技术开发计划项目(20130120-11)
桂林医学院附属医院 放疗科,桂林541004
赵丹洋(1991-),女,桂林医学院2014级硕士研究生
刘美莲. Email: liu.meilian@163.com
R341; R45; R730.231; R737.33; R977.6
A
1672-4194(2016)03-0195-06

