小鼠膝关节骨关节炎细胞因子的表达
林旭晨, 赵 畅, 曾 春, 王文昊, 柳 鑫, 蔡道章
小鼠膝关节骨关节炎细胞因子的表达
林旭晨, 赵畅, 曾春, 王文昊, 柳鑫, 蔡道章
目的初步探讨实验性骨关节炎小鼠不同时间不同免疫应激情况下细胞因子的表达。方法8周龄健康清洁级C57小鼠随机分为实验组和对照组2组。实验组小鼠激活免疫系统,1周后实验组和对照组小鼠同时行右侧膝关节DMM手术(即手术部分切除右侧膝关节内侧半月板)。分别于术后4,8周取膝关节病理标本,进行关节组织切片番红O快绿染色和mankin评分,免疫组织化学技术检测MMP13表达情况,RT-qPCR检测滑膜组织IL-1β、IL-6、TNF-α等细胞因子以及X型胶原的表达。结果与对照组比较,手术后4,8周,实验组mankin评分、各细胞因子mRNA表达和X型胶原mRNA表达均高于对照组(P<0.05)。结论免疫应激条件下,关节组织中胶原及细胞因子呈现差异性表达。
骨关节炎; 骨关节炎, 膝; 免疫系统; 白细胞介素1; 白细胞介素6; 肿瘤坏死因子α
骨关节炎(osteoarthritis,OA)是关节炎中最为常见的一种,是引起中老年人疼痛和伤残的主要原因之一,严重地影响了中老年患者的生活质量。随着人类寿命的延长以及人口老龄化的加剧,OA发病率呈现逐年增高趋势[1-2]。传统观念普遍认为,OA是一种非炎症性退行性病变,其病因复杂,创伤、衰老、炎症、肥胖及遗传等因素均在发病中起着一定的作用[3]。近期研究表明,免疫系统和OA的进展存在一定的相关性[4]。然而,以往研究主要集中于研究不同严重程度OA对患者免疫系统的影响,未能探明免疫系统与OA之间的因果关系。本研究通过激活小鼠的免疫系统,再经过手术诱发小鼠的OA,以未激活免疫系统的小鼠为对照组,收集小鼠关节样本,应用形态学和RT-qPCR方法,初步探究免疫系统激活在OA的病理过程中所起的作用。
1 材料与方法
1.1材料动物:健康雄性清洁级C57小鼠40只,8周龄,体质量22~24 g,由广东省医学实验动物中心提供(合格证号:No 44007200021628)。试剂:MMP13抗体(英国Abcam公司);番红O快绿(美国Sigma公司);GenStar反转录试剂盒(A214 starscript Ⅱ first-strand cDNA synthesis Mix,北京康润生物有限公司);GenStar实时荧光定量PCR试剂盒[A364 2×realstar power probe mixture(with ROX Ⅱ),北京康润生物有限公司]。RT-qPCR仪(7500 fast real-time PCR system,美国Applied Biosystems公司)。
1.2方法
1.2.1抗原制备卵清蛋白(ovalbumin,OVA)粉末(美国Sigma公司)用无菌PBS溶解后配制成10 mg/mL的储液放入-20 ℃冰箱储存,少量分装,避免反复冻融。再用无菌PBS将上述OVA储液稀释成1 mg/mL的工作浓度,每100 μg OVA抗原液加入100 μg铝盐佐剂,在冰上充分混匀。
1.2.2分组与建模将40只小鼠分别编号为1~40,利用随机数表法随机抽选出20只为实验组,余20只为对照组。实验组小鼠激活免疫系统,对照组不做任何处理。
1.2.2.1小鼠免疫系统激活利用配制好的抗原溶液,每只小鼠每次腹腔注射100 μL即可。
1.2.2.2OA模型建立实验组小鼠激活免疫系统1周(9周龄)后,实验组和对照组小鼠同时行右侧膝关节不稳定的内侧半月板(destabilization of the medial meniscus, DMM)手术,即部分切除右侧膝关节内侧半月板:用1%戊巴比妥钠腹腔麻醉后,剃净右膝关节周围鼠毛并用碘伏消毒。将小鼠固定于解剖显微镜下,在右膝关节部位用眼科剪纵向剪开皮肤,长度1 cm左右。用手术刀沿髌骨内侧纵向切开肌肉,将髌骨向外侧翻并固定,从而暴露出关节解剖结构,首先离断其内侧半月板-胫骨韧带,其次摘除部分内侧半月板。将外翻的髌骨复位,并用眼科针缝合切口。整个手术过程均在实验室无菌手术操作间完成。术后将小鼠置于笼中饲养,自由摄食摄水并自由活动。
1.2.3检测项目
1.2.3.1组织取材实验组小鼠在术后第3天补打抗原1次,术后第3周第2次补打抗原。术后第4周,实验组与对照组各取10只处死,其中5对取小鼠关节进行组织切片,5对取关节滑膜等软组织并提取RNA以检测相应的炎症因子的变化;另10对小鼠中,实验组小鼠于术后第5周和第7周分别进行第3及第4次补打抗原,术后8周对这10对小鼠进行相同处理取材。具体步骤如下:将小鼠断颈处死,取右膝关节并将肌肉除净。将处理好的关节置于4%多聚甲醛4 ℃冰箱固定过夜,再用4%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)脱钙2周。洗净脱钙液,脱水并石蜡包埋。
1.2.3.2番红O快绿染色与mankin评分蜡块修整后切片,切片厚度5 μm,置于37 ℃过夜干燥。将组织切片置于60 ℃电热恒温鼓风干燥箱中烤片2 h。在二甲苯和梯度乙醇(95%,90%,80%)中进行脱蜡水化。苏木精染色2 min,水洗,1%固绿水溶液中染色10 s,水洗,0.5%番红O染液中染色2 min,过夜风干并封片。光镜下观察切片中关节组织结构改变,参照改良mankin评分标准进行评分并统计,评分越高,OA情况越严重[5]。
1.2.3.3免疫组织化学染色切片脱蜡水化,置于37 ℃孵箱中蛋白酶K修复5 min,去离子水洗5 min×3次,室温下滴加3%内源性过氧化物酶阻断剂避光孵育10 min,去离子水洗5 min×3次,山羊血清室温封闭1 h,PBS洗5 min×1次,4 ℃条件下滴加兔多克隆抗体MMP13一抗工作液(1∶200)孵育过夜,PBS洗5 min×3次,室温下滴加兔抗鼠二抗(1∶200)后孵育1 h,PBS洗5 min×3次,滴加DAB显色液显色后脱水并用中性树胶封片。
1.2.3.4关节滑膜等软组织总RNA提取与RT-qPCR由于小鼠关节体积小,单取滑膜难度过高且量不足,所以将其除肌肉及韧带之外的关节囊、滑膜等软组织一并取下,在研钵中加液氮研磨,然后加TRIZOL 1 mL充分裂解组织,加入氯仿200 μL并混匀,静置3 min后10 000 r/min离心15 min,取上清液,加入等体积异丙醇并混匀,静置15 min后12 000 r/min离心10 min,弃上清液,加入75%乙醇混匀,7 500 r/min离心5 min,弃上清液,待乙醇自然风干后加入30 μL无菌三蒸水溶解沉淀。
将所得总RNA按照GenStar反转录试剂盒说明书中的操作方法反转为cDNA,并置于-20 ℃长久保存。将所得cDNA按GenStar实时荧光定量PCR试剂盒说明书中的操作过程预混成相应体系,并使用RT-qPCR仪进行荧光定量PCR检测。所得数据利用7500 Software v2.0.5进行分析。RT-qPCR引物序列见表1。
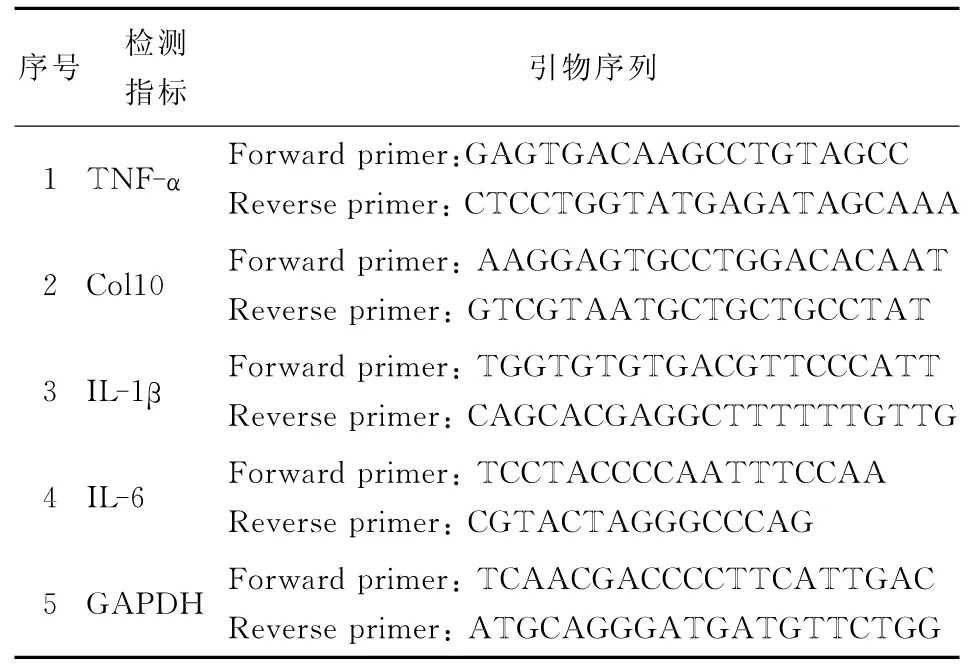
表1 RT-qPCR引物序列
2 结 果
2.1小鼠一般情况实验过程中,各组小鼠体质量无降低,一般状态良好,饮食饮水正常,精神状态佳,皮毛有光泽,反应灵敏(表2)。

表2 对照组和实验组小鼠体质量变化情况
2.2小鼠关节的组织学评估对小鼠膝关节切片进行番红O快绿染色(图1),并依据染色结果进行mankin病理评分(图2)。与对照组比较,4周与8周时实验组评分均高于对照组(P<0.01)。
2.3小鼠关节MMP13及X型胶原表达MMP13免疫组织化学染色(图3)和X型胶原mRNA RT-qPCR(图4)结果显示,4周和8周时,实验组MMP13免疫组织化学表达强度均高于对照组(P<0.01);X型胶原mRNA的表达,实验组也显著高于对照组(P<0.01或P<0.05)。
2.4小鼠关节滑膜组织中细胞因子RT-qPCR对IL-1β、IL-6、TNF-α等相关细胞因子进行RT-qPCR检测显示,DMM手术后4周与8周时,IL-1β、IL-6、TNF-α等相关细胞因子表达量实验组均明显高于对照组(P<0.01,图5)。
3 讨 论
OA是常见于老年人的关节退行性疾病,研究的发病机制中有众多的病原学因素,遗传、年龄以及损伤是公认的危险因素[6]。新近研究表明,先天免疫系统可能参与OA这种炎症反应,然而,它们是如何引起OA关节损伤,至今仍不清楚[7]。研究表明,滑膜中的含钙晶体可能会与先天免疫系统的组成部分直接相互作用,以及通过诱导或放大其他炎症信号,使OA组织发生炎症反应,含钙晶体可以促进滑膜细胞和软骨细胞产生促炎物质。然而,含钙晶体、炎症和OA之间的关系是复杂的[8]。本研究旨在通过对实验小鼠免疫系统进行活化,初步探讨OA与免疫系统的关系。
小鼠关节番红O快绿染色后mankin评分结果反应的是OA的严重程度趋势,与免疫组织化学染色结果及各细胞因子表达的趋势相一致。基础病理研究发现,患者膝关节出现大量的软骨基质矿化结晶均存在软骨表面及滑膜组织,产生骨赘及滑膜肿胀症状[9]。胶原是细胞外基质成分之一,属纤维蛋白质[10]。不同类型胶原在分布、结构、形态与功能上各不相同,胶原蛋白具有独特的氨基酸组成,基本结构单位是胶原分子,每个分子由3条多肽链(α链) 互相缠绕成三螺旋结构[11]。Ⅱ型胶原蛋白形成的网状结构遭到破坏,被认为是骨性关节炎发生过程中的重要环节,软骨的这种框架结构被破坏后会引发软骨生物力学、生物化学等一系列变化[12],MMP13作为反应软骨退化的主要酶类之一,除了能够反应关节软骨中Ⅱ型胶原的退化情况,还能够反应出关节软骨中蛋白多糖等成分的退化情况;有研究表明,发生关节软骨破坏的患者的软骨中MMP13呈现高表达,提示MMP13表达的增加与软骨退化相关。通过利用MMP13过表达的转基因小鼠发现,其表现出类似于OA的自发性关节软骨破坏,因而更进一步说明了软骨的破坏与退化和MMP13的高表达是相关的[13]。研究证明,在正常情况下X型胶原存在于关节软骨与骨交界处的钙化软骨层,是关节软骨与骨的分界面,小鼠免疫系统被活化,说明X型胶原在骨性关节炎的发病过程中也起一定作用[14]。X型胶原散在于骨性关节炎的基质中,在OA的进展中起到一定的作用[5]。笔者的实验对小鼠MMP13进行免疫组织化学,反应其Ⅱ型胶原蛋白的表达,并采用RT-qPCR检测X型胶原的表达,结果显示,实验组MMP13和X型胶原mRNA均明显高于对照组。
OA的发生发展与分子水平的炎症反应导致软骨的损伤关系密切,OA患者的软骨损伤可能是软骨细胞对局部组织损伤的过度反应,目的在于去除受损的软骨组织,生成新生组织并起到替代的作用[15]。机械应力异常会活化处于低代谢状态的关节软骨细胞,并刺激细胞产生一系列的炎症介质,如IL-1β、IL-6、TNF-α等,这些介质通常是机体处于炎症或损伤的情况下由巨噬细胞释放,可促进软骨细胞的分解代谢,引起软骨细胞释放的蛋白聚糖酶和基质金属蛋白酶等水解酶增加,导致软骨组织损伤,在软骨基质降解过程中发挥作用[16-18]。白细胞介素、肿瘤坏死因子、基质金属蛋白酶、氧自由基等这些炎性介质的持续存在可能破坏其余正常软骨,甚至引起新的损伤[19]。白细胞介素及肿瘤坏死因子被认为是重要的前炎性细胞因子,它们主要调节炎症中多种相关细胞的相互反应并参与损伤后的修复过程[20]。然而,这些细胞因子并非独立行使功能,它们有相互重叠的生物学活性,而且彼此间形成信号网络[21],这体现了OA作用机制上的复杂性,有待进一步的研究。
笔者认为,不同免疫应激条件下,关节中胶原及细胞因子呈现差异性表达,提示在OA的进展过程中,免疫系统通过某种方式影响了其疾病的严重程度。
[1]李子荣. 膝关节骨关节炎:以循证医学为基础的诊断和治疗选择[J]. 中华全科医师杂志, 2013,12(2):81-83.
[2]陆艳红,石晓兵. 膝骨关节炎国内外流行病学研究现状及进展[J]. 中国中医骨伤科杂志, 2012(6):81-84.
[3]石晓明,于占革. 骨关节炎发病机制的研究进展[J]. 中华临床医师杂志:电子版, 2013(24):284-286.
[4]陈金伟,吕杰,俞银贤,等. 膝骨关节炎中天然免疫和TLR/NF-κB信号通路的研究进展[J]. 中华临床医师杂志:电子版, 2013(24):281-283.
[5]Huang M J,Wang L,Jin D D,etal. Enhancement of the synthesis of n-3 PUFAs in fat-1 transgenic mice inhibits mTORC1 signalling and delays surgically induced osteoarthritis in comparison with wild-type mice.[J].AnnalsoftheRheumaticDiseases, 2014,73(9):1719-1727.
[6]朱芳晓,周润华. 晶体,炎症与骨关节炎的研究进展[J]. 中国现代医药杂志, 2012,14(12):115-117.
[7]Annaswamy T M,Gosai E V,Jevsevar D S,etal. The role of intra-articular hyaluronic acid in symptomatic osteoarthritis of the knee[J].Pm&RJInjuryFunction&Rehabilitation, 2015,7(9) :995-1001.
[8]Courties A,Gualillo O,Berenbaum F,etal. Metabolic stress-induced joint inflammation and osteoarthritis[J].Osteoarthritis&Cartilage, 2015,23(11):1955-1965.
[9]刘建湘,杜靖远,杨述华. 大鼠实验性骨关节炎模型的建立及病理特征[J]. 华中科技大学学报:医学版, 2009,38(1):98-102.
[10]陈崇伟,卫小春,杨自权,等. 伸膝制动骨关节炎动物模型软骨内胶原变化的观察[J]. 中华风湿病学杂志, 2003,7(6):332-335.
[11]Naraoka T,Ishibashi Y,Tsuda E,etal. Periodic knee injections of collagen tripeptide delay cartilage degeneration in rabbit experimental osteoarthritis[J].ArthritisResearch&Therapy, 2013,15(1):1-10.
[12]Kumahashi N,Swärd P,Larsson S,etal. Type Ⅱ collagen C2C epitope in human synovial fluid and serum after knee injury-associations with molecular and structural markers of injury[J].Osteoarthritis&Cartilage, 2015,23(9):1506-1512.
[13]Wang M,Sampson E R,Jin H,etal. MMP13 is a critical target gene during the progression of osteoarthritis[J].ArthritisResearch&Therapy, 2013,15(1):R5-R5.
[14]Kalai E,Bahlous A,Charni N,etal. Increased urinary type Ⅱ collagen C-telopeptide levels in tunisian patients with knee osteoarthritis[J].ClinicalLaboratory, 2012,58(3-4):209-215.
[15]Driban J B,Lo G H,Eaton C B,etal. Knee pain and a prior injury are associated with increased risk of a new knee injury: data from the osteoarthritis initiative[J].JournalofRheumatology, 2015,42(8):1463-1469.
[16]Centeno C J,Al-Sayegh H,Bashir J,etal. A dose response analysis of a specific bone marrow concentrate treatment protocol for knee osteoarthritis[J].BmcMusculoskeletalDisorders, 2015,16(1):1-8.
[17]Edd S N,Giori N J,Andriacchi T P. The role of inflammation in the initiation of osteoarthritis after meniscal damage[J].JournalofBiomechanics, 2015,48(8):1420-1426.
[18]Afara I O,Prasadam I,Moody H,etal. Near infrared spectroscopy for rapid determination of mankin score components: a potential tool for quantitative characterization of articular cartilage at surgery[J].ArthroscopytheJournalofArthroscopic&RelatedSurgery, 2014,30(9):1146-1155.
[19]Thomas M,Sittisak H. Cytokines as biochemical markers for knee osteoarthritis.[J].WorldJournalofOrthopaedics, 2015,6(1):95-105.
[20]Fischer J A,Hueber A J,Wilson S,etal. Combined inhibition of tumor necrosis factor α and interleukin-17 as a therapeutic opportunity in rheumatoid arthritis: development and characterization of a novel bispecific antibody[J].ArthritisRheumatol, 2015,67(1):51-62.
[21]Imamura M,Targino R A,Hsing W T,etal. Concentration of cytokines in patients with osteoarthritis of the knee and fibromyalgia[J].ClinicalInterventionsinAging, 2014,9(9):939-944.
(编辑:常志卫)
Expression of Cytokines in Mice Knee Osteoarthritis
LIN Xuchen, ZHAO Chang, ZENG Chun, WANG Wenhao, LIU Xin, CAI Daozhang
Department of Joint Surgery and Sport Medicine, The Third Affiliated Hospital of Southern Medical University,Academy of Orthopedics of Guangdong Province, Guangzhou 510630, China
ObjectiveTo investigate the expression of cytokines in experimental osteoarthritis in mice at different time and different immune stress.MethodsC57 mice aged 8 weeks were randomly divided into 2 groups, the experimental group and control group.One week after the mice in experimental group undergoing activation of the immune system, and after one week, the mice in experimental group and control group underwent DMM surgery on the right side of the knee joint at the same time (the medial meniscus of the right knee was removed and the medial collateral ligament was broken).In 4 weeks and 8 weeks post-surgery, the pathological specimens of knee joint were obtained and the knee joint tissue section was used for red fast green dyeing, and for MMP13 expression by immunohistochemical detection, and the synovial tissue was used to detect cytokines IL-1β, IL-6, TNF-α expression by RT-qPCR.ResultsIn 4 and 8 weeks after the surgery, the mankin score in experimental group was significantly higher than that in the control group, and the difference was statistically significant,P<0.05; and in 4 and 8 weeks, the expression of type ten collagen mRNA in the experimental group was significantly higher than that of control group; and IL-1β, IL-6, TNFα mRNA expression in the experimental group were also higher than that of the control group,P<0.05.ConclusionIn different immunological stress states, the expression of cytokines and collagen has differential expression, suggesting that in the process of osteoarthritis, the immune system may affect the severity of this disease somehow.
osteoarthritis; osteoarthritis, knee; immune system; interleukin-1; interleukin-6; tumor necrosis factor-alpha
2016-02-24
国家自然科学基金(81371990)
南方医科大学 第三附属医院,广东省骨科研究院,广州510630
林旭晨(1989-),男,南方医科大学2013级硕士研究生
蔡道章.Email:daozhang@medmail.com.cn
R-332;R392.12;R684.3;R977.6
A
1672-4194(2016)03-0143-05

