柱前衍生化HPLC法分析人工栽培金线莲中多糖的单糖组成
林守二, 黄丽英, 俞晓玲
柱前衍生化HPLC法分析人工栽培金线莲中多糖的单糖组成
林守二1,2, 黄丽英1, 俞晓玲1
目的建立一种金线莲多糖(ARPS)中单糖组成的柱前衍生化高效液相(HPLC)测定方法。方法以三氟乙酸(TFA)水解ARPS,通过1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生,梯度洗脱HPLC测定,并分别对衍生化过程的pH、PMP 的用量和水解过程的TFA浓度作了优化。结果人工栽培ARPS由甘露糖、核糖、葡萄糖、半乳糖和阿拉伯糖组成,且各单糖的物质的量的比为:甘露糖∶核糖∶葡萄糖∶半乳糖∶阿拉伯糖=1.00∶8.47∶47.30∶1.17∶1.19。结论该方法简便可行,重复性良好,适用于分析ARPS中单糖组成。
兰科; 多糖类; 色谱法; 色谱法, 高效压液相; 单糖类
(2016)03-0148-07
金线莲具有抗肿瘤、保肝和降压等多种药理活性,但野生资源稀少[1-2],目前已经实现人工栽培和工厂化生产组培苗[3]。本课题组发现,野生的金线莲中富含金线莲多糖,主要由葡萄糖、甘露糖、鼠李糖、半乳糖和岩藻糖组成[4]。目前文献对人工栽培和野生金线莲这二种不同来源药材的重要活性成分之一金线莲多糖(anoectochilus roxburghii polysaccharide, ARPS)组成的异同点鲜有报道。本研究采用三氟乙酸(trifluoroacetic acid, TFA)水解ARPS,以1-苯基-3-甲基-5吡唑啉酮(1-pheny-3-methyl-5-pyrazolone, PMP)作为柱前衍生化试剂,梯度洗脱高效液相色谱法(high performance liquid chromatography, HPLC)测定人工栽培的金线莲中ARPS的单糖组成,并计算其物质的量。同时,对衍生化过程的pH、PMP的用量和水解过程的TFA浓度分别优化,为ARPS的单糖组成分析提供参考,也为金线莲的进一步开发利用提供理论依据。
1 材料与方法
1.1材料
1.1.1主要试剂D-甘露糖(批号:33708)、D-半乳糖(批号:lot#H1224032)、鼠李糖(批号:32800)、葡萄糖(批号:lot#A1403066)、L-岩藻糖(批号:30268)、DL-阿拉伯糖(批号:lot#G1223072)、D-核糖(批号:35727)、D-(+)-半乳糖醛酸(批号:lot#B1413009)(以上对照品均购自阿拉丁试剂公司,纯度均≥98%);PMP(批号:20131127,分析纯,国药集团化学试剂有限公司);TFA(化学纯,国药集团化学试剂有限公司);氯仿(化学纯,南京利盛化学试剂有限公司);乙腈(色谱纯,西陇化工股份有限公司);乙酸铵(色谱级,西亚试剂公司)。
1.1.2主要仪器自动三重纯水蒸馏器(SZ-97,上海亚荣生化仪器厂);电子天平(BS124S,Max120 g, d=0.1 mg,北京赛多利斯仪器系统有限公司);数控超声波清洗器(KQ-250DE型,昆山市超声仪器有限公司); 高效液相色谱仪(LC-20A,日本岛津有限公司);离心机(H 1650-W,湖南湘仪实验室仪器开发有限公司)。
1.1.3精制ARPS来源金线莲为福建南靖人工栽培药材,经福建医科大学药学院张永红教授鉴定。精制ARPS为实验室应用水提醇沉后高速逆流色谱法分离纯化(另报道),苯酚-硫酸法测得其纯度为92.46%。
1.2方法
1.2.1衍生化过程pH的考察精密称取甘露糖9.0 mg,核糖7.5 mg,鼠李糖18.2 mg,葡萄糖9.0 mg,半乳糖9.0 mg,阿拉伯糖7.5 mg,岩藻糖8.2 mg,半乳糖醛酸10.6 mg,用水定容至10 mL,得鼠李糖浓度为10 mmol/L(因响应值较小),其余单糖浓度为5 mmol/L,作为混合对照品溶液。
取5份100 μL混合对照品溶液,加入100 μL 0.5 mol/L PMP甲醇溶液(0.435 5 g PMP 溶于50 mL的甲醇),再分别加入0.1 mol/L的NaOH 60,40,30,25,20 μL,涡旋混匀,70 ℃水浴反应30 min,取出冰浴冷却后分别加入等物质的量的盐酸溶液中和,80 ℃干燥。用600 μL水复溶,并加入1 mL氯仿萃取4次,最后用0.22 μm的微孔滤膜过滤后待进样分析。
1.2.2衍生化过程PMP用量的考察取5份100 μL混合对照品溶液,分别加入不同量0.5 mol/L的PMP甲醇溶液,使PMP的物质的量分别为各单糖物质的量总和的2,5,10,20,30倍,再加入0.1 mol/L的NaOH 30 μL,其余条件及方法同1.2.1,衍生化后待进样分析。
1.2.3混合对照品溶液的衍生化取混合对照品溶液100 μL于1.5 mL的EP管中,加入0.5 mol/L的PMP甲醇溶液100 μL(为单糖总物质的量的10倍)和0.1 mol/L NaOH溶液30 μL,其余条件及方法同1.2.1,衍生化后待进样分析。
1.2.4ARPS的水解及TFA浓度的考察取精制ARPS 3 mg,加入1.5 mL浓度分别为0.002,0.01,0.02,0.1,0.2,2 mmol/L的TFA溶液,充氮气封管,于100 ℃水浴水解12 h,冰浴冷却后8 000 r/min离心10 min,取上清液,用NaOH中和至中性,作为样品溶液。取样品溶液100 μL于1.5 mL的EP管中,加入0.5 mol/L的PMP甲醇溶液100 μL和0.1 mol/L的NaOH 溶液30 μL,其余条件及方法同1.2.1,衍生化后待进样分析。
1.2.5色谱条件的选择色谱柱:C18柱(4.6×250 mm,5 μm,Waters);柱温:30 ℃;流速:0.8 mL/min;检测波长:254 nm;流动相:B:乙腈,A:20 mmol/L 乙酸铵水溶液;梯度模式:时间梯度0~2~8~25 min,相应浓度梯度:溶剂B 15%~20%~28%~33%,进样体积为20 μL。
1.2.6方法学考察(1)线性关系的考察:精密称取甘露糖4.0 mg,核糖7.4 mg,葡萄糖126.3 mg,半乳糖7.5 mg,阿拉伯糖 4.1 mg,用水定容至10 mL,为混合对照品母液。配制不同浓度的混合对照品溶液衍生化后按1.2.5条件进样分析。(2)精密度试验:取1.2.1中同一混合对照品溶液衍生化后,按1.2.5条件进样分析,连续进样6次,根据峰面积计算相对标准偏差(relative standard deviation,RSD)值。(3)稳定性试验:取同一份样品溶液衍生化后按1.2.5条件,分别于0,2,4,6,8,10,12 h后进样,观察峰面积变化情况。(4)重复性试验:取样品溶液6份衍生化后,按1.2.5条件进样分析,记录峰面积并换算成含量计算RSD值。(5)加样回收试验:取已知含量的ARPS样品9份,按低、中、高分成3组,每组分别加入含量为80%,100%,120%的相应对照品,按1.2.4水解并衍生化后按1.2.5条件进样分析,计算回收率和RSD。
2 结 果
用于糖类衍生化的试剂有2-氨基苯甲酸、糖腈乙酸酯、PMP等。其中,PMP与糖类物质衍生时反应条件温和,产物无立体异构,两分子PMP与一分子单糖缩合,生成的衍生物与各单糖的定量关系明确,线性关系良好,其反应原理如图1所示:
本实验采用PMP衍生化HPLC法分析人工栽培金线莲中多糖的单糖组成,并对衍生化条件进行优化,比较各种单糖对照品峰面积的大小,优化后的衍生化条件及单糖含量测定结果如下:
2.1衍生化过程pH的优化结果当加入0.1 mol/L NaOH 25 μL时,半乳糖醛酸峰面积的响应值最大;岩藻糖在加入量为30 μL时峰面积响应最大;鼠李糖、半乳糖和葡萄糖均随NaOH加入量的增加峰面积响应增大,但在加入量为30~60 μL时增大较缓慢;而阿拉伯糖、核糖和甘露糖在加入量为20~30 μL中响应值呈上升趋势,当加入量>30 μL后趋于平稳状态。故加入0.1 mol/L的 NaOH 30 μL 较为合适,此时测得溶液中的pH值为8~9(图2)。
当PMP与单糖总和的物质的量的比为5倍以下时,各种糖的峰面积响应值都随着PMP加入量的增大而增大;当PMP加入量为5~20倍时,各种糖的峰面积基本都维持在最大值的水平;当PMP加入量超过20倍时,各种糖峰面积响应值略下降,综上分析,PMP加入量为单糖总物质的量的5~20倍时较为合适,故本实验选择PMP加入量为单糖总物质的量的10倍(图3)。
2.2TFA浓度的优化结果不同单糖对TFA 的敏感程度不同,随着TFA浓度的增大,ARPS水解后各种单糖的峰面积都呈现先增大后减小的趋势,其中葡萄糖和甘露糖在TFA浓度为0.1 mol/L时峰面积响应最大,而核糖、阿拉伯糖和半乳糖则在TFA浓度为0.02 mol/L时峰面积有最大响应(图4)。由于核糖在这2个TFA浓度上差异变化较为剧烈,其他糖的变化则相对平缓,故选用浓度为0.02 mol/L的TFA作为水解酸。色谱分析发现,ARPS中不含鼠李糖、半乳糖醛酸和岩藻糖3种单糖,故不讨论TFA的浓度对其影响。
此外,实验中发现衍生化过程中在70 ℃水浴反应30 min后,选用冰浴冷却,可以减少杂质峰,酸中和步骤中以加入等当量的酸为宜,且在酸中和后的干燥过程可明显减少杂峰。
综上所述,最优化的水解和衍生化条件是:0.02 mol/L的TFA作为水解酸,衍生化过程加入0.1 mol/L的NaOH 30 μL,PMP加入量为单糖总物质的量的10倍。
2.3PMP(不含单糖)、混合对照品和样品衍生化反应后的色谱图色谱过程应用等度洗脱对流动相的组成进行优化。当乙腈浓度<22%时峰较宽,且保留时间较长;而当乙腈浓度>30%时,峰与峰之间不能达到完全分离,故洗脱方式采用梯度洗脱,优化结果其梯度为0~2~8~25 min,乙腈浓度为15%~20%~28%~33%。在保证乙腈梯度浓度的情况下,考察流动相中醋酸铵的pH为5.0~7.5时混合对照品的出峰情况,发现随着pH的增大,洗脱顺序不变,出峰时间缩短,但分离度略变差。为了分析简便,且在基本满足分离度的要求下,最终选择水相含20 mmol/L pH为7.0的醋酸铵溶液。
选择考察后的最优条件,PMP(不含单糖)、混合对照品溶液及样品溶液衍生化后按1.2.5色谱条件进样分析。依据保留时间,判断ARPS由甘露糖、核糖、葡萄糖、半乳糖和阿拉伯糖组成(图5~7)。
2.4线性关系的考察按1.2.5条件进样分析,以单糖摩尔浓度为横坐标(x,mmol/L),峰面积为纵坐标(y),对甘露糖、核糖、葡萄糖、半乳糖和阿拉伯糖5种单糖进行线性回归,结果见表1。
2.5精密度试验取1.2.1中同一混合对照品溶液衍生化后,连续进样6次,记录甘露糖、核糖、葡萄糖、半乳糖及阿拉伯糖的峰面积并计算RSD值,结果表明RSD值分别为1.31%,0.83%,1.35%,2.11%和1.84%,表明方法精密度良好。
2.6重复性试验取同一批样品溶液6份衍生化后进样分析,记录甘露糖、核糖、葡萄糖、半乳糖及阿拉伯糖的峰面积,换算成含量并计算RSD值,结果表明RSD值分别为2.59%,3.21%,2.65%,1.35%和1.59%,表明重复性良好。
2.7稳定性试验同一份样品溶液衍生化后于0,2,4,6,8,10,12 h后进样,观察甘露糖、核糖、葡萄糖、半乳糖及阿拉伯糖的峰面积变化情况,根据4 h内的峰面积计算得RSD值分别为1.78%,2.12%,3.27%,1.26%和1.32%,表明样品在萃取后4 h内测完基本稳定,在6 h后测响应值有所下降,随着时间推移,下降越明显。

表1 6种单糖的回归方程及相关系数
2.8加样回收试验取已知含量的ARPS样品9份,按低、中、高分成3组,每组分别加入含量为80%,100%和120%的相应对照品,水解并衍生化后进样分析,计算回收率和RSD,结果如表2所示,平均回收率为98.72%~102.28%,RSD为1.05%~3.71%,表明方法准确度良好。
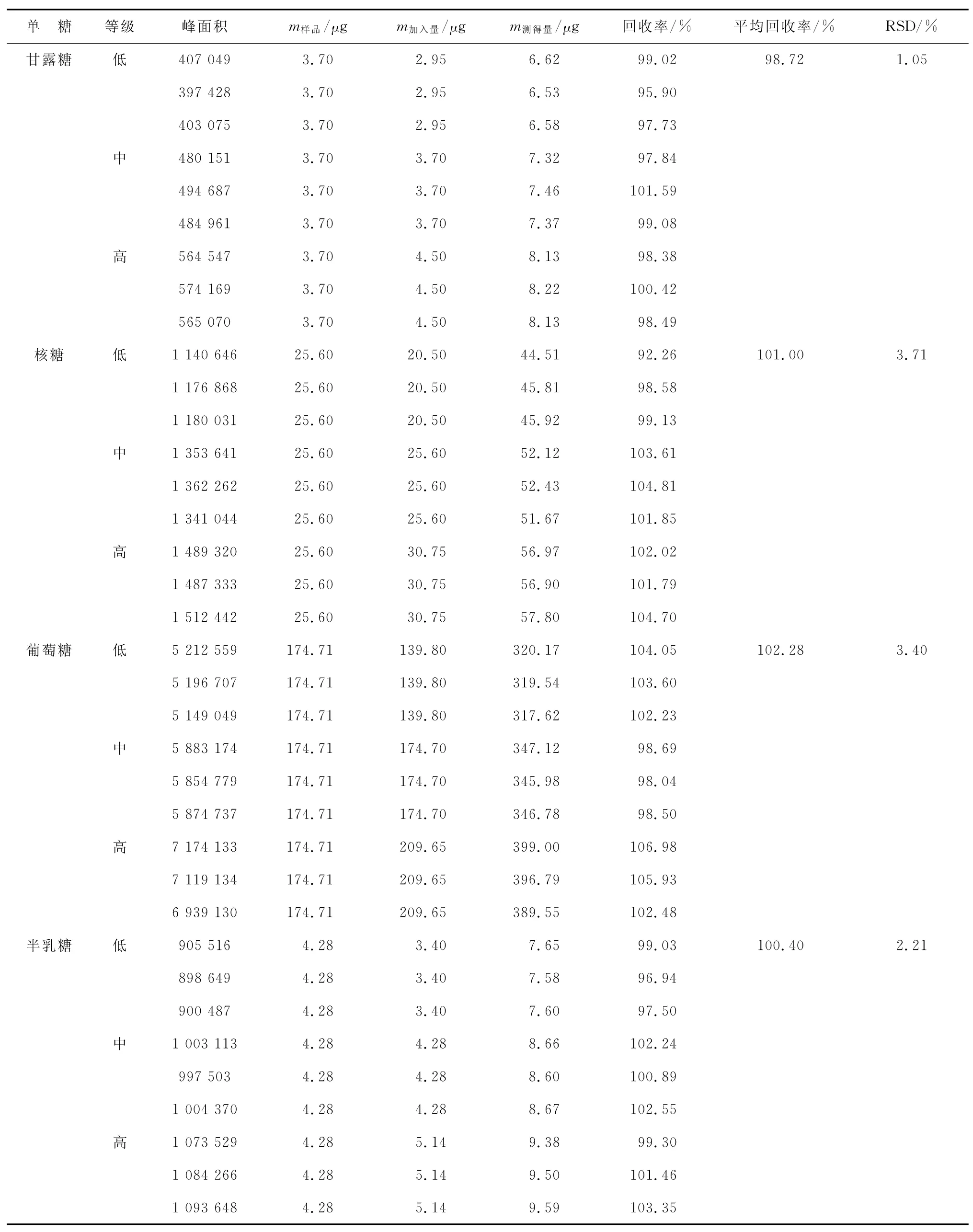
表2 回收率实验结果
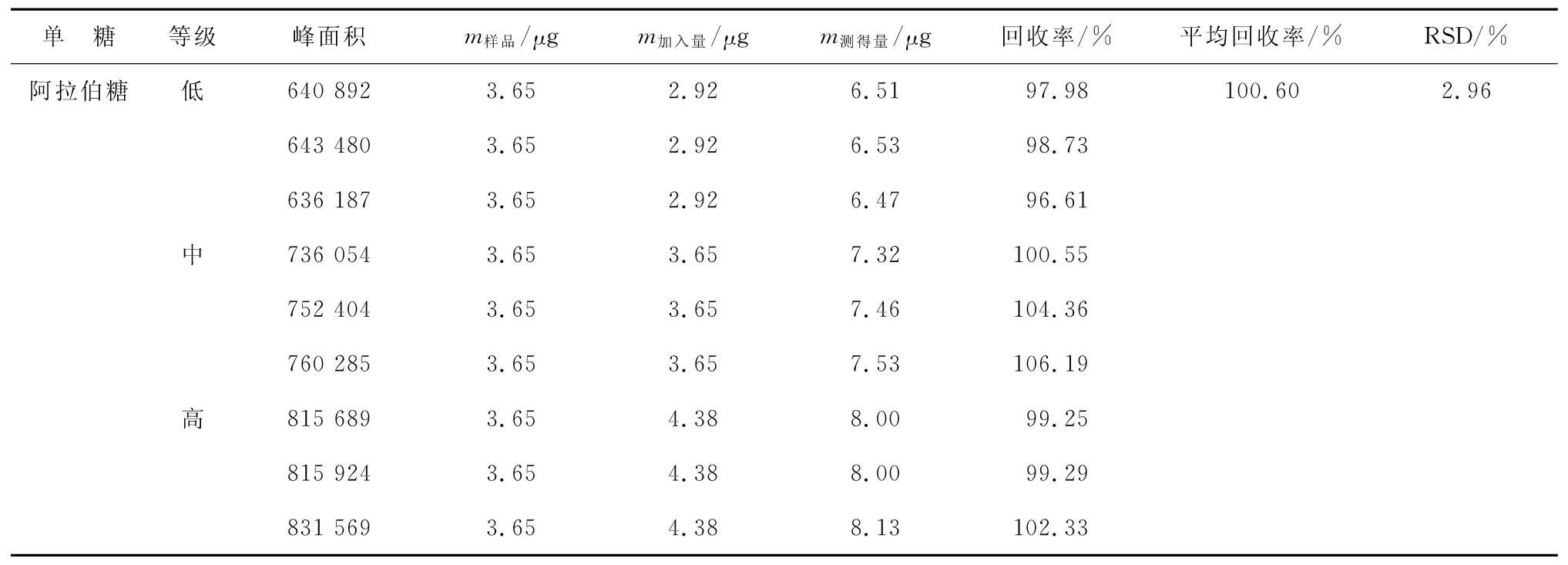
表2 (续)
RSD:相对标准偏差.
2.9各单糖的物质的量的比测定结果ARPS经优化后的条件水解并衍生化后,按1.2.5色谱条件进样分析,根据峰面积对应线性关系换算成物质的量,进而求出组成ARPS的各单糖物质的量的比,结果如表3所示。
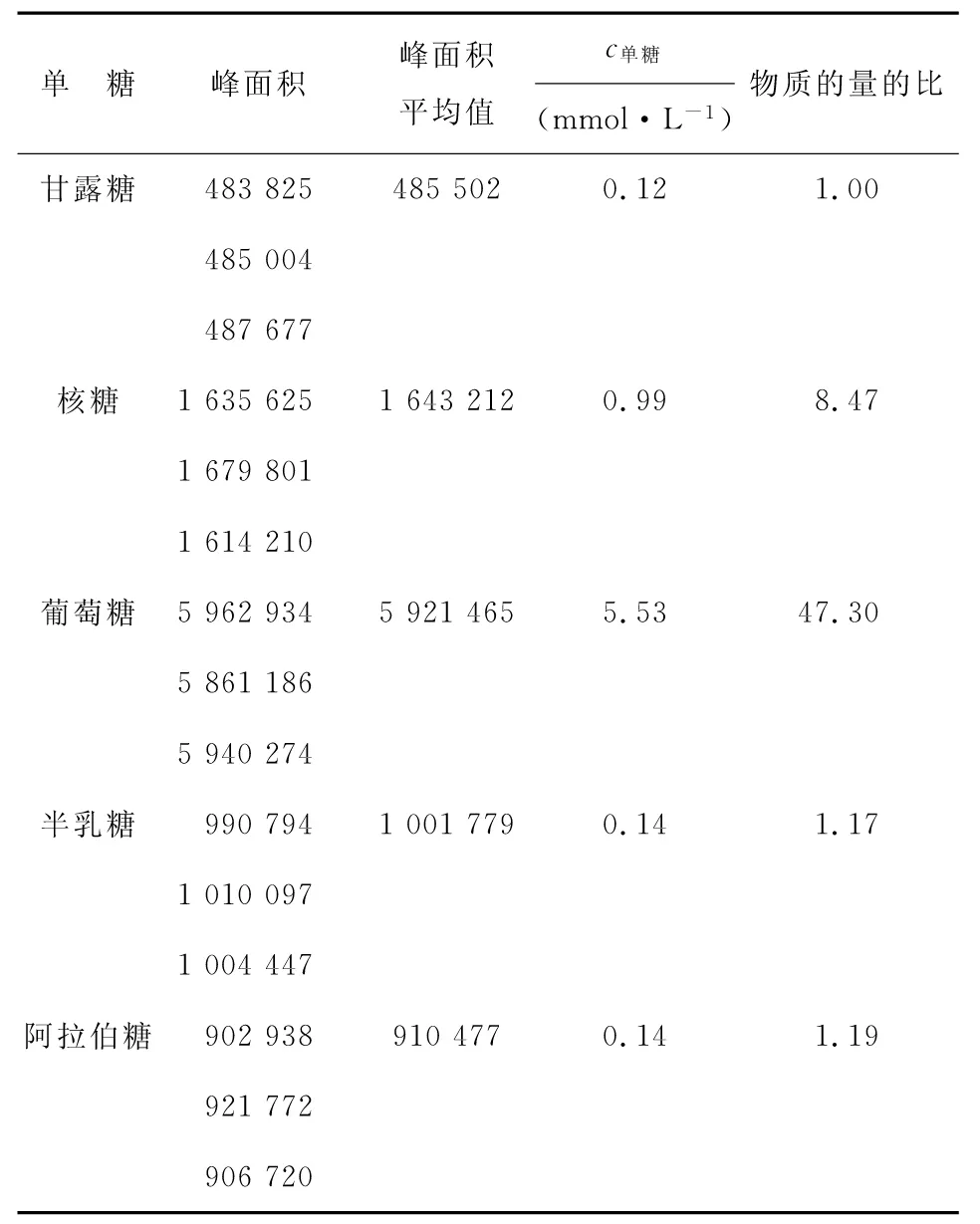
表3 各单糖物质的量的比测定结果
根据表3样品中各单糖的峰面积之比可得ARPS中各单糖的物质的量的比为:甘露糖∶核糖∶葡萄糖∶半乳糖∶阿拉伯糖=1.00∶8.47∶47.30∶1.17∶1.19,物质的量的比之间差异较大,表明ARPS主要由葡萄糖组成,葡萄糖可能是构成糖主链的主要单糖[5]。文献研究的野生金线莲中多糖的单糖组成为甘露糖∶鼠李糖∶半乳糖∶阿拉伯糖∶岩藻糖=1.3∶1.0∶1.2∶1.1∶1.7[6],研究结果与之差异较大,表明人工栽培的金线莲与野生金线莲的单糖组成种类和物质的量的比都不同。
3 讨 论
单糖组成的研究是多糖结构表征的重要内容。多糖是由单糖连接而成的,要测定其单糖组成,首先要对多糖进行水解。不同糖的水解条件不同,目前多采用酸水解法,主要用到的酸有盐酸、硫酸和TFA,其中TFA反应条件温和且易于除去,被广泛使用[7-8]。本研究考察了不同浓度的TFA对ARPS的水解情况后,最终选择了0.02 mol/L的TFA。但不同多糖的构成方式不同,可能水解过程最适TFA浓度也会有所差别。
由于多糖的紫外吸收为末端吸收,需要通过衍生化反应,使其带上紫外吸收的基团,使得普通的紫外吸收检测器就能实现对其进行分析。单糖组成分析方法主要是气相色谱法和液相色谱法[9]。文献[10-11]在研究单糖组成分析时,同时采用PMP柱前衍生化法(HPLC法)和糖腈乙酸酯衍生化法(GC法)分析,结果表明2种方法检测结果基本一致,但HPLC没有挥发性限制问题,且文献表明HPLC能检测到多糖组成中的多糖和糖醛酸信息[12],结果更为全面。本实验以PMP作为柱前衍生化试剂。由PMP空白试验可知,残余的PMP峰出现在12.7 min,均在各个单糖出峰之前,不影响测定结果。同时分别对衍生化过程的pH和PMP 的用量作了考察,但是不同单糖对pH及PMP用量的敏感度不同,因此同时测定时应综合考虑后选择较为合适的条件。
实验测得人工栽培ARPS各单糖的物质的量的比为:甘露糖∶核糖∶葡萄糖∶半乳糖∶阿拉伯糖=1.00∶8.47∶47.30∶1.17∶1.19,葡萄糖含量尤为高,其可能与栽培过程所添加的原料有关,与野生ARPS单糖组成差异也较大,但对于药材的综合质量评价还有待于进一步研究。
[1]邵清松,周爱存,黄瑜秋.不同移栽条件对金线莲组培苗成活率及生长的影响[J].中国中药杂志,2014,39(6):955-958.
[2]黄以平.金线莲研究进展[J].海峡药学,2013,25(9):19-21.
[3]蔡文燕,肖华山,范秀珍.金线莲研究进展[J].亚热带植物科,2003,32(3):68-72.
[4]张锦雀.金线莲多糖分离纯化、结构表征及其抗肿瘤作用研究[D].福州:福建医科大学药物分析系,2009.
[5]唐雨薇,张宇,王宇亮,等.黄芪多糖分离与结构特征分析[J].时珍国医国药,2014,25(5):1097-1100.
[6]陈晓兰.金线莲多糖的分离纯化及其对酒精诱导致小鼠肝损伤的保护作用研究[D].福州:福建医科大学药物分析系,2013.
[7]刘刚,王辉,周本宏,等.高效液相色谱法分析松茸多糖的单糖组成[J].中国医院药学杂志,2012,32(10):758-761.
[8]林葵,苏青,黄岛平,等.高效液相色谱法测定土垅大白蚁菌圃多糖的单糖组成[J].药物分析杂志,2013,33(6):989-993.
[9]张丽芝,沈荣.单糖组成分析方法的研究进展[J].微生物学免疫学进展,2014,41(1):77-81.
[10]范嘉龙,马丽萍,叶红,等.苦丁冬青苦丁茶多糖的单糖组成分析[J].食品科学,2013,34(11):72-76.
[11]齐晓辉.浒苔多糖的结构及寡糖研究[D].济南:中国海洋大学药物化学系,2012.
[12]韩威,姜瑞芝,陈英红,等.银耳多糖单糖组成分析的三种色谱方法比较[J].天然产物研究与研发,2012,24(3):359-361.
(编辑:张慧茹)
Analyze Monosaccharide Composition of Polysaccharide in Artificial Cultivated Anoectochilus Roxburghii by Pre-column Derivatization HPLC
LIN Shou’er1,2, HUANG Liying1, YU Xiaoling1
1. College of Pharmacy, Fujian Medical University, Fuzhou 350004, China;2. Fujian Center for Disease Control and Prevention, Fuzhou 350001, China
ObjectiveTo establish a method for the determination of monosaccharide composition inAnoectochilusRoxburghiipolysaccharide (ARPS) by pre-column derivatization High Performance Liquid Chromatography(HPLC).MethodsARPS was hydrolyzed by trifluoroacetic acid(TFA) solution and the monosaccharide derivatives obtained with 1-phenyl-3-methyl-5-pyrazolone(PMP) were separated by HPLC using gradient elution process.The pH, dosage of PMP in the process of derivatization and concerntration of TFA in the process of hydrolyzation was optimized respectively.ResultsARPS was composed of mannose, ribose, glucose, galactose and arabinose, and their molar ratio was 1.00∶8.47∶47.30∶1.17∶1.19.ConclusionThe method is simple, workable and had good reproducibility.It could be used to determine the monosaccharide composition of ARPS.
orchidaceae; polysaccharides; chromatography; chromatography, high pressure liquid; monosaccharides
2015-12-15
国家海洋局海洋生物遗传资源重点实验室开放研究基金(HY201404);国家卫生和计划生育委员会科研基金(wkj-FJ-33);国家级大学生创新创业训练计划项目(201410392016)
1.福建医科大学 药学院,福州350004;2.福建省疾病预防控制中心,福州350001
林守二(1989-),女,医学硕士
黄丽英. Email:fjmuhly88@sina.com
R282.71; R343.2; R343.9; R927.2; R977.7
A
1672-4194

