TNF-a-1 031,-238,-308基因多态性与卵巢早衰的关系
王雪金,罗湘闽
TNF-a-1 031,-238,-308基因多态性与卵巢早衰的关系
王雪金,罗湘闽
目的探讨肿瘤坏死因子(TNF)-a基因中-238,-1 031,-308位点多态性与卵巢早衰的关系。方法选择200例卵巢早衰妇女和200例对照者作为研究对象,抽取外周血白细胞中的DNA,应用聚合酶链式反应-限制性片段长度多态性技术分析TNF-a基因中-238G/A、-1 031T/C、-308G/A位点多态性,采用卡方检验对不同基因型之间的差异进行比较。结果卵巢早衰组和对照组中TNF-a-238位点和TNF-a-1 031位点的等位基因频率和基因型频率差别无统计学意义(P>0.05)。卵巢早衰组中TNF-a-308位点的G/G基因型频率高于对照组(90%vs82.5%,P<0.05),且2组间等位基因频率差别有统计学意义(P<0.05)。结论TNF-a基因中-308位点的单核苷酸多态性可能与卵巢早衰的发生存在相关性。
肿瘤坏死因子类; 肿瘤坏死因子α; 多态现象,遗传; 基因; 卵巢
在近代历史中,普通女性自然绝经的平均年龄一直保持在50~52岁,而40岁前的绝经,人们将其定义为卵巢早衰或卵巢功能不全[1]。卵巢早衰是不孕症的原因之一,表现为卵巢功能减退、卵巢对卵泡刺激素(follicle stimulating hormone,FSH)低反应性和雌二醇(estradiol,E2)水平降低,临床表现为初潮正常或延迟、第二性征发育正常的女性40岁前出现4~6月的闭经,且≥2次(间隔至少4周)血清FSH水平升高(>40 IU/L)、雌激素水平降低[2]。因卵巢早衰伴随生育能力的提早丧失,具有卵巢早衰风险的患者,如>30岁再怀孕,可能在受孕及维持妊娠到足月方面会遇到某些困难[3]。目前卵巢早衰的发生和发展没有任何可早期辨别的症状或体征,通常在疾病的终末期才可确诊,因此大部分患者在诊断卵巢早衰之前尚未怀孕[4],故研究卵巢早衰的病因具有重要意义。卵巢早衰的病因涉及遗传、环境、精神、感染、代谢、自身免疫以及一些医源性因素等[5-6],但大多数患者的病因仍不清楚,属特发性卵巢早衰。国内外研究发现,卵巢早衰患者血清中的肿瘤坏死因子α(tumor necrosis factor,TNF-α)水平低于正常对照组,推测TNF-a基因可能为易感基因[7-8]。本研究旨在探讨TNF-a基因中-1 031,-238,-308位点多态性与卵巢早衰的关系。
1 对象和方法
1.1对象收集2013年1月-2015年6月就诊于笔者科室的特发性卵巢早衰妇女200例为病例组,年龄(29.31±4.51)岁(18~39岁),均为中国汉族。入选标准:40岁之前出现继发性闭经4~6月以上,≥2次血清FSH>40 IU/L,E2<15 pg/mL(2次间隔1月以上)。排除其他原因导致的卵巢功能低下,如染色体核型异常,全身免疫系统疾病、盆腔手术史、放化疗史等明显卵巢损害的因素。
另外收集同期就诊的、因输卵管因素导致不孕的患者200例作为对照组,年龄(28.56±4.12)岁(18~39岁),月经周期正常,女性基础激素检查均在正常范围,无卵巢因素异常及全身免疫性疾病。2组间年龄差别无统计学意义。所选患者均无血缘关系,所有研究对象均签署知情同意书,该研究得到医院伦理委员会批准。
1.2方法
1.2.1主要试剂和仪器血液基因组DNA提取试剂盒(德国QIAGEN公司),PCR体系试剂(大连宝生物工程有限公司),引物(上海生工公司合成)。超净工作台(苏州苏净集团),稳流稳压电泳仪(北京三恒多用公司),PCR扩增仪(2400或9600型,美国PE公司),凝胶图像分析仪(Del Doc1000型,美国PE公司)。
1.2.2血基因组DNA的提取所有研究对象均在清晨空腹抽取静脉血约3 mL,置于抗凝真空管中,置-70 ℃冰箱保存。采用血基因组DNA提取试剂盒提取外周血白细胞中的DNA,将离心所得DNA样本放置于-20 ℃冰箱中保存,备用。
1.2.3PCR扩增引物序列由上海生工公司合成。
TNF-a-1 031T/C:扩增长度为270 bp[9]。PCR扩增反应条件:预变性95 ℃,5 min;变性95 ℃,30 s→退火55 ℃,30 s→延伸72 ℃,30 s,共35个循环;72 ℃再延伸5 min。
上游:5′-GGGGAGAACAAAAGGATAAG-3′
下游:5′-CCCCATACTCGACTTTCATA-3′
TNF-a 238G/A:扩增长度为152 bp[10]。PCR反应条件:预变性94 ℃,4 min;变性94 ℃,30 s→退火60 ℃,30 s→延伸72 ℃,30 s,共35个循环;72 ℃再延伸2 min。
上游:5′-AGAAGACCCCCCTCGGAACC-3′
下游:5′-ATCTGGAGGAAGCGGTAGTG-3′
TNF-a-308G/A:扩增长度为107 bp[9]。PCR扩增反应条件:预变性94 ℃,5 min;变性95 ℃,1 min→退火56 ℃,30 s→延伸72 ℃,30 s,共35个循环;72 ℃再延伸10 min。
上游:5′-AGGCAATAGGTTTTGAGGGCCAT-3′
下游:5′-TCCTCCCTGCTCCGATTCCG-3′
1.2.4聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)分析TNF-a-1 031T/C的PCR产物用限制性内切酶BbsⅠ酶切,置37 ℃恒温水浴箱过夜;TNF-a-238G/A的PCR产物用限制性内切酶MspⅠ酶切,置37 ℃恒温水浴箱1 h;TNF-a-308G/A的PCR产物用限制性内切酶NcoⅠ酶切,置37 ℃恒温水浴箱16 h。所有酶切产物用3%琼脂糖凝胶进行电泳分析。
1.3统计学处理采用SPSS 16.0统计软件进行分析。采用卡方检验分析基因型的分布是否符合Hardy-Weinberg平衡。各种基因型和等位基因频率用直接计数法计算,计数资料用卡方检验,对不同基因型之间的差异进行分析,并计算比值比(OR)和95%的可信区间(95%CI)。P<0.05为差别具有统计学意义。
2 结 果
2.1基因型分析
2.1.1TNF-a-1 031T/C的限制性酶切分析TNF-a-1 031T/C的PCR产物用限制性内切酶BbsⅠ酶切,发现3种不同的基因型,分别为TT、TC和CC。TT型为野生型纯合子,不能被酶切,电泳可见270 bp片段;CC型为突变型纯合子,可被酶切,电泳可见159,111 bp片段;TC型为杂合子,可被酶切,电泳可见270,159,111 bp片段(图1)。
2.1.2TNF-a-238G/A的限制性酶切分析TNF-a-238G/A的PCR产物用限制性内切酶MspⅠ酶切,发现3种不同的基因型,分别为GG、GA、AA。GG基因型的扩增产物可被酶切,电泳可见133 bp片段,另外1条片段19 bp,因电泳时超出凝胶范围而不可见;GA基因型为杂合子,可见152,133 bp片段(19 bp不显影);AA基因型为纯合子,扩增产物未被切开,可见152 bp片段(图2)。
2.1.3TNF-a-308G/A的限制性酶切分析
TNF-a-308G/A的PCR产物经限制性内切酶NcoⅠ酶切,发现3种不同的基因型,分别为GG、AA和GA。GG型为野生型纯合子,被切为87和20 bp;AA型为突变型纯合子,不能被切开(107 bp);GA型为杂合子,被切为107,87和20 bp,其中20 bp处的条带因电泳时超出凝胶范围而不可见(图3)。
2.2TNF-a基因型和等位基因分布情况将对照组中2个位点基因型进行遗传平衡检验,根据实验所得样本的实际基因型分布推导群体的理论基因型分布,经Hardy-Weinberg遗传平衡检验得出,TNF-a-1 031T/C、TNF-a-238G/A、TNF-a-308G/A位点所对应的P值均>0.05,符合Hardy-Weinberg遗传平衡定律,结果见表1。表明研究对象具有一定的人群代表性,无遗传学偏差。
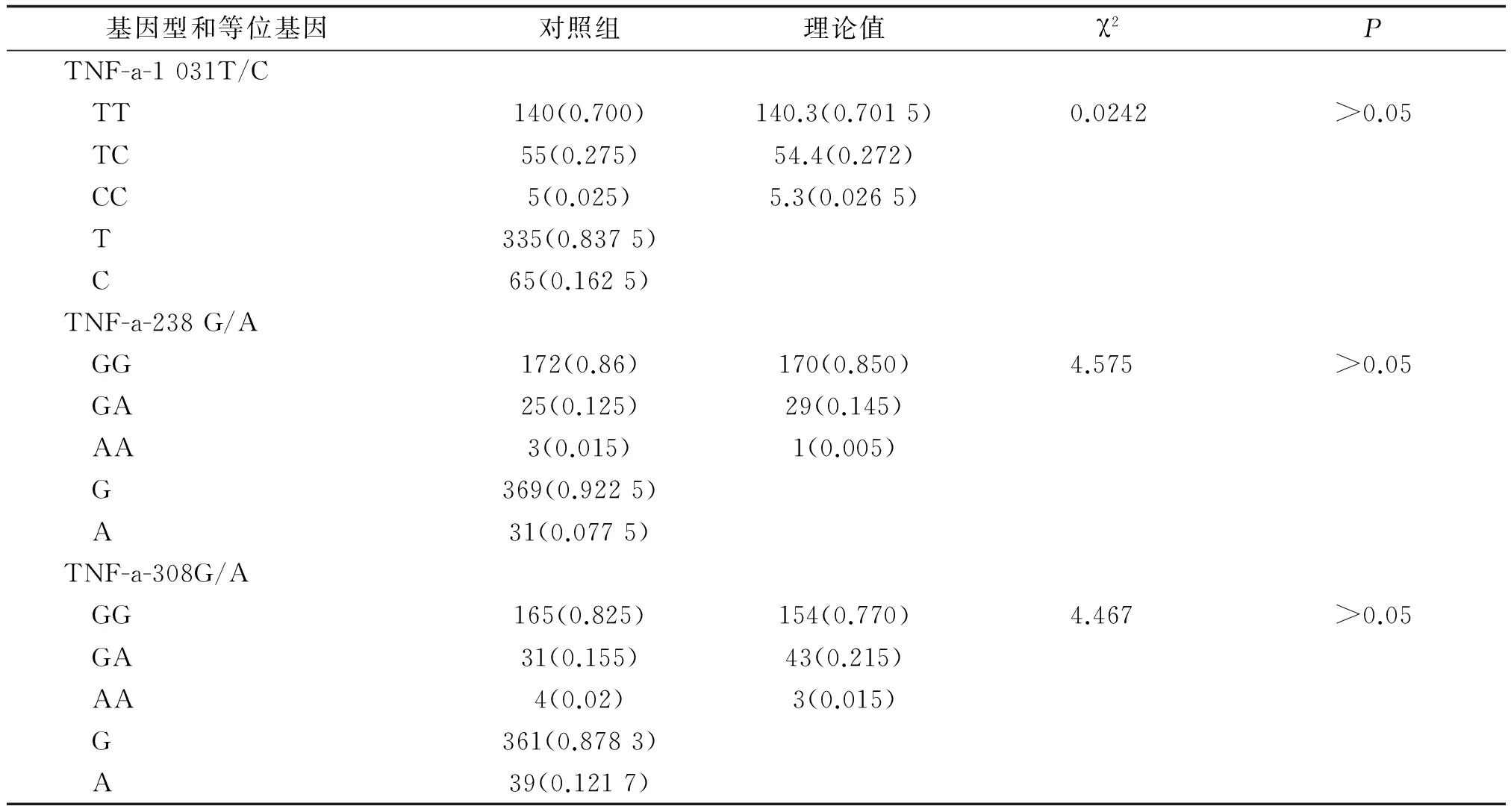
表1 对照人群TNF基因3个位点遗传平衡检验
表中数据为n(%).TNF:肿瘤坏死因子.
TNF-a-1 031T/C、TNF-a-238G/A、TNF-a-308G/A基因在卵巢早衰组和对照组中各基因型及等位基因的频率分布如表2,TNF-a-1 031T/C基因中,卵巢早衰组TT基因型的频率低于对照组(68%vs70%,P>0.05),TC基因型和CC基因型的频率均高于对照组,分别为(28%vs27.5%,P>0.05)和(4%vs2.5%,P>0.05)。其中T等位基因在卵巢早衰组和对照组的频率中分别为82%,83.75%,而C等位基因在卵巢早衰组和对照组的频率中分别为18%,16.25%,二者差别均无统计学意义(P>0.05)。
TNF-a-238G/A基因在卵巢早衰组中GG基因型的频率低于对照组(83%vs86%,P>0.05),GA基因型和AA基因型的频率均高于对照组,分别为(14.5%vs12.5%,P>0.05)和(2.5%vs1.5%,P>0.05)。其中G等位基因在卵巢早衰组和对照组的频率中分别为90.25%,92.25%,而A等位基因在卵巢早衰组和对照组的频率中分别为9.75%,7.75%,二者差别均无统计学意义(P>0.05)。
TNF-a-308G/A在卵巢早衰组中GG基因型的频率高于对照组(90%vs82.5%),且差别具有统计学意义(P=0.029,OR=1.91,95%CI=1.06~3.44),GA基因型和AA基因型的频率均低于对照组,分别为(9.5%vs15.5%,P>0.05)和(0.5 %vs2%,P>0.05)。其中G等位基因在卵巢早衰组和对照组的频率中分别为94.75%,87.83%,而A等位基因在卵巢早衰组和对照组的频率中分别为5.25%,12.17%,且二者差别具有统计学意义(P<0.05)。
3 讨 论
卵巢早衰患者可出现潮热、出汗、性欲减退等更年期症状,可导致不孕,这些症状将严重影响患者的生育能力、生活质量和家庭稳定[11]。国内外学者对卵巢早衰的病理生理进行了大量的研究[12],但其遗传性机制仍不清楚[13-14]。近年来研究发现,抗苗勒管激素(anti-Mullerian hormone,AMH)对于评估血清FSH轻度升高的仍有正常月经来潮的妇女卵巢功能有重要意义,被认为可联合FSH诊断卵巢早衰[15-16]。所以当AMH出现异常的时候,大部分患者已经出现生育力的下降。本研究旨在发现卵巢早衰的易感基因,从而可以更早地发现卵巢早衰遗传易感的患者,必要时可为患者提供前期的生育咨询和健康指导。

表2 卵巢早衰组与对照组中TNF基因型及等位基因的频率分布
n=200.表中病例组和对照组数据为n(%).TNF:肿瘤坏死因子.a:理论值<5,采用确切概率法.
TNF-a主要由内毒素激活的巨噬细胞产生,可杀伤肿瘤细胞,引起肿瘤坏死,而对正常组织细胞无毒性作用[17],编码TNF-a基因均位于高度多态的主要组织相容性复合物MHC3类抗原基因簇,定位于6p21.4。在启动子区域有多个多态性基因位点,如-1 031(T/C)、-863(C/A)、-851(C/T)、-419(G/C)、-376(G/A)、-308(G/A)、-238(G/A)、-162(G/A)及-49(G/A)等。
研究发现,TNF-a基因启动子区的SNP可以从转录水平上影响TNF的产生,从而引起不同个体之间TNF-a水平出现明显差异,并参与多种疾病的发生和发展[18]。国内外有研究发现,变应性鼻炎等疾病与TNF-a-238位点多态性有相关性[19],Gonzalez等发现,TNF-a-308位点基因多态性与Crohn’s病患者TNF-a水平升高及患病易感性有关[20]。Naz及王一峰等均在临床研究中发现,卵巢早衰组中血清TNF-a值低于对照组,且差别有统计学意义[7-8]。多项研究发现,TNF-a-1 031(T/C),-308(G/A),-238(G/A)位点多态性与TNF-a水平变化有关[20-22]。但未见TNF-a基因多态性与卵巢早衰的关系的相关报道。本研究旨在探讨TNF-a基因中-1 031,-238,-308位点多态性与卵巢早衰的关系。
本研究结果显示,卵巢早衰组和对照组中TNF-a-238位点和TNF-a-1 031位点的等位基因频率和基因型频率差别无统计学意义(P<0.05)。卵巢早衰组中TNF-a-308位点的GG基因型频率高于对照组(90%vs82.5%,P<0.05),且2组间等位基因频率差别有统计学意义(P<0.05),由此得出,TNF-a-308G/A基因多态性可能与卵巢早衰的发生存在相关性,TNF-a-308G/A基因可能是卵巢早衰发病的易感因素。
[1]Shin S Y, Lee J R, Noh G W,etal. Analysis of serum levels of anti-Mullerian hormone, inhibin B, insulin-like growth factor-I, insulin-like growth factor binding protein-3, and follicle-stimulating hormone with respect to age and menopausal status [J].JKoreanMedSci, 2008,23(1):104-110.
[2]Al-Azemi M, Killick S R, Duffy S,etal. Multi-marker assessment of ovarian reserve predicts oocyte yield after ovulation induction[J].HumReprod, 2011,26(2):414-422.
[3]Perry J R, Corre T, Esko T,etal. A genome-wide association study of early menopause and the combined impact of identified variants[J].HumMolGenet, 2013,22(7):1465-1472.
[4]Shelling A N. Premature ovarian failure[J].Reproduction, 2010:140(5):633-641.
[5]Beranger R, Hoffmann P, Christin-Maitre S,etal. Occupational exposures to chemicals as a possible etiology in premature ovarian failure:a critical analysis of the literature[J].ReprodToxicol, 2012,33(3):269-279.
[6]Ebrahimi M, Akbari Asbagh F. The role of autoimmunity in premature ovarian failure[J].IranJReprodMed, 2015,13(8):p.461-72.
[7]Naz P K, Thurston D, Santoro N. Circulating tumor necrosis factor (TNF)-alpha in normally cycling women and patients with premature ovarian failure and polycystic ovaries [J].AmJReprodImmunol, 1995,34(3):170-175.
[8]王一峰, 欧汝强, 杨宁, 等. 卵巢早衰患者血清抗透明带抗体和TNF-α、IFN-γ 及IL-2的分析[J]. 生殖医学杂志,2002,11(1):7-10.
[9]Bonyadi M, Abdolmohammadi R, Jahanafrooz Z,etal. TNF-alpha gene polymorphisms in Iranian Azari Turkish patients with inflammatory bowel diseases[J].SaudiJGastroenterol, 2014,20(2):108-112.
[10]Oregon-Romero E, Vazquez-Del Mercado M, Ruiz-Quezada S L,etal. Tumor necrosis factor alpha-308 and -238 polymorphisms in rheumatoid arthritis. Association with messenger RNA expression and sTNF-alpha[J].JInvestigMed, 2008,56(7):937-943.
[11]Kovanci E, Schutt A K. Premature ovarian failure: clinical presentation and treatment[J].ObstetGynecolClinNorthAm, 2015,42(1):153-161.
[12]Fenton A J. Premature ovarian insufficiency: Pathogenesis and management[J].JMidlifeHealth, 2015,6(4):147-153.
[13]Chapman C, Cree L, Shelling A N. The genetics of premature ovarian failure: current perspectives[J].IntJWomensHealth, 2015,7:799-810.
[14]Bilgin E M, Kovanci E. Genetics of premature ovarian failure[J].CurrOpinObstetGynecol, 2015,27(3):167-174.
[15]Sukur Y E, Kivancli I B, Ozmen B. Ovarian aging and premature ovarian failure[J].JTurkGerGynecolAssoc, 2014,15(3):190-196.
[16]Knauff E A, Eijkemans M J, Lambalk C B,etal. Anti-Mullerian hormone, inhibin B, and antral follicle count in young women with ovarian failure[J].JClinEndocrinolMetab, 2009,94(3):786-792.
[17]李明江, 刘风华, 李继俊. 肿瘤坏死因子与子宫内膜异位症[J]. 现代妇产科进展, 2000,9:215-217.
[18]Suganuma M, Kurusu M, Suzuki K,etal. New tumor necrosis factor alpha inducing protein released from Helicobacter pylori for gastric cancer progression[J].JCancerResClinOncol, 2005,131(5):305-313.
[19]丘理子, 黄映红, 赖荷, 等. 变应性鼻炎与肿瘤坏死因子水平及TNF-a-238G/A基因多态性的关系[J]. 现代医院, 2009,9(15):22-24.
[20]Gonzalez S, Rodrigo L, Martinez-Borra J,etal. TNF-alpha -308A promoter polymorphism is associated with enhanced TNF-alpha production and inflammatory activity in Crohn’s patients with fistulizing disease[J].AmJGastroenterol, 2003,98:1101-1106.
[21]Tucker R M, Hendrickson R J, Mukaida N,etal. Progressive biliary destruction is independent of a functional tumor necrosis factor-alpha pathway in a rhesus rotavirus-induced murine model of biliary atresia[J].ViralImmunol, 2007,20:34-43.
[22]Spadaro A, Scrivo R, Riccieri V,etal. Effect of tumor necrosis factor alpha antagonists in a patient with rheumatoid arthritis and primary biliary cirrhosis[J].JointBoneSpine, 2008,75:87-89.
(编辑:何佳凤)
Association of TNF-a-1 031,-238,-308 Gene Polymorphisms with Premature Ovarian Failure in Chinese Women
WANG Xuejin, LUO Xiangmin
Department of Reproductive Medicine, The Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China
ObjectiveTo investigate the relationships between tumor necrosis factor-alpha (TNF-α) gene-1 031,-238,-308 polymorphisms with premature ovarian failure in Chinese women.MethodsTwo hundred with premature ovarian failure and two hundred healthy control women were compared in the study.TNF-a-1 031, -238, -308 gene polymorphisms were assayed by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP).All statistical analyses were calculated with SPSS for Windows 16.0.ResultsThere were no significant differences in allele or genotype frequency of TNF-a-238 and TNF-a-1 031 between women with premature ovarian failure and control group(P>0.05).The homozygous GG genotype for the SNP-308G/A was significantly higher in patients with premature ovarian failure than in healthy controls (90%vs82.5%,P<0.05).The allele frequency of the TNF-α-308G was significantly higher in patients with premature ovarian failure patients than in healthy controls(P<0.05).ConclusionThe data suggested that the TNF-a-308 gene polymorphisms was associated with premature ovarian failure.
tumor necrosis factors; tumor necrosis factor-alpha; polymorphism, genetic; genes; ovary
2016-04-13
泉州市科技计划项目(2013Z108)
福建医科大学 附属第二医院生殖医学科,泉州362000
王雪金(1983-),女,主治医师,医学硕士
罗湘闽. Email: lxm@wuhansen.com
R339.22; R711.75; R711.6
A
1672-4194(2016)03-0167-05

