APEX1单核苷酸多态性与肝癌易感性关系的研究
郑智华, 黄爱民, 高美钦, 臧盛兵
APEX1单核苷酸多态性与肝癌易感性关系的研究
郑智华1,2, 黄爱民2, 高美钦2, 臧盛兵2
目的探讨中国福建人群APEX1单核苷酸多态性(SNP)与肝细胞癌(HCC)易感性的关系。方法应用连接酶检测反应(LDR)及直接测序法检测APEX1 rs2307486、rs1130409及rs33956927 3个SNP位点,并进行连锁不平衡及单倍型分析,探讨3个SNP在福建HCC人群中的分布情况,并分析其与该人群HCC易感性的关系。结果相对于GG基因型,rs33956927位点的GA基因型增加了患HCC的风险(P=0.002),而rs2307486和rs1130409多态性与HCC易感性无关(P>0.05)。结论APEX1 rs33956927多态位点携带GA基因型人群可能对HCC更易感,APEX1 rs33956927多态性可作为筛查HCC好发的危险因素;rs2307486和rs1130409多态性与HCC的发生无关。
肝肿瘤; 肿瘤; 基因; 多态性,单核苷酸; 多态现象,遗传; 聚合酶链反应
肝细胞癌(hepatocellular carcinoma,HCC)是人类最常见的恶性肿瘤之一,其发病率在全世界恶性肿瘤中排名第5位,而死亡率居第3位[1]。中国的新发HCC病例数占全世界所有新发病例数的55%[2-3]。HCC的发生是多因素、多步骤的复杂过程,受环境和遗传因素影响。而研究发现,基因组内存在的某些单核苷酸多态性(single nucleotide polymorphisms,SNP)不仅是遗传标记,而且可使个体对疾病产生不同的易感性[4-5]。
APEX1基因是多功能的DNA碱基切除修复途径的限速酶,既具有脱嘌呤/脱嘧啶位点核酸内切酶活性,修复烷化剂、氧自由基、电离辐射等因素产生的DNA损伤,又具调节转录因子的DNA结合活性,可通过调节许多转录因子的DNA结合活性,参与细胞增殖、分化和细胞凋亡等多种关键的细胞反应。分子流行病学研究表明,APEX1多态性与DNA持续交联、基因型改变和肿瘤危险性直接相关[6-8]。
近年来,APEX1基因多态性与许多恶性肿瘤如肺癌、乳腺癌、结肠癌和前列腺癌等相关性的研究均见报道[9-11],而目前国内外对肝癌APEX1多态性的研究未见相关报道。本研究应用多重PCR技术及连接酶检测反应技术检测APEX1 3个SNP位点(rs1130409、rs2307486及rs33956927)多态性在福建原发性HCC人群的分布情况,分析其与该人群HCC易感性的关系。
1 材料与方法
1.1材料选取福建医科大学附属第一医院手术切除的新鲜HCC标本100例为病例组,年龄(48.2±11.4)岁(32~72岁),其中有肿瘤家族史者19例。患者均无其他部位恶性肿瘤史,未接受放疗、化学药物治疗。另收集福建医科大学附属协和医院同期来院体检无肿瘤病史的健康人群血液标本100例为对照组,按照年龄±3岁进行匹配,其中有肿瘤家族史14例。对照组与病例组无血缘关系,均为中国福建地区汉族人群。
1.2方法
1.2.1血液和新鲜组织DNA的抽提按照DNA抽提试剂盒(北京天根生化科技有限公司)的步骤,提取组织DNA,经琼脂糖凝胶电泳及紫外分光光度计检测,-20 ℃冻存备用。
1.2.2PCR扩增目的片段APEX1 rs2307486上下游引物分别为:
F:5′ GCAAACCTGCCACACTCAA3′
R:5′TCGAAGCCCATCCACATT3′
rs1130409上下游引物分别为:
F:5′TATGCTAATTCTGTTTCATTTC3′
R:5′CACCCGGCCTTCCTGATC 3′
rs33956927上下游引物分别为:
F:5′TGTTGGGGTAGAGGTGCCTA3′
R:5′AAAAGAATGCTGGCTTCACG3′
PCR反应体系20 μL PCR,包括Tris-HCl(pH 7.4)10 mmol/L,KCl 50 mmol/L,MgCl22.0 mmol/L,dNTPs 200 mmol/L,Primers 0.5 μmol/L,polymerase 1 U,DNA 2 μL。PCR反应过程包括:95 ℃ 15 min→94 ℃变性30 s→56 ℃退火1 min→72 ℃延伸1 min,共35个循环后,72 ℃延伸7 min。3%的琼脂糖凝胶电泳检测,观察PCR产物的效果。
1.2.3多重连接酶检测反应各位点探针序列见表1,LDR反应体系包括1×Buffer 1 μL,探针1 μL,连接酶0.05 μL,H2O 16.95 μL,PCR产物1 μL。LDR反应程序为:95 ℃ 2 min→94 ℃ 30 s→50 ℃退火2 min,共35个循环后,72 ℃延伸7 min。取三重LDR产物1 μL,采用5%聚丙烯酰胺凝胶电泳跑胶。采用Genemapper软件进行基因分型分析,同时样本送上海生工生物工程公司进行测序分析(各位点基因型测序见图1~3)。

表1 各位点探针序列
1.3统计学处理所有实验室基因型数据及调查资料经过核实后,应用EpiData软件进行数据录入并建立数据库,运用SPSS 16.0软件进行数据整理分析。计算病例组及对照组的基因型、等位基因频率,使用χ2检验比较病例组及对照组间基因型频率、等位基因频率的分布差别。采用SHEsis在线软件计算2个多态性位点间连锁不平衡系数(D’)和r2值并构建单倍型[12]。采用单因素条件Logistic回归模型分析基因型与病例组的临床病例因素的关联性,计算其OR及95%CI。所有的统计检验均为双侧概率检验,P<0.05为差别具有统计学意义。
2 结 果
2.1基本信息共收集病例组和对照组各100例,其中男性151例(75.5%),女性49例(24.5%)。经卡方拟合优度检验,病例组和对照组均符合Hardy-Weinberg平衡定律(表2)。病例组和对照组在年龄、性别及民族构成上的比较,差别无统计学意义(P>0.05);但2组在HBV感染情况分布的比较,差别具有统计学意义(P<0.05)。
2.2rs2307486、rs1130409和rs33956927位点与HCC易感性的关系rs2307486位点等位基因频率分析见表3,rs1130409位点等位基因频率分析见表4,各组差别均无统计学意义。在病例组和对照组中,rs33956927等位基因频率分析P=0.002,基因型频率P=0.002(表5)。其中T等位基因只在病例组中出现,100例HCC中有9例是GT基因型,其余91例均为GG基因型;对照组中只有GG基因型,未有出现GT基因型。经非条件 logistic 回归分析法校正HBV感染情况后,与T等位基因相比,G等位基因与HCC的发病风险有统计学意义(P=0.002)。
2.3rs2307486、rs1130409及rs339569273个位点连锁不平衡及单倍型分析连锁不平衡分析结果显示,rs1130409及rs33956927位点间存在连锁不平衡(D′=0.519),其余两两位点间不存在连锁不平衡(D′<0.5)。单倍型分析计算,结果显示所有单倍型均和HCC完全不相关。

表2 各位点病例组和对照组Hardy-Weinberg平衡定律检验
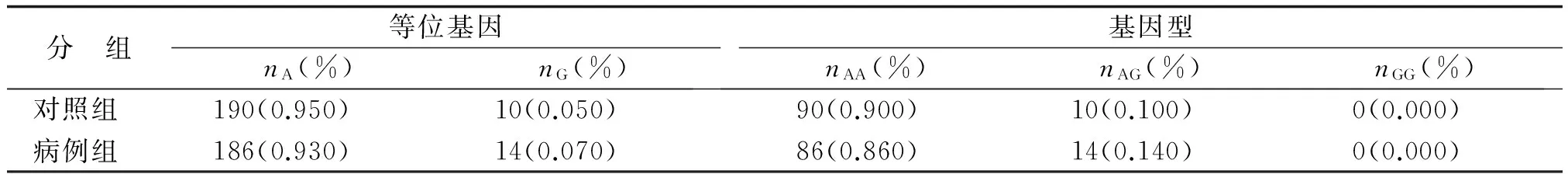
表3 rs2307486 基因型频率统计学分析
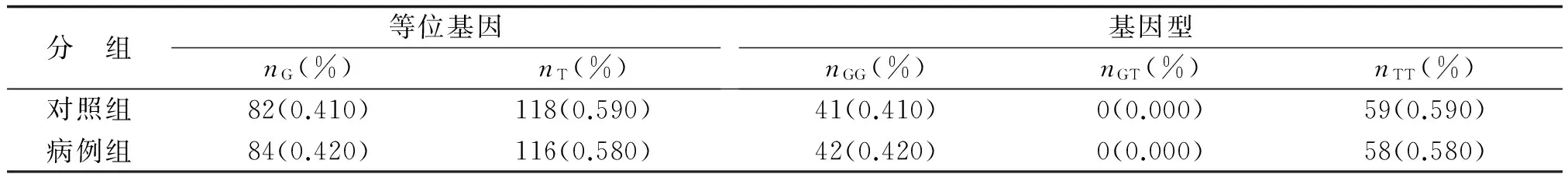
表4 rs1130409基因型频率统计学分析
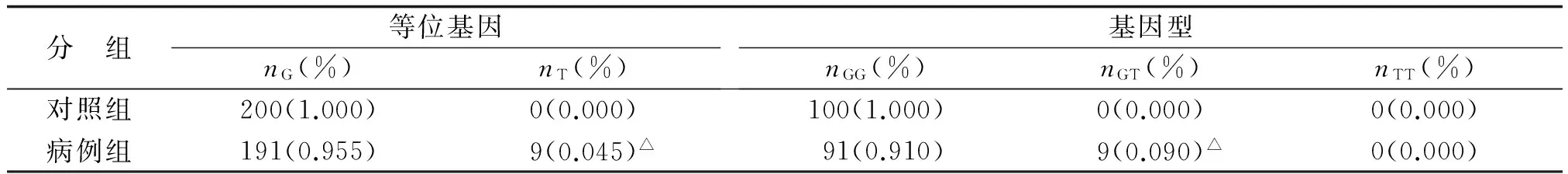
表5 rs33956927基因型频率统计学分析
与对照组比较,△:P<0.05.
3 讨 论
HCC是最常见的恶性肿瘤之一,恶性度高,预后非常差。福建省作为HCC的高发省份,每年约6 000人因HCC死亡。然而,HCC的发病机制还未完全阐明。研究结果表明,DNA修复基因内的SNP,可影响DNA的修复能力,最终影响HCC的易感性,是HCC的遗传因素基础[13]。
APEX1基因位于14号染色体q11.2-12,长度为2.6 kb,有4个内含子和5个外显子。作为多功能的DNA修复酶,APEX1主要负责修复AP位点,AP位点是DNA最常见的损伤位点之一,具有细胞毒性和基因毒性,若不能修复,可阻碍DNA的复制,导致基因突变、染色体微卫星不稳定性或细胞凋亡,最终可导致肿瘤的发生。此外,APEX1又具有氧化还原因子活性,可通过调节许多转录因子的DNA结合活性,参与细胞增殖、分化和细胞凋亡等多种关键的细胞反应。本课题组通过组织芯片研究发现,APEX1在HCC的表达明显高于癌旁肝组织,并且蛋白的细胞质表达增多及细胞核的表达增强,提示肝癌患者的预后越差[14]。本课题组还进一步构建APEX1-siRNA感染肝癌细胞MHCC-97。通过检测发现,APEX1基因抑制可降低肿瘤的侵袭和运动能力[15],提示肝癌组织中APEX1的检测可作为判断患者预后的指标之一,且APEX1有望成为HCC肿瘤治疗的靶点。
为进一步研究APEX1 SNP与HCC易感性的关系,笔者检测rs1130409、rs2307486及rs33956927 3个SNP。rs33956927是APEX1基因核苷酸第2 474位点上G→A的转换,使第241个氨基酸由甘氨酸转换成精氨酸,位于第5个外显子上。本研究中,笔者检测100例福建省HCC患者的DNA,发现rs33956927 A等位基因频率为0.045,而正常对照人群中未发现T等位基因。正常人群中均为纯合子GG,而HCC患者只有纯合子GG或杂合子GA,没有AA基因型。GG基因型与GA基因型分布具有显著差别,提示rs33956927位点的GA基因型相对于GG基因型,增加了患HCC风险(P=0.002),携带GA基因型人群可能对HCC更易感。由于rs33956927是APEX1 4个错义突变位点之一,笔者推测,可能是SNP造成蛋白质构象发生改变,从而使基因功能受到影响。但具体机制尚需进一步实验深入研究。
rs1130409是目前APEX1研究最多的SNP位点,它指在核苷酸第2 197位点上T→G的颠换,使第148个氨基酸由天冬氨酸转换成谷氨酸,位于第5个外显子上,DNA修复功能结构域内。该位点可出现3种基因型:TT、GT和GG。国内外有关APEX1 rs1130409多态性与肿瘤相关性的研究结果的报道不尽一致。148Glu/Glu基因型在德国人群中具有保护性意义,可降低肺癌的危险性[16]。而其他研究结果却显示,148Glu/Glu基因型可增加某些肿瘤易感性[9]。但Ito等研究发现,日本人群rs1130409多态性与肺癌易感性无关,Asp/Glu和Glu/Glu基因型与Asp/Asp基因型比较,其肺癌危险性差别无统计学意义[17]。对于国内外研究结果不尽一致的现象,笔者推测可能是由于环境致癌物暴露及程度的不同以及基因型频率分布的种族和地区差别所致。虽然有研究指出,rs1130409多态性并不影响APEX1的功能,包括核酸内切酶活性和DNA结合能力,不会使DNA修复功能发生变化,但该多态性可能会影响细胞的某些正常生理进程[18]。例如,Hu等发现,rs1130409多态性在正常人群中与有丝分裂延迟有关,且148Glu等位基因型可能对电离辐射具有更高的敏感性,从而增加对肿瘤的易感性[19]。这也可以解释rs1130409多态性增加肿瘤易感性的结论。
本研究结果显示,rs1130409G等位基因频率为0.396,但rs1130409基因型及等位基因分布无显著差别,提示rs1130409多态性与福建省HCC的危险性无关(P=0.680)。
APEX1 rs2307486位于第3外显子上,是第1 247个碱基由A转换成G,导致该位点形成氨基酸变异体,由异亮氨酸转变成缬氨酸。目前国内外对该SNP的研究报道并不多,仅Zienolddiny等检测其在肺癌人群的分布,发现rs2307486多态性具有保护作用,可降低挪威人群非小细胞肺癌的危险性[20]。本研究中,正常人群和肝癌HCC只有纯合子AA或杂合子AG,没有GG基因型,但统计学分析显示,正常人群和HCC患者中基因型及等位基因分布的差别无统计学意义(P>0.05),提示rs2307486多态性与HCC发生的危险性无关。
本研究发现,rs1130409与rs33956927位点间存在着连锁不平衡(D′=0.519),但二者之间的关联较弱(D′<0.8)。3个多态性位点共构建了7种单倍型,频率<0.05的单倍型被忽略,只计算P>0.05的单倍型,结果显示所有单倍型和HCC均不相关。
总之,本研究发现在福建人群中,APEX1 rs33956927多态性位点GA基因型可增加患HCC的风险,但未发现rs1130409和rs2307486多态性与肝癌的易感性相关。rs1130409与rs33956927位点间存在着连锁不平衡,但是本研究尚未确定这2个位点联合作用是否对APEX1基因功能产生影响。要解决上述问题,需进一步扩大样本量,并进行基因功能机制的研究来探讨APEX1多态性与HCC的关系。
[1]Leslie H, Blumgart. 肝胆胰外科学[M]. 黄洁夫, 译. 北京:人民卫生出版社, 2010:1144.
[2]杨甲梅. 实用肝胆外科学[M]. 上海:上海人民出版社, 2009:131.
[3]Jemal A,Thomas A,Murray T,etal. Cancer statistics[J].CancerClin, 2002,52(2):23-47.
[4]Kim H Y,Yoon J H,Lee H S,etal. MicroRNA-196A-2 polymorphisms and hepatocellular carcinoma in patients with chronic hepatitis B[J].JMedVirol, 2014,86(3):446-453.
[5]Pan Y,Zhao L,Chen X M,etal. The XRCC1 Arg399Gln genetic polymorphism contributes to hepatocellular carcinoma susceptibility: an updated meta-analysis[J].AsianPacJCancerPrev,2013,14(10):5761-5767.
[6]Yu E T,Hadi M Z. Bioinformatic processing to identify single nucleotide polymorphism that potentially affect Ape1 function[J].MutatRes, 2011,722(2):140-146.
[7]Wallace S S,Sweasy J B,Nemec A A,etal. Variant base excision repair proteins: contributors to genomic instability[J].SeminCancerBiol,2010,20(5):320-328.
[8]Karahalil B,Bohr V A,Wilson D M. Impact of DNA polymorphisms in key DNA base excision repair proteins on cancer risk[J].HumExpToxicol, 2012,31(10):981-1005.
[9]Osawa K,Miyaishi A,Uchino K,etal. APEX1 Asp148Glu gene polymorphism is a risk factor for lung cancer in relation to smoking in Japanese[J].AsianPacJCancerPrev,2010,11(5):1181-1186.
[10]Kim K Y,Han W,Noh D Y,etal. Impact of genetic polymorphisms in base excision repair genes on the risk of breast cancer in a Korean population[J].Gene, 2013,532(2):192-196.
[11]Li Y,Li S,Wu Z,etal. Polymorphisms in genes of APE1, PARP1, and XRCC1: risk and prognosis of colorectal cancer in a northeast Chinese population[J].MedOncol,2013,30(2):505.
[12]Shi Y Y,He L. SHEsis, a powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci[J].CellRes,2005,15(2):97-98.
[13]Wong R H,Huang C H,Yeh C B,etal. Effects of metallothionein-1 genetic polymorphism and cigarette smoking on the development of hepatocellular carcinoma [J].AnnSurgOncol,2013,20(6):2088-2095.
[14]郑智华,黄爱民,刘景丰,等. APE1在肝细胞癌组织芯片的表达及临床病理意义[J]. 福建医科大学学报,2008,42(2):100-103.
[15]Zheng Z H,Du W,Li Y J,etal. Lentiviral-mediated short hairpin RNA silencing of APE1 suppresses hepatocellular carcinoma proliferation and migration: A potential therapeutic target for hepatoma treatment[J].OncolRep,2015,34(1):95-102.
[16]Popanda O,Schattenerg T,Phong C T,etal. Specific combinations of DNA repair gene variants and increased risk for non-small cell lung cancer[J].Carcinogenesis, 2004,25(12):2433-2441.
[17]Ito H,Matsuo K,Hamajima N,etal. Gene-environment interactions between the smoking habit and polymorphisms in the DNA repair genes, APE/ref-1 Asp148Glu and XRCC1 Arg399Gln, in Japanese lung cancer risk[J].Carcinogenesis,2004,25(8):1395-1401.
[18]Hadi M Z,Coleman M A,Fidelis K,etal. Functional characterization of Ape1 variants identified in the human population[J].NucleicAcidsRes,2000,28(20):3871-3879.
[19]Hu J J,Smith T R,Miller M S,etal. Genetic regulation of ionizing radiation sensitivity and breast cancer risk[J].EnvironMolMutagen,2002,39(2-3):208-215.
[20]Zienolddiny S,Campa D,Lind H,etal. Polymorphisms of DNA repair genes and risk of non-small cell lung cancer[J].Carcinogenesis,2006,27(3):560-567.
(编辑:张慧茹)
Association of Single Nucleotide Polymorphism of APEX1 Gene with Susceptibility to Hepatocellular Carcinoma
ZHENG Zhihua1,2, HUANG Aimin2, GAO Meiqin2, ZANG Shengbing2
1. Department of Pathology, Quanzhou Medical College, Quanzhou 362000, China;2. Department of Pathology, Institution of Oncology, Fujian Medical University, Fuzhou 350004, China
ObjectiveTo explore the association between the single nucleotide polymorphisms(SNP) of APEX1 gene and the susceptibility to hepatocellular carcinoma among Chinese Han people in Fujian.MethodsThe SNP of APEX1 rs2307486, rs1130409 and rs33956927 were detected by ligase detection reaction (LDR) and sequecing test, and the linkage disequilibrium (LD) and haplotype analysis were also used to investigate the association of the SNPs with the risk of HCC.ResultsFor the polymorphism of rs33956927 significantly increased the risk of develop HCC(P=0.002), whereas the rs2307486 and rs1130409 polymorphisms had no effects on HCC(P>0.05).ConclusionsAPEX1 rs33956927 polymorphism with GA genotype may more sensitive to HCC.APEX1 rs33956927 polymorphism can be used as a risk factor for screening HCC; while rs2307486 and rs1130409 polymorphisms had no effects on HCC.
liver neoplasms; neoplasms; genes; polymorphism, single nucleotide; polymorphism, genetic; polymerase chain reaction
2015-12-22
福建省自然科学基金(2006J0099)
1. 泉州医学高等专科学校 基础医学部病理教研室,泉州362000;
2. 福建医科大学 基础医学院病理学系,福州350004
郑智华(1980-),女,讲师,医学硕士
黄爱民. Email: aimin@fjmu.edu.cn
R394; R394.2; R394.25; R735.7
A
1672-4194(2016)02-0088-05

