超声在意义不明确的细胞非典型病变甲状腺结节中的价值
张 青,朱庆莉,李文波,姜玉新,孟芝兰,毕娅兰,赵 雨
中国医学科学院 北京协和医学院 北京协和医院 1超声医学科 2病理科,北京 100730
·论著·
超声在意义不明确的细胞非典型病变甲状腺结节中的价值
张青1,朱庆莉1,李文波1,姜玉新1,孟芝兰2,毕娅兰2,赵雨2
中国医学科学院北京协和医学院北京协和医院1超声医学科2病理科,北京 100730
目的评估甲状腺超声在意义不明确的细胞非典型病变(AUS)中的临床价值。方法选取2014年1月至2015年12月在北京协和医院进行甲状腺细针穿刺患者1984例,其中细胞学诊断为AUS并有手术病理或临床随诊的病例83例,回顾分析83例甲状腺穿刺结节超声声像图资料,依据美国甲状腺协会推荐的超声图像进行分级:高度可疑恶性、中度可疑恶性、低度可疑恶性。结果83例中手术证实恶性19例(22.9%)、良性8例(9.6%),临床随诊无异常改变56例(67.5%)。单发结节36例(43.4%)、多发结节47例(56.6%),结节最大径(1.2±0.7)cm。病理恶性19例中16例(84.2%)超声分级为高度可疑恶性,2例(10.5%)为中度可疑恶性,1例(5.3%)为低度可疑恶性。单因素及多因素分析显示甲状腺结节恶性程度与穿刺结节超声图像分级显著相关[OR=9.23(2.96~28.79),P=0.00],但与患者的年龄、性别、结节数目及结节大小无关(P均>0.05)。结论甲状腺超声图像分级有助于诊断为AUS甲状腺结节的良恶性判断。
超声;Bethesda分类;超声引导下细针抽吸细胞学检查;甲状腺结节
ActaAcadMedSin,2016,38(4):378-382
甲状腺细针抽吸细胞学检查(fine-needle aspiration,FNA)已经广泛应用于甲状腺结节的诊断,其诊断敏感性为58%~100%,特异性为47.4%~100%[1]。甲状腺细胞病理学Bethesda报告系统是目前推荐使用的甲状腺细胞学分类方法,其中第Ⅲ类是意义不明确的细胞非典型病变(atypia of undetermined significance,AUS)或滤泡性病变,恶性发生率5%~15%[2]。这类结节的后续临床处理多样,包括随访、重复穿刺或手术,甲状腺超声在AUS结节的临床处理决策中是否能够发挥作用,目前也存在争议[3- 4]。本研究回顾性分析诊断为AUS的甲状腺结节超声图像,并与病理对照,探讨不同声像图表现的甲状腺结节的临床处理原则。
对象和方法
对象选取2014年1月至2015年12月北京协和医院进行甲状腺细针穿刺活检患者1984例,其中诊断为AUS的83例,患者平均年龄(45.6±12.0)岁,男性16例(19.3%)、女性67例(80.7%),27例获得手术病理,其余全部进行临床随诊包括触诊和超声检查,无失访者,临床随诊时间7~24个月,其中1年内的随诊病例为9例,记录其临床资料包括结节数目、结节大小和手术病理或临床随诊结果。甲状腺FNA的指征是:(1)超声发现甲状腺结节,不能除外恶性;(2)具有高危因素,如患慢性淋巴细胞性甲状腺炎、既往有甲状腺癌手术史;(3)甲状腺结节在随访过程中变大或变硬;(4)核素显像为冷结节[1]。
方法患者仰卧,颈部垫高,常规消毒铺巾。使用IU 22超声仪(荷兰Philips公司),高频线阵探头,探头频率12 MHz,选择仪器出厂预设的甲状腺检查条件,根据病灶具体情况调整深度、增益、聚焦部位,使图像效果达最佳,获得病灶最长径切面及横切面二维图像和彩色多普勒超声图像,并测量其大小,记录病灶数目。穿刺部位选择结节实性部分重点取材,超声引导全程监视穿刺针方向和位置。使用2%利多卡因进行局部麻醉,21G针接10 ml注射器穿刺刺入甲状腺结节内,保持负压,进行反复提插抽吸20次以上。消除负压,拔出针头,吸取标本立即涂片2~7张,95%乙醇固定。
图像分析采用美国甲状腺协会2015年推荐的超声图像分级:(1)高度可疑恶性:实性低回声结节伴有不伴有部分囊性成分,出现一种或者更多恶性征象,如:形态不规则、微小钙化、纵横比大于1及甲状腺腺体外转移征象等;(2)中度可疑恶性:低回声实性结节,边缘光整,无微小钙化,无纵横比大于1及腺体外转移征象;(3)低度可疑恶性:等回声及高回声结节,或者囊性结节伴有偏心的实性成分,无不规则边缘、微小钙化、纵横比大于1及腺体外转移征象[5]。两位医生共同阅读图像判定。
细胞学诊断分类细胞学诊断由受过甲状腺细胞病理学Bethesda报告系统细胞病理诊断培训的细胞病理医生出具。诊断分为以下6类:Ⅰ:标本无法诊断或不满意;Ⅱ:良性病变;Ⅲ:意义不明确的细胞非典型性病变或滤泡性病变;Ⅳ:滤泡性肿瘤或可疑滤泡性肿瘤;Ⅴ:可疑恶性肿瘤;Ⅵ:恶性肿瘤[2]。选取诊断为AUS的病例。
统计学处理采用SPSS 22.0软件进行统计学分析,单因素分析采用t检验、卡方检验及单因素方差分析,多因素分析采用二元Logistic回归检验。P<0.05为差异有统计学意义。
结 果
临床资料诊断为AUS的83例,单发结节36例(43.4%)、多发结节47例(56.6%),结节最大径(1.2±0.7) cm。27例在患者的强烈要求下进行手术,恶性19例(22.9%),病理均为乳头状癌,其中8例为滤泡型、11例为经典型;良性8例(9.6%),1例为慢性甲状腺炎、1例为结节性甲状腺肿伴腺瘤样增生、6例为结节性甲状腺肿伴纤维化和(或)钙化。临床随诊56例(67.5%),无结节明显增大及临床与超声转移征象,其中重复穿刺3例,为良性病变。以手术病理及临床随诊未发现恶性表现为标准,病理为恶性的结节归为恶性组,其余归为良性组。在良恶性组之间,性别、年龄、结节数目及结节大小差异均无统计学意义(P均>0.05)(表1)。
超声分级与病理83例结节的超声分级,高度可疑恶性28例(图1)、中度可疑恶性32例(图2)及低度可疑恶性23例(图3),其在良恶性组间分布差异有统计学意义(P=0.00)(表1)。病理恶性19例中有16例(84.2%)超声分级为高度可疑恶性,均为甲状腺乳头状癌,其中滤泡型7例、经典型9例;2例(10.5%)超声分级为中度可疑恶性,分别为滤泡型和经典型;1例(5.3%)为低度可疑恶性,为经典型。病理为良性8例中3例超声分级为高度可疑恶性、1例为慢性甲状腺炎、2例结节性甲状腺肿伴纤维化和(或)钙化;3例为中度可疑恶性,1例为结节性甲状腺肿大伴腺瘤样增生,2例为结节性甲状腺肿伴纤维化和(或)钙化;2例为低度可疑恶性,均为结节性甲状腺肿伴纤维化和(或)钙化。
以超声分级高度可疑恶性作为超声表现的恶性组,超声分级高度可疑恶性对于甲状腺结节恶性的诊断准确率81.9%、特异性81.3%、敏感性84.2%、阳性预测值57.1%、阴性预测值94.5%。
多因素分析以结节良恶性为因变量,患者性别、年龄、结节数目及结节最大径线和超声分级为自变量,进行二元Logistic分析。超声分级与结节恶性度密切相关[OR=9.23(2.96~28.79),P=0.00],结节良恶性与患者性别[OR=3.92(0.71~21.53),P=0.12]、年龄[OR=0.99(0.94~1.05),P=0.81]、结节数目[OR=1.14(0.29~4.46),P=0.85]及结节最大径线[OR=1.14(0.40~3.23),P=0.81]无关。
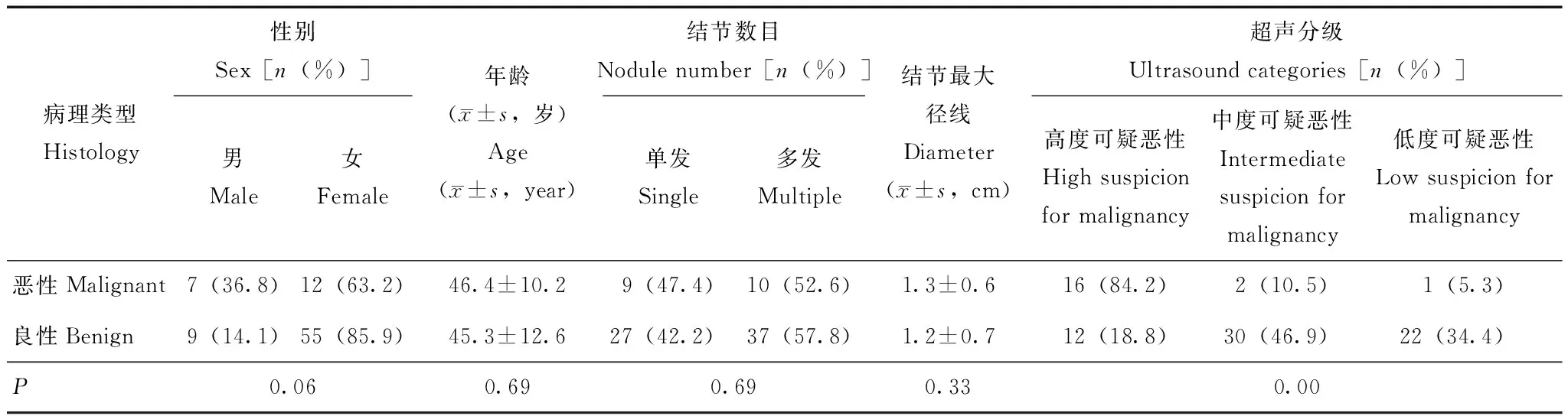
表 1 临床资料及超声分级在良恶性组间的分布Table 1 Comparisons of clinical factors and ultrasound categories between the benign and malignant groups
FNA:细针抽吸细胞学检查;AUS:意义不明确的细胞非典型病变FNA: fine-needle aspiration;AUS: atypia of undetermined significance
图 1超声分级为高度可疑恶性,FNA为AUS,手术病理为甲状腺乳头状癌
Fig 1Ultrasound category: high suspicion for malignancy;FNA diagnosis:AUS;surgical pathology: papillary thyroid carcinoma
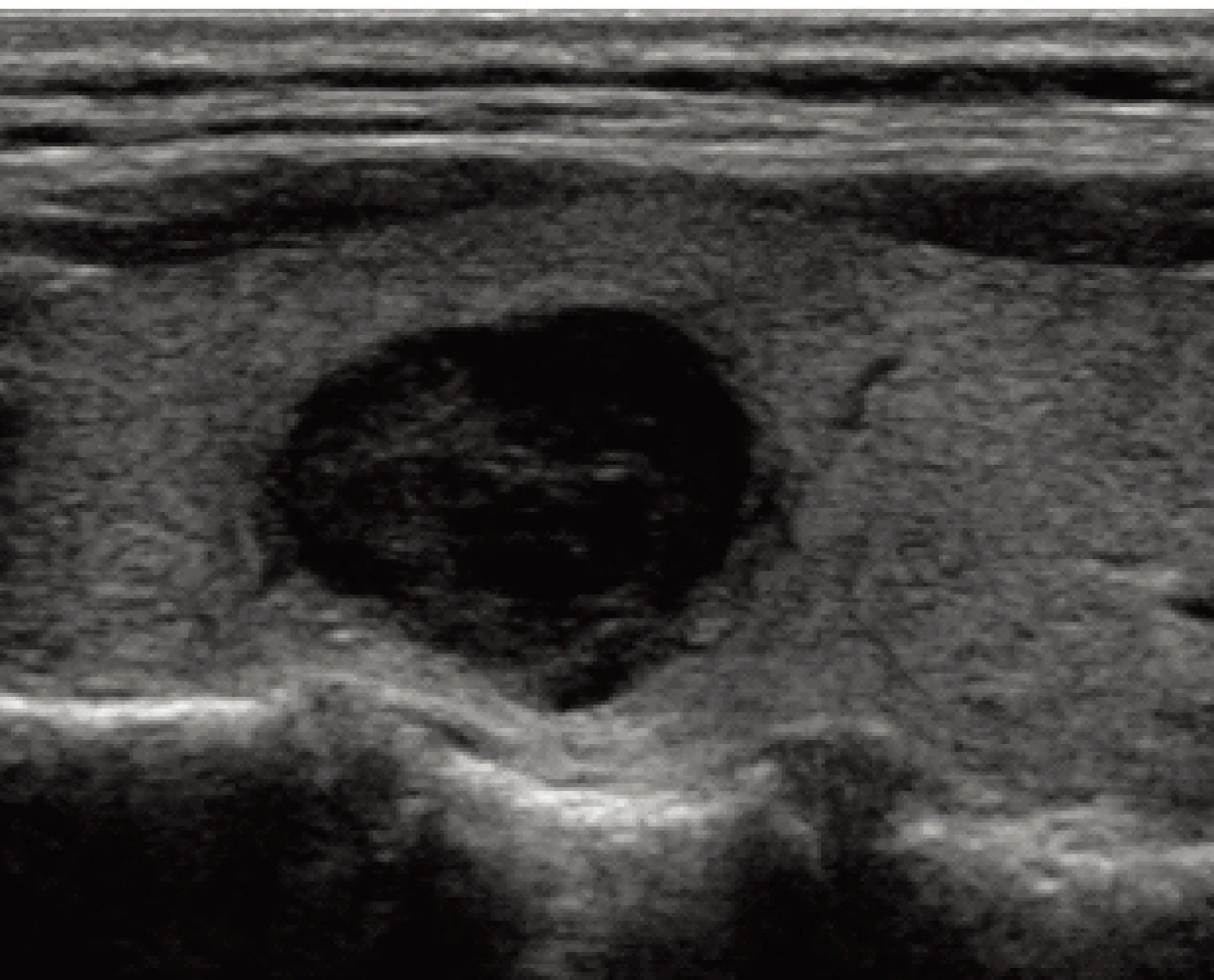
图 2超声分级为中度可疑恶性,FNA为AUS,手术病理为结节性甲状腺肿伴腺瘤样增生
Fig 2Ultrasound category: intermediate suspicion for malignancy;FNA diagnosis: AUS;surgical pathology: nodular goiter with adenomatous hyperplasia

图 3超声分级为低度可疑恶性,FNA为AUS,手术病理为结节性甲状腺肿
Fig 3Ultrasound category: low suspicion for malignancy;FNA diagnosis: AUS;surgical pathology: nodular goiter
讨 论
本研究AUS占所有FNA病例4.18%,与以往报道的3%~27%[4,6- 7]较为一致,但恶性率22.9%,略高于Bethesda分类Ⅲ的5%~15%[2]恶性度。这可能与FNA入选标准有关,本研究采用甲状腺超声检查筛选可疑结节进入FNA,而不是以结节大小为标准。类似的高恶性率在其他研究也有报道,为27.5%~55.5%[3- 4,8- 9]。因此进一步区分AUS结节的良恶性,对指导后续临床处置有重要意义。
甲状腺超声是目前甲状腺结节诊断最为准确有效的方法,但其在AUS结节中的作用目前存在争议。有研究表明AUS结节的超声征象如极低回声、形态不规则、微钙化及纵横比大于1与结节恶性度明显相关,但不同研究中有意义的超声征象并不一致[4,9- 12],甚至有研究表明这些超声征象与结节良恶性无关[3]。因此,部分研究者综合不同的超声征象进行超声图像分级,分析其与结节良恶性的关系。Kim等[8]将53例诊断Bethesda Ⅲ的甲状腺结节超声表现分为良性及恶性,与病理对照分析,超声恶性的诊断敏感性及特异性均在85%以上;Gweon等[4]报道超声分型与结节良恶性明显相关,恶性超声类型诊断敏感性94.1%、特异性 69.6%;但Park等[3]却发现甲状腺影像报告和数据系统分类与结节良恶性无相关性。本研究采用2015年美国甲状腺协会推荐的超声分级,分为低度可疑恶性、中度可疑恶性、高度可疑恶性3级,综合分析甲状腺结节的超声恶性征象,避免单个超声征象的判断偏移。对照AUS结节良恶性,发现超声分级与AUS结节良恶性明显相关,是主要影响因素,其中高度可疑恶性的诊断敏感性、特异性及准确性均在80%以上,恶性率84.2%,明显高于中度可疑恶性的10.5%及可疑恶性的5.3%,因此,本研究认为美国甲状腺协会推荐的超声分级在一定程度上可有助于预测AUS结节的良恶性,超声高度怀疑为恶性,需进行二次穿刺活检,必要时考虑手术切除,而超声中度及低度可疑恶性的结节可考虑随诊为主,对后续临床处理有一定的指导意义。
目前推荐对AUS类结节的重复细针穿刺需要间隔一段时间,以避免前一次穿刺对后续穿刺的影响,如出血等,从而利于进一步鉴别良恶性结节[2]。但Lee等[13]认为Bethesda分类细胞学表现有一定重叠,不可能完全区分,即重复细针穿刺无法完全避免AUS的出现,因此,有研究推荐重复粗针穿刺活检以组织学弥补细胞学的不足[14- 15]。本研究患者重复穿刺依从性不高,仅2例进行重复细胞学穿刺,无活检穿刺病例。
此外,也有学者关注AUS病例中恶性的临床相关影响因素。部分研究表明男性患者年龄大于40岁及结节直径≥2 cm与结节恶性度明显相关[11,16- 17],Mehta 等[18]的研究表明结节大小是AUS结节恶性度的独立因素,结节大小每增加1 mm,恶性风险增加4.3%。但近来多数研究表明患者性别、年龄、结节大小、结节位置及结节数目与良恶性无关[3],这与本研究结果一致,结节良恶性与患者临床资料无相关性。
AUS甲状腺恶性结节的病理类型多数是甲状腺乳头状癌,有部分研究表明其中的滤泡型甲状腺乳头状癌占优势[3],这些滤泡型甲状腺乳头状癌结节的超声表现与良性结节存在交叉[9],是超声鉴别的难点所在。但本研究滤泡型为8例、经典型11例,未见滤泡型结节的优势分布。手术切除的良性结节多为结节性甲状腺肿伴纤维化及钙化,其超声征象与恶性病变存在交叉,从而造成术前超声的误判。
综上,甲状腺FNA中AUS结节的超声图像分级有助于结节良恶性的诊断,对临床后续的处理有指导意义。
[1]李文波,朱庆莉,姜玉新,等. 超声引导下细针吸取细胞学检查对甲状腺结节的诊断价值[J]. 中国医学科学院学报,2010,32(1):76- 80.
[2]Ali SZ,Cibas ES. The bethesda system for reporting thyroid cytopathology: definitions,criteria,and explanatory notes[M].New York: Springer,2010:1- 75.
[3]Park VY,Kim EK,Kwak JY,et al. Malignancy risk and characteristics of thyroid nodules with two consecutive results of atypia of undetermined significance or follicular lesion of undetermined significance on cytology[J].Eur Radiol,2015,25(9):2601- 2607.
[4]Gweon HM,Son EJ,Youk JH,et al. Thyroid nodules with Bethesda system Ⅲ cytology: can ultrasonography guide the next step? [J].Ann Surg Oncol,2013,20(9):3083- 3088.
[5]Haugen BR,Alexander EK,Bible KC,et al.2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the american thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid,2016,26(1):1- 133.
[6]Theoharis CG,Schofield KM,Hammers L,et al. The Bethesda thyroid fine-needle aspiration classification system: year 1 at an academic institution[J]. Thyroid,2009,19(11):1215- 1223.
[7]Jo VY,Stelow EB,Dustin SM,et al. Malignancy risk for fine-needle aspiration of thyroid lesions according to the Bethesda System for Reporting Thyroid Cytopathology[J]. Am J Clin Pathol,2010,134(3):450- 456.
[8]Kim DW,Lee EJ,Jung SJ,et al. Role of sonographic diagnosis in managing Bethesda class Ⅲ nodules[J]. AJNR Am J Neuroradiol,2011,32(11):2136- 2141.
[9]Yoo WS,Choi HS,Cho SW,et al. The role of ultrasound findings in the management of thyroid nodules with atypia or follicular lesions of undetermined significance[J]. Clin Endocrinol (Oxf),2014,80(5):735- 742.
[10]Kayilioglu SI,Dinc T,Sozen I,et al. Thyroid nodules with atypia or follicular lesions of undetermined significance (AUS/FLUS): analysis of variables associated with outcome[J]. Asian Pac J Cancer Prev,2015,15(23):10307- 10311.
[11]Kuru B,Atmaca A,Tarim IA,et al. Risk factors associated with malignancy and with triage to surgery in thyroid nodules classified as Bethesda category Ⅲ (AUS/FLUS) [J]. Eur J Surg Oncol,2016,42(1):87- 93.
[12]Lee S,Shin JH,Oh YL,et al. Subcategorization of Bethesda system category Ⅲ by ultrasonography[J]. Thyroid,2016,26(6):836- 842.
[13]Lee YH,Kim BH,Suh SI,et al. Comparison of cytological results obtained by repeated US-guided fine-needle aspiration biopsies of thyroid nodules: focus on the rate of malignancy and diagnostic concordance[J]. Diagn Cytopathol,2009,37(7):492- 497.
[14]Park KT,Ahn SH,Mo JH,et al. Role of core needle biopsy and ultrasonographic finding in management of indeterminate thyroid nodules[J]. Head Neck,2011,33(2):160- 165.
[15]Na DG,Min HS,Lee H,et al.Role of core needle biopsy in the management of atypia/follicular lesion of undetermined significance thyroid nodules: comparison with repeat fine-needle aspiration in subcategory nodules[J]. Eur Thyroid J,2015,4(3):189- 196.
[16]Miller B,Burkey S,Lindberg G,et al. Prevalence of malignancy within cytologically indeterminate thyroid nodules[J]. Am J Surg,2004,188(5):459- 462.
[17]Kim JW,Park IS,Kim BM,et al. The clinical significance of atypia in thyroid fine-needle aspiration[J]. Eur Arch Otorhinolaryngol,2007,264(9):1053- 1057.
[18]Mehta RS,Carty SE,Ohori NP,et al. Nodule size is an independent predictor of malignancy in mutation-negative nodules with follicular lesion of undetermined significance cytology[J]. Surgery,2013,154(4):730- 736;discussion 736- 738.
Role of Thyroid Ultrasound in the Diagnosis of Thyroid Nodules with Atypia of Undetermined Significance
ZHANG Qing1,ZHU Qing-li1,LI Wen-bo1,JIANG Yu-xin1,MENG Zhi-lan2,BI Ya-lan2,ZHAO Yu2
1Department of Ultrasound,2Department of Pathology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
JIANG Yu-xinTel: 010- 69155491,E-mail: jiangyx@pumch.ac.cn
ObjectiveTo evaluate the role of ultrasound for thyroid nodules with atypia of undetermined significance(AUS).MethodsFrom January 2014 to December 2015,83 thyroid nodules with AUS diagnosed by ultrasound-guided fine-needle aspiration biopsy were collected from 1984 subjects. On the basis of ultrasonic features,each thyroid nodule was prospectively classified into one of three categories: low suspicion for malignancy,intermediate suspicion for malignancy,and high suspicion for malignancy. ResultsAmong 83 lesions,19 lesions(22.9%) were confirmed malignant,8 lesions (9.6%)were benign,56 lesions (67.5%)had no abnormal changes during clinical follow-up. The nodules were solitary in 36 cases (43.4%)and multiple in 47 cases(56.6%).The maximum diameter was (1.2±0.7)cm. Based on the ultrasonic feature of 19 malignant cases,16 cases (84.2%) were classified as high suspicion for malignancy,2 cases(10.5%) as intermediate suspicion for malignancy,and 1 case(5.3%) for low suspicion for malignancy. Univariate and multivariate analyses revealed that the degree of malignancy of thyroid nodules was significantly associated with ultrasound image classification[OR=9.23(2.96- 28.79),P=0.00],but not with age,gender,nodule number,and nodule size (allP>0.05).ConclusionUltrasound diagnosis by using the present thyroid ultrasound classification system can be helpful for distinguishing malignant and benign AUS thyroid nodules.
ultrasonography;Bethesda system;ultrasound-guided fine-needle aspiration biopsy;thyroid nodules
国家科技部国际科技合作计划(2015DFA30440) Supported by International Science and Technology Cooperation Program of the Ministry of Science and Technology (2015DFA30440)
姜玉新电话: 010- 69155491,电子邮件:jiangyx@pumch.ac.cn
R445.1
A
1000- 503X(2016)04- 0378- 05
10.3881/j.issn.1000- 503X.2016.04.002
2016- 05- 09)

