规范化术后多模式镇痛治疗对加速腹盆部手术后康复的意义
申 乐,黄宇光
中国医学科学院 北京协和医学院 北京协和医院麻醉科,北京 100730
·综述·
规范化术后多模式镇痛治疗对加速腹盆部手术后康复的意义
申乐,黄宇光
中国医学科学院北京协和医学院北京协和医院麻醉科,北京 100730
加速术后康复(ERAS)旨在通过围术期多学科联合的临床路径干预管理,改善并加速手术患者的术后康复。术后镇痛治疗是ERAS的重要组成部分之一。2012年至今,国际ERAS学会先后发布了7部关于腹盆部手术的ERAS指南,所有这些指南均指出规范化术后多模式镇痛治疗可以显著改善术后镇痛效果、加速术后康复。胸段硬膜外镇痛是腹盆部手术后镇痛治疗的基础方案。此外,多模式镇痛治疗还需要综合应用多种辅助镇痛方式和药物共同达到ERAS目的。本文主要综述这7部ERAS指南中与术后镇痛治疗相关的推荐意见,为实施规范化术后多模式镇痛治疗提供参考依据。
加速术后康复;术后多模式镇痛;指南
ActaAcadMedSin,2016,38(4):458-463
手术创伤所导致的疼痛是患者、手术医生和麻醉医生等共同面临的挑战。80%以上的手术患者会有明显的术后疼痛,其中仅有一半左右的患者对术后镇痛效果满意[1]。术后镇痛不足会延长患者的住院时间,延缓术后恢复进度,甚至会影响疾病的预后。加速术后康复(enhanced recovery after surgery,ERAS)是近10年的一门新兴综合学科,其目的通过围术期多学科联合临床路径干预管理,改善并加速手术患者的术后康复[2]。为了达成这一目的,国际ERAS学会从2012年底开始,陆续发布了一系列ERAS指南,主要针对择期直肠/盆腔手术[3]、择期结肠手术[4]、胰十二指肠切除术[5]、根治性膀胱癌切除术[6]、胃(部分)切除术[7]、胃肠道手术[8]和妇科常规/肿瘤手术[9]等7类腹盆部大手术(按指南发布时间先后排序)。对于这一类手术,术后镇痛的目标包括:减轻疼痛、促进早期下地活动、促进胃肠道功能恢复和降低并发症发生率等。因此,在这7部ERAS指南中无一例外都提到了规范化术后多模式镇痛的重要性以及具体实施的方式、方法和药物选择。本文主要针对这7部ERAS指南中术后镇痛的基础方案、辅助镇痛方式和辅助镇痛药物的选择等分别进行汇总,以便医护人员在围术期更好地实施规范化术后多模式镇痛治疗,加速患者术后康复。
基础镇痛方案选择
胸段硬膜外镇痛是腹盆部大手术术后镇痛的“基石”与“金标准”。尽管因为不同ERAS指南中所参考的证据级别不同,胸段硬膜外镇痛对于择期直肠/盆腔手术、择期结肠手术、胰十二指肠切除术、胃(部分)切除术、胃肠道手术和妇科常规手术等类型的开腹手术方式都是首选推荐的术后基础镇痛方案(表1)。术后1~3日,硬膜外应用低浓度局麻药物(或联用小剂量阿片类药物)可以显著改善上述开腹手术患者的术后康复进程。
直肠/盆腔手术可能会涉及到会阴部手术切口,术后疼痛强度大,其原因与盆腔会阴部神经损伤密切相关;因此,此类患者通常需要同时联用腰段硬膜外镇痛。胰十二指肠切除术患者术后应用胸段硬膜外镇痛需要警惕吻合口瘘的风险,其原因可能与胸段硬膜外阻断交感神经,低血压导致肠道缺血有关。妇科肿瘤开腹手术范围广、创伤大,单纯应用胸段硬膜外镇痛无法完全满足患者术后镇痛需求,因此多数情况需要应用全身性阿片类药物镇痛治疗或二者联合应用。
胸段硬膜外镇痛的主要局限性:穿刺难度大、失败率高。由于胸椎解剖结构特点,胸段硬膜外穿刺的难度显著高于腰段硬膜外穿刺。另一方面,由于硬膜外置管的位置具有随机性,因此即使穿刺成功、置管顺利,也会出现术后镇痛不足的情况。因此,应用胸段硬膜外镇痛技术,需要在术前或术后患者清醒后及时判断是否有明确的阻滞范围和镇痛效果,并根据具体情况制定后续的治疗计划。此外,胸段硬膜外镇痛还可能出现运动阻滞、尿潴留、皮肤瘙痒等并发症,严重时亦可限制其临床应用。
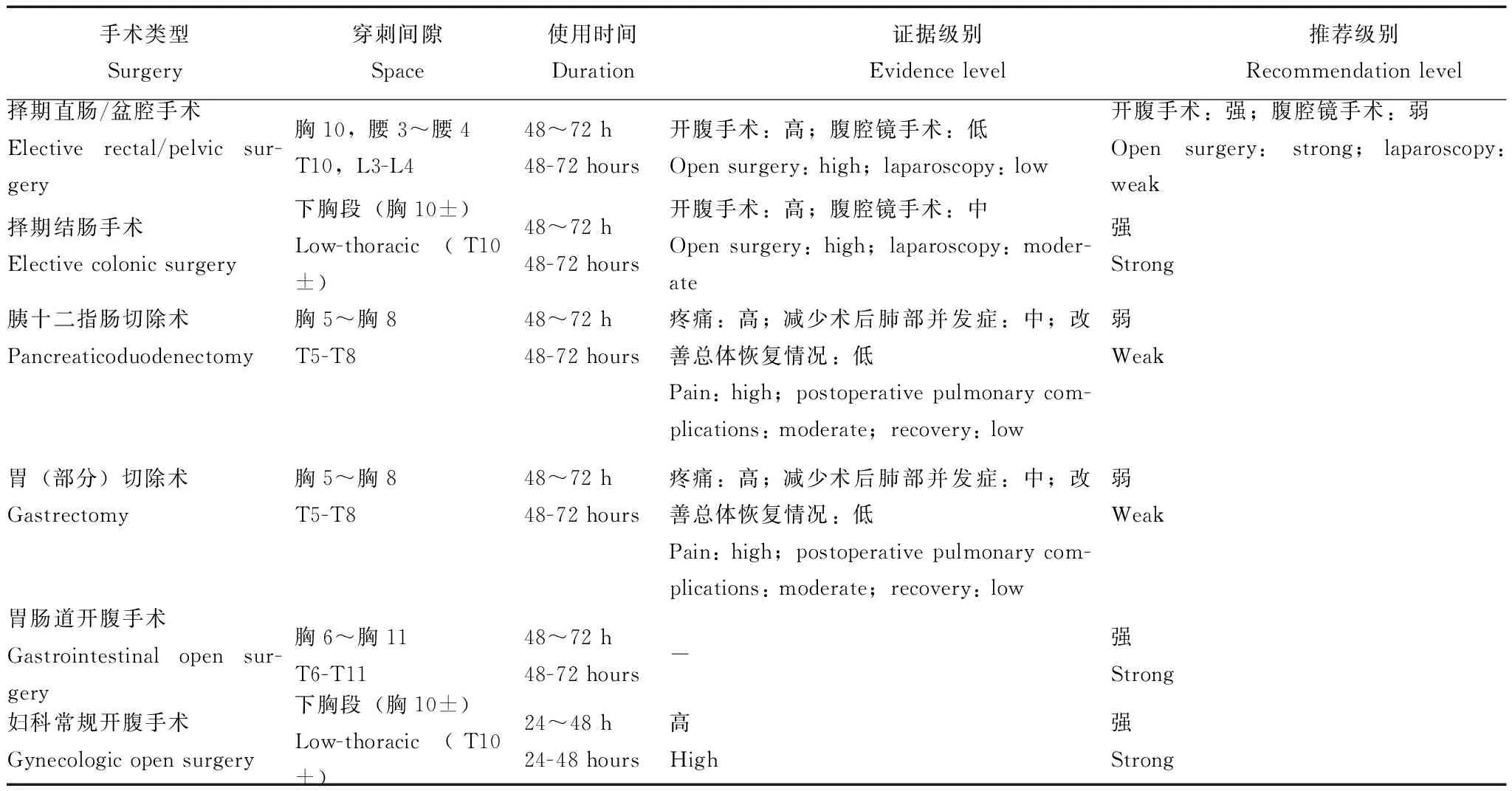
表 1 腹盆部手术胸段硬膜外镇痛Table 1 Thoracic epidural analgesia for abdominal and pelvic surgery
辅助镇痛方式选择
腹横肌平面阻滞腹横肌平面(transversus abdominis plane,TAP)阻滞通过阻滞下段胸神经(T7-T12)和第一腰神经(L1)的前支,对其支配的前腹壁皮肤、肌肉和壁层腹膜产生一定的镇痛效果。随着超声引导下穿刺技术和置管连续阻滞技术的进步,TAP阻滞在临床麻醉与镇痛中的应用日益普及。TAP阻滞的优势主要体现在操作安全简单、并发症少、对运动和肠蠕动影响小等方面。
在这7部ERAS指南中都不同程度地提到单次或连续术后TAP阻滞可以显著减少全身性阿片类药物的用量,减少硬膜外镇痛药物的用量(表2)。尤其在结肠、胃肠道和妇科常规等类型的腹腔镜手术患者中,TAP阻滞甚至可以单独用于患者的术后镇痛。但是,TAP阻滞无法减轻内脏性疼痛,因此,对于腹腔内手术创伤大、合并严重术后内脏性疼痛的患者,需要接受全身性阿片类药物或其他方式的镇痛治疗。对于开腹手术患者,目前尚缺乏证据支持TAP阻滞单独应用是否可以取代胸段硬膜外镇痛或全身性阿片类药物镇痛方式,因此,目前主要作为辅助手段应用于此类手术的麻醉与术后镇痛。
在胃肠道手术ERAS指南中术后TAP阻滞推荐方案为:单次注射15 ml局麻药物;单侧置管持续输注0.2%罗哌卡因(8~10 ml/h)48~72 h;亦可双侧置管持续输注0.2%罗哌卡因(8~10 ml/h)用于腹部中线附近的切口镇痛。
手术切口周围局部浸润麻醉手术切口局部浸润麻醉可以在切皮前、缝皮后单次注射局麻药物和/或术后切口周围置管持续注射低浓度局麻药物(如0.2%罗哌卡因等)。多数腹盆部开腹手术患者都已证实手术切口周围局部浸润麻醉可以有效减轻手术切口痛、减少术后全身性阿片类药物的用量,也未发现其增加切口感染的风险。然而,由于现有临床研究在局麻药物注射位置、时间点、药物浓度、置管位置等方面的差异,因此尚缺乏高质量证据的支持。此外,由于手术切口局部浸润麻醉亦无法减轻内脏性疼痛,故而也仅用于辅助胸段硬膜外镇痛或全身性阿片类药物镇痛治疗。
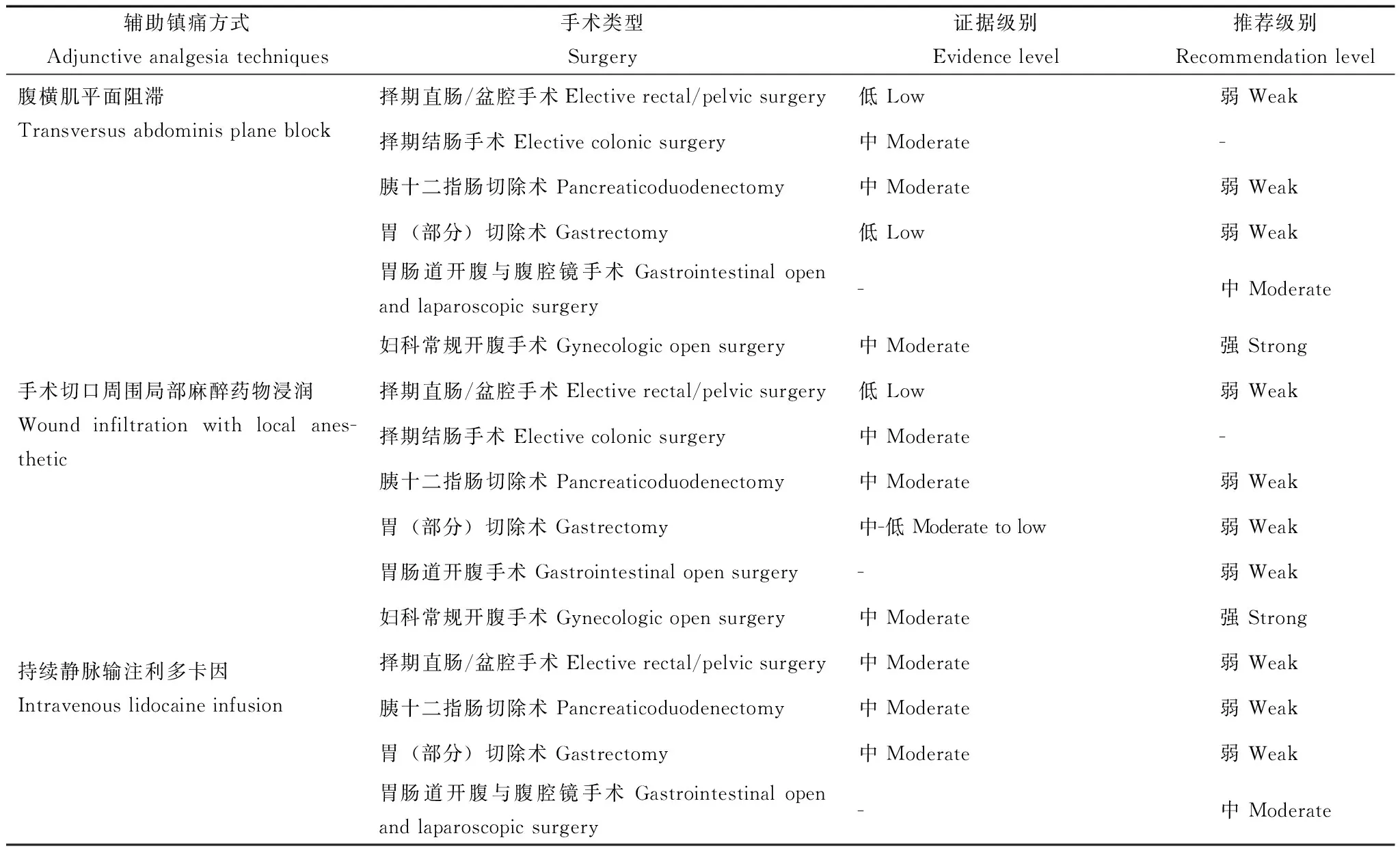
表 2 辅助镇痛方式Table 2 Adjunctive analgesia techniques
在胃肠道手术ERAS指南中持续手术切口周围局部浸润麻醉推荐方案为:腹膜外置管,持续输注0.2%罗哌卡因(10 ml/h)48~72 h。
持续静脉输注利多卡因利多卡因的多重作用机制使其具有镇痛、抗炎、减轻痛觉超敏等临床效果。持续静脉输注利多卡因在癌性疼痛和慢性疼痛的治疗中,尤其治疗中枢性神经病理性疼痛具有一定的作用。2010年,McCarthy等[10]系统回顾了静脉输注利多卡因在术后急性疼痛方面的临床研究,证实利多卡因可以显著减少腹部手术后全身性阿片类药物的用量,改善术后镇痛效果。
在胃肠道手术ERAS指南中持续静脉输注利多卡因推荐方案为:诱导前30 min内静脉注射负荷量利多卡因1.5 mg/kg(理想体重),术中持续输注维持量利多卡因2 mg/(kg·h)(理想体重)至手术结束或至麻醉后恢复室出室前,注射期间持续心电监护。
辅助镇痛药物联合应用
辅助镇痛药物联合应用是规范化术后多模式镇痛治疗的主要组成部分,其目的在于减少术后全身性阿片药物或硬膜外镇痛药物的用量;因此,选择药物时需要考虑到:与阿片类药物的协同作用、药物不良反应、对慢性疼痛的预防作用等多个方面。择期直肠/盆腔手术、择期结肠手术、根治性膀胱癌切除术、胃肠道手术和妇科常规/肿瘤手术等5部ERAS指南都指出,将对乙酰氨基酚和非甾体类抗炎药(non-steroidal antiinflammatory drugs,NSAIDs)/环氧化物酶- 2(cyclooxygenase- 2,COX- 2)抑制剂单独或联合应用于术后镇痛治疗,可以显著减少阿片类药物的用量,减轻术后恶心呕吐,加速术后康复(表3)。
胰十二指肠切除术和胃(部分)切除术等2部ERAS指南未给出上述药物的推荐意见,主要可能与这些药物多数需要口服给药,以及NSAIDs和COX- 2抑制剂对上消化道的潜在不良反应有关。此外,个别ERAS指南提示布洛芬、双氯芬酸钠、塞来昔布等药物可能会增加术后肠吻合口瘘的风险;胃肠道手术ERAS指南也提到了NSAIDs和COX- 2抑制剂的潜在心血管事件风险,但目前的证据支持在心血管事件低风险患者中短期应用是相对安全的。
妇科常规/肿瘤手术ERAS指南指出,围术期应用加巴喷丁可以有效减轻术后疼痛、减少阿片类药物用量及其不良反应。加巴喷丁的作用机制为抑制突触前神经元钙离子通道α2δ亚基,继而抑制兴奋性神经递质的释放,减轻痛觉传递中的外周敏化与中枢敏化。Clarke等[11]系统回顾了加巴喷丁用于术后镇痛的相关研究,提示其可显著降低术后慢性疼痛的发生率,改善患者术后功能。然而,围术期应用加巴喷丁治疗的最佳时机和剂量尚需进一步研究进行验证。
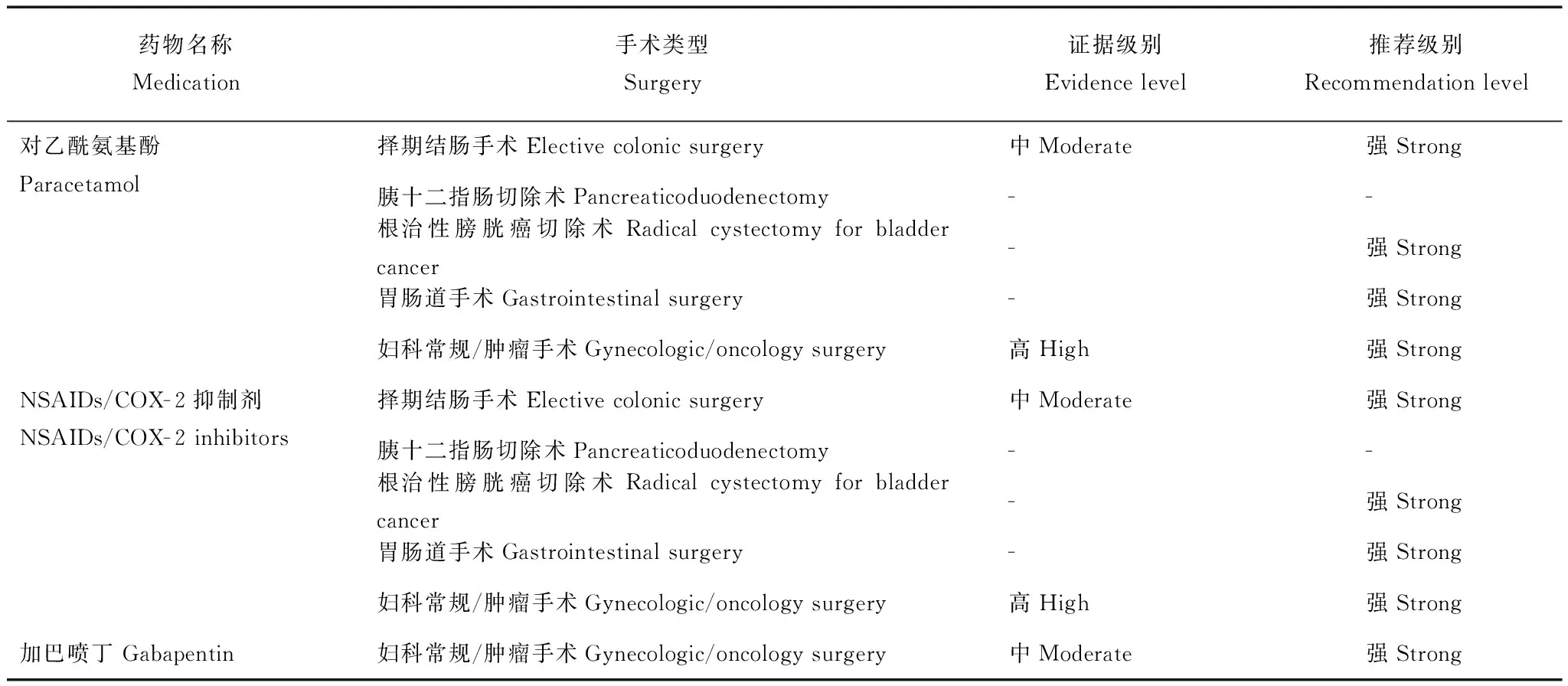
表 3 辅助镇痛药物Table 3 Adjunctive analgesics
NSAIDs:非甾体类抗炎药;COX- 2:环氧化物酶- 2
NSAIDs:non-steroidal antiinflammatory drugs;COX- 2: cyclooxygenase- 2
传统观念认为,术后镇痛药物的选择应遵循“降阶梯”原则,即术后早期选用强效阿片类药物进行治疗,之后逐渐过渡为弱阿片类药物、对乙酰氨基酚、NSAIDs或COX- 2抑制剂的顺序。但是,现有的临床证据和ERAS指南均提倡术后早期即开始联合应用多种药物达到减少全身性阿片类药物用量的效果。由于对乙酰氨基酚、NSAIDs、COX- 2抑制剂、加巴喷丁、普瑞巴林等药物多为口服给药,因此,应在外科情况允许下尽早开始口服这些辅助药物,而且目前已经有对乙酰氨基酚、帕瑞昔布等药物的静脉注射制剂,可以实现术后早期全程覆盖。
规范化术后多模式镇痛治疗
自上世纪90年代患者自控镇痛术引入中国以来,手术患者的术后镇痛质量得到显著提升,阿片类药物也一直发挥重要作用。然而,随着近年来对阿片类药物的深入研究,以及ERAS理念的不断实践,围术期通过多模式镇痛,尽量减少全身性阿片类药物的用量,已经成为广泛的共识。Chapman等[12]对比美国与欧洲术后镇痛的效果发现,美国患者术后镇痛的阿片类药物用量显著高于欧洲患者,但美国患者对于术后镇痛的满意度却显著低于欧洲患者,因此,术后镇痛的效果并不取决于阿片类药物的用量。
影响阿片类药物临床应用的最主要原因还是阿片类药物相关不良反应(opioid-related adverse events,ORAE)。由于阿片受体在机体内的广泛分布,导致其发挥镇痛作用的同时可能出现恶心、呕吐、便秘、肠梗阻、呼吸抑制、皮肤瘙痒、黏膜水肿等ORAE。全身性应用阿片类药物ORAE的总体发生率在10%~20%,而且一旦发生ORAE,患者的住院时间、医疗费用和再次入院率都会显著延长或增加。围术期应用阿片类药物还会影响患者的长期预后,Lennon等[13]在动物实验中已经证实,μ阿片受体活化会促进肿瘤细胞的生长,Maher等[14]的回顾性研究提示围术期应用阿片类药物是非小细胞肺癌术后5年复发的独立危险因素之一。
综上,规范化术后多模式镇痛治疗方案需要从以下3方面综合考虑。首先,胸段硬膜外镇痛是开腹手术的最佳基础镇痛方案,但对于存在椎管内麻醉禁忌证的患者或者硬膜外镇痛效果不足时,全身性阿片类药物镇痛将作为备选方案加以替代或弥补。其次,TAP阻滞、手术切口周围局部浸润麻醉等区域麻醉可以有效减轻腹盆部手术后的切口痛,但二者无法控制内脏性疼痛,因此,主要用于辅助胸段硬膜外镇痛或全身性阿片类药物镇痛,用以减少椎管内药物或全身性阿片类药物的用量,降低相应并发症和不良反应的发生率。再次,对乙酰氨基酚、NSAIDs、COX- 2抑制剂、加巴喷丁等可以与阿片类药物共同作用,达到减少阿片类药物用量、改善镇痛效果的目的。因此,国际ERAS学会这7部腹盆部手术指南在近年来各方面临床证据的基础上,一致提出通过多部位、多方法、多药物联合应用实现的多模式镇痛在ERAS中将发挥重要作用。
[1]Rawal N. Current issues in postoperative pain management[J]. Eur J Anaesthesiol,2016,33(3):160- 171.
[2]ERAS Society Official Website[OL].[2016- 02- 26]. www.erassociety.org.
[3]Nygren J,Thacker J,Carli F,et al. Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations[J]. Clin Nutr,2012,31(6):801- 816.
[4]Gustafsson UO,Scott MJ,Schwenk W,et al. Guidelines for perioperative care in elective colonic surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations[J]. Clin Nutr,2012,31(6):783- 800.
[5]Lassen K,Coolsen MM,Slim K,et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations[J]. World J Surg,2013,37(2):240- 258.
[6]Cerantola Y,Valerio M,Persson B,et al. Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS®) society recommendations[J].Clin Nutr,2013,32(6):879- 887.
[7]Mortensen K,Nilsson M,Slim K,et al. Consensus guidelines for enhanced recovery after gastrectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations[J]. Br J Surg,2014,101(10):1209- 1229.
[8]Feldheiser A,Aziz O,Baldini G,et al. Enhanced Recovery After Surgery (ERAS) for gastrointestinal surgery,part 2: consensus statement for anaesthesia practice[J]. Acta Anaesthesiol Scand,2016,60(3):289- 334.
[9]Nelson G,Altman AD,Nick A,et al. Guidelines for postoperative care in gynecologic/oncology surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations-Part Ⅱ [J]. Gynecol Oncol,2016,140(2):323- 332.
[10]McCarthy GC,Megalla SA,Habib AS. Impact of intravenous lidocaine infusion on postoperative analgesia and recovery from surgery: a systematic review of randomized controlled trials [J]. Drugs,2010,70(9): 1149- 1163.
[11]Clarke H,Bonin RP,Orser BA,et al. The prevention of chronic postsurgical pain using gabapentin and pregabalin: a combined systematic review and meta-analysis [J]. Anesth Analg,2012,115(2):428- 442.
[12]Chapman CR,Stevens DA,Lipman AG.Quality of postoperative pain management in American versus European institutions [J].J Pain Palliat Care Pharmacother,2013,27(4):350- 358.
[13]Lennon FE,Mirzapoiazova T,Mambetsariev B,et al. Overexpression of the μ-opioid receptor in human non-small cell lung cancer promotes Akt and mTOR activation,tumor growth,and metastasis [J].Anesthesiology,2012,116(4):857- 867.
[14]Maher DP,Wong W,White PF,et al. Association of increased postoperative opioid administration with non-small-cell lung cancer recurrence: a retrospective analysis[J].Br J Anaesth,2014,113 (Suppl 1):i88-i94.
Role of Postoperative Multimodal Analgesia in Abdominal and Pelvic Enhanced Recovery after Surgery
SHEN Le,HUANG Yu-guang
Department of Anesthesiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
HUANG Yu-guangTel: 010- 69152058,E-mail: garybeijing@163.com
Enhanced recovery after surgery (ERAS) is to achieve early recovery for patients undergoing major surgery through multimodal perioperative care pathways. Treatment of postoperative pain is of great importance for ERAS. From 2012 to now,the ERAS Society has published seven international guidelines for the abdominal or pelvic surgeries. Each of these guidelines recommended a standardized postoperative multimodal analgesia protocol to improve pain relief and postoperative recovery. Upon these guidelines,thoracic epidural analgesia should be the primary choice for postoperative analgesia of either abdominal and pelvic surgeries. Meanwhile,postoperative multimodal analgesia should contain multiple methods and drugs. In this review,we ellucidate the recommendations on postoperative multimodal analgesia from these seven ERAS guidelines,so as to facilitate the implementation of standardized postoperative multimodal analgesia.
enhanced recovery after surgery;postoperative multimodal analgesia;guideline
国家自然科学基金(31070930、81200869)Supported by the National Natural Sciences Foundation of China (31070930,81200869)
黄宇光电话:010- 69152058,电子邮件:garybeijing@163.com
R614.1
A
1000- 503X(2016)04- 0458- 06
10.3881/j.issn.1000- 503X.2016.04.016
2016- 04- 07)

