miR- 125a- 5p对胰腺癌细胞增殖、凋亡和细胞周期的影响
贾丛伟,孙 洋,张婷婷,卢朝辉,陈 杰
中国医学科学院 北京协和医学院 北京协和医院病理科,北京 100730
·论著·
miR- 125a- 5p对胰腺癌细胞增殖、凋亡和细胞周期的影响
贾丛伟,孙洋,张婷婷,卢朝辉,陈杰
中国医学科学院北京协和医学院北京协和医院病理科,北京 100730
目的探讨miR- 125a- 5p对胰腺癌细胞增殖、凋亡和细胞周期的影响。方法荧光定量PCR检测胰腺癌组织中miR- 125a- 5p的表达水平,细胞计数试剂盒- 8检测下调miR- 125a- 5p水平对胰腺癌细胞生长的影响,流式细胞术检测下调miR- 125a- 5p表达水平对胰腺癌细胞周期和凋亡的影响,软琼脂集落形成实验评价miR- 125a- 5p在胰腺癌细胞恶性转化过程中的作用。结果miR- 125a- 5p在胰腺癌组织的表达高于癌旁正常组织(P<0.05)。下调miR- 125a- 5p表达水平后,胰腺癌细胞系Panc- 1和MIA PaCa- 2的生长受到抑制(P<0.05),早期凋亡率分别增加13.6%和11.0%(P<0.05),细胞集落数目分别下降27.3%和27.8% (P<0.05),Panc- 1细胞S期细胞百分比降低11.8% (P<0.05)。结论miR- 125a- 5p在胰腺癌组织中高表达,下调miR- 125a- 5p表达水平使胰腺癌细胞生长受到抑制,集落形成能力下降,细胞周期受到阻滞,凋亡比例增加,提示miR- 125a- 5p在胰腺癌中发挥癌基因的作用。
胰腺癌;miR- 125a- 5p;癌基因
ActaAcadMedSin,2016,38(4):415-421
胰腺癌是一种恶性程度高、预后极差的消化系统恶性肿瘤。2015年统计数据显示,在美国,胰腺癌分别位居男性、女性肿瘤发病率的第11位和第8位,而其死亡率却均高居第4位[1]。微小RNA(microRNA,miRNA)是一类长18~25个核苷酸的非编码单链小RNA分子。成熟的miRNA通过与靶基因mRNA分子的3’端非编码区域完全或不完全互补配对,降解靶基因mRNA或抑制其转录后翻译导致靶基因的转录后沉默[2],参与多种生命活动,与肿瘤的发生有着密切的关系[3- 4]。miR- 125a- 5p是近年受到广泛关注的一个miRNA,其在肺癌、胃癌、食管癌等疾病中的作用机制已经日渐明朗[5- 6]。到目前为止,还极少有miR- 125a- 5p在胰腺癌中研究的相关报道。本研究探讨miR- 125a- 5p对胰腺癌细胞增殖、凋亡和细胞周期的影响。
材料和方法
材料10对胰腺癌及癌旁新鲜组织取自2010年7月至2013年5月北京协和医院手术切除标本,液氮中冰冻保存。4株胰腺癌细胞系Panc- 1、MIA PaCa- 2、BxPC- 3和AsPC- 1均购自美国模式培养物集存库。miR- 125a- 5p抑制剂是类似小干扰RNA的片段,由上海吉玛公司设计合成,其序列为5’-UCACAAGUUAG GGUCUCAGGGA- 3’。
细胞培养Panc- 1、MIA PaCa- 2和AsPC- 1培养于含10%胎牛血清的DMEM高糖培养基(Gibico,美国)中,BxPC- 3培养于含有10%的胎牛血清的1640培养基(Gibico,美国)中,37℃、5%CO2条件下培养,实验细胞均处于对数生长期。
转染将细胞分为3组,转染miR- 125a- 5p 抑制剂(100 nmol/L)的抑制剂组、转染无关序列(negative control,NC)(100 nmol/L)的阴性对照组和只加转染试剂的空白对照组,按lipo2000(Invitrogen,美国)说明书进行转染,4~6 h更换为完全培养基,转染24 h后提取RNA。
荧光定量PCR检测miR- 125a- 5p表达水平使用Trizol试剂(Invitrogen,美国)提取组织和细胞的总RNA,超纯水(无RNA酶、DNA酶)溶解,检测浓度和纯度。使用Taqman microRNA RT Kit(ABI,美国),以管家基因U6作为内参,用miR- 125a- 5p引物逆转录成cDNA(逆转录引物序列:5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCACAGGTT- 3’)。使用SYBR®Green PCR Master Mix(ABI,美国)作为核酸染料,配制好反应体系:cDNA 1 μl,上游引物(5 μmol/L)2 μl,下游引物(5 μmol/L)2 μl,SYBR Green PCR Master mix 10 μl,加ddH2O至20 μl。在ABI Stepone Plus实时荧光定量PCR仪上进行扩增(上游引物:5’-ACACTCCAGCTGGGTCCCTGAGACCCTTTAA- 3’;下游引物:5’-CTCAACTGGTGTCGTGGAGT- 3’),反应条件为:95℃ 10 min,95℃ 15 s、60℃ 1 min(40个循环);记录循环阈值(cycle threshold,Ct),采用2-△△Ct方法,比较样品间的表达差异。
细胞计数试剂盒- 8检测细胞活性Panc- 1、MIA PaCa- 2细胞系分组同前,转染后以约3000个/孔的密度接种于96孔板,分别于转染24、48、72 h后更换为含10%细胞计数试剂盒- 8的培养基,然后再置于37℃、5% CO2条件下培养1.5 h,酶标仪检测波长450 nm的光密度值。
碘化丙啶单染检测细胞周期Panc- 1和MIA PaCa- 2细胞系分组同前,转染后以2×105个/孔的密度接种于6孔板,转染72 h后用4℃磷酸盐缓冲液清洗,胰酶消化,收集细胞至离心管中,加入70%冰乙醇固定,4℃过夜,4℃ 800×g离心后弃上清,4℃磷酸盐缓冲液清洗,于400 μl结合缓冲液中重悬,加入50 μl RNA酶(Sigma,美国)37℃孵育30 min,避光加入50 μl碘化丙啶(propidium iodide,PI)(50 μg/ml)(Sigma,美国),室温避光孵育30 min,流式细胞仪检测细胞(FACSAriaⅡ,BD,美国)周期。
膜联蛋白Ⅴ-异硫氰酸荧光素/PI双染法检测细胞凋亡率按PI单染操作步骤收集细胞至离心管,离心后弃上清,4℃磷酸盐缓冲液清洗,按膜联蛋白V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)凋亡检测试剂盒Ⅰ(BD,美国)说明进行操作,将细胞重悬于500 μl结合缓冲液中,避光各加入5 μl异硫氰酸荧光素和PI,混匀,室温避光孵育15 min,流式细胞仪(C6,BD,美国)检测细胞凋亡率。
软琼脂集落形成实验Panc- 1、MIA PaCa- 2细胞系设阴性对照组和抑制剂组,首先将下层软琼脂培养液(10%胎牛血清+0.5%软琼脂溶液+1×DMEM培养基)铺于6孔板,放入4℃冰箱,凝固后,转入37℃培养箱。转染24 h后,以1×104/L的细胞密度加入上层软琼脂培养液中(10%胎牛血清+0.35%软琼脂溶液+1×DMEM培养基),混合均匀后加入铺有下层软琼脂的6孔板中。37℃、5% CO2培养箱中培养14 d,每孔加入200 μl噻唑蓝溶液(5 mg/ml),继续培养过夜,显微镜下观察集落形成情况,计数。
统计学处理采用SPSS 17.0软件对数据进行统计分析,t检验及方差分析结果,P<0.05为差异有统计学意义。
结 果
miR- 125a- 5p在胰腺癌组织及细胞系中的表达10例胰腺癌标本的基本资料见表1。荧光定量PCR结果显示miR- 125a- 5p在胰腺癌组织中的相对表达量明显高于癌旁组织,差异有统计学意义(t=6.42,P=0.000)(图1)。同时,miR- 125a- 5p在4种胰腺癌细胞系(AsPC- 1、BxPC- 3、MIA PaCa- 2、Panc- 1)中的相对表达水平均高于正常胰腺组织(设正常胰腺组织为1,4个细胞系分别为AsPC- 1=1.37、BxPC- 3=1.61、MIA PaCa- 2=1.46、Panc- 1=1.41)(t=8.81,P=0.003)。
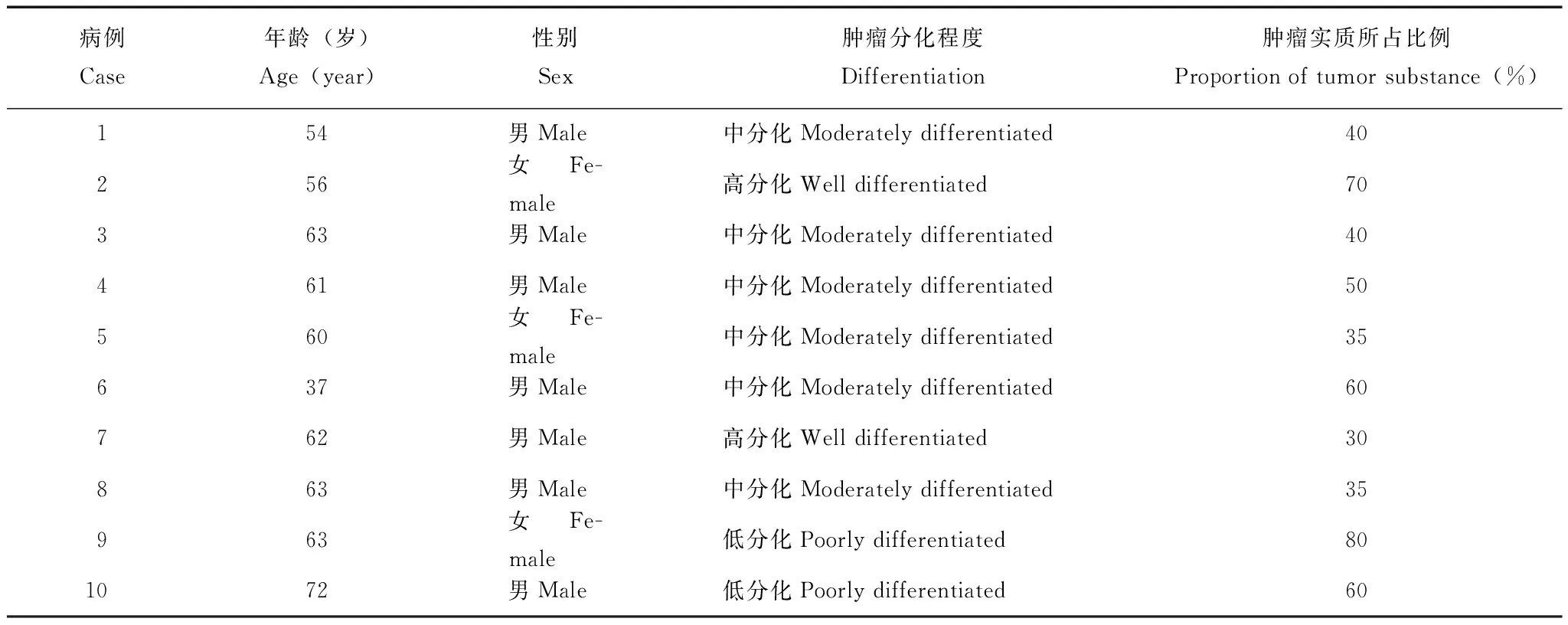
表 1 10例胰腺癌标本的基本资料Table 1 General information of 10 patients with pancreatic ductal adenocarcinoma
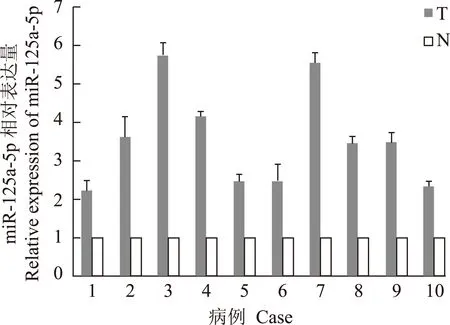
图 1miR- 125a- 5p在胰腺癌组织(T)和癌旁组织(N)中的相对表达量
Fig 1The relative expression of miR- 125a- 5p in pancreatic ductal adenocarcinoma tissues(T) and adjacent normal tissues(N)
转染miR- 125a- 5p抑制剂对胰腺癌细胞系的生长、增殖的影响细胞计数试剂盒- 8结果显示,Panc- 1细胞中抑制剂组的24、48、72 h数值分别为0.370、0.502、1.083;MIA PaCa- 2细胞中抑制剂组的24、48、72 h数值分别为0.542、0.681、1.198。相对空白对照组和阴性对照组,转染miR- 125a- 5p 抑制剂后,Panc- 1和MIA PaCa- 2细胞在转染24 h后生长开始受到抑制,并随着培养时间延长,抑制作用进一步增大,培养72 h时抑制作用最大,差异具有统计学意义(P<0.05)(图2)。
转染miR- 125a- 5p抑制剂对胰腺癌细胞系凋亡的影响膜联蛋白V-异硫氰酸荧光素/PI双染流式细胞学结果显示,转染miR- 125a- 5p 抑制剂 72 h后,Panc- 1
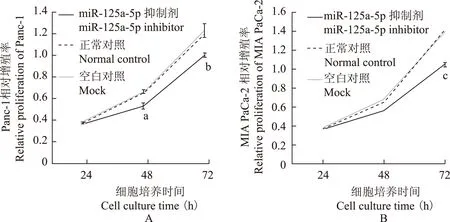
与阴性对照和空白对照比较,aF=13.56,aP=0.02;bF=89.89,bP=0.00;cF=9.87,cP=0.04
aF=13.56,aP=0.02;bF=89.89,bP=0.00;cF=9.87,cP=0.04 compared with normal control and mock groups
图 2转染miR- 125a- 5p 抑制剂后各组Panc- 1(A)和MIA PaCa- 2(B)细胞的相对增殖数量
Fig 2Relative proliferation of Panc- 1(A) and MIA PaCa- 2(B) cell after transfection with the miR- 125a- 5p inhibitor
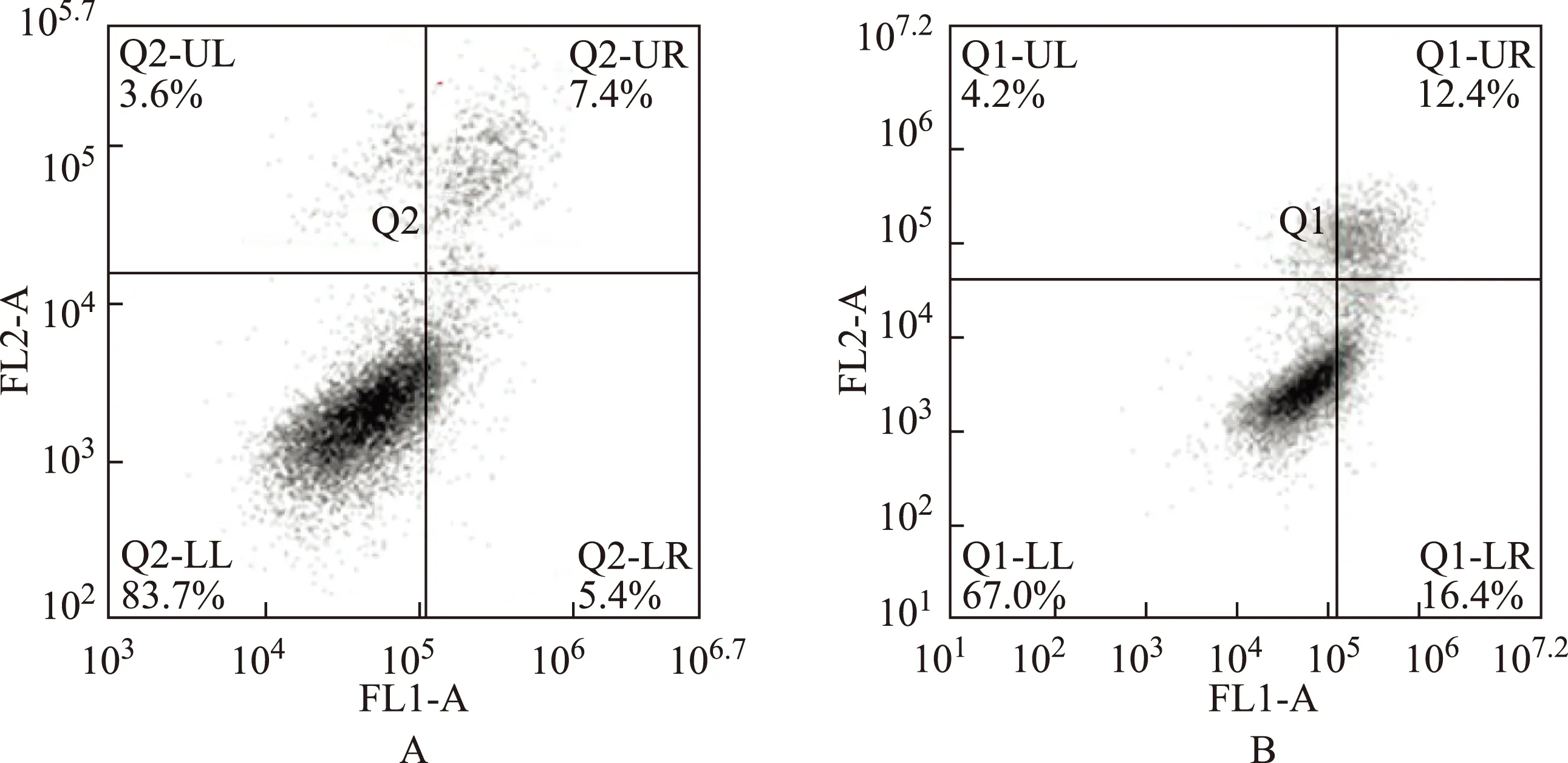
细胞中,阴性对照组和抑制剂组异硫氰酸荧光素单阳性细胞比例(即早期凋亡)分别是3.6%和17.2%;异硫氰酸荧光素、碘化丙啶双阳性细胞比例(即晚期凋亡)分别是5.0%和9.6%。与阴性对照组相比,Panc- 1细胞的早期凋亡率和晚期凋亡率分别升高了13.6 %和4.6 %(早期凋亡:χ2=8.99,P=0.00;晚期凋亡:χ2=1.80,P=0.18)(图3)。MIA PaCa- 2细胞中,阴性对照组和抑制剂组的早期凋亡率分别是5.4%和16.4%;晚期凋亡率分别是7.4%和12.4%。与阴性对照组相比,MIA PaCa- 2细胞的早期凋亡率和晚期凋亡率分别升高了11.0 %和5.0%(早期凋亡:χ2=6.44,P=0.01;晚期凋亡:χ2=1.45,P=0.23)(图4)。
转染miR- 125a- 5p抑制剂对胰腺癌细胞周期的影响转染miR- 125a- 5p 抑制剂后,Panc- 1细胞中抑制剂组、空白对照组和阴性对照组的S期细胞比例分别为28.2%、37.0%和40.0%,与空白对照组和阴性对照组相比,抑制剂组S期细胞的比例均明显下降(P<0.05)(图5),但MIA PaCa- 2细胞系在转染miR- 125a- 5p抑制剂后,抑制剂组、空白对照组和阴性对照组的S期细胞比例分别为26.1%、28.2%和26.0%,差异无统计学意义(图6)。
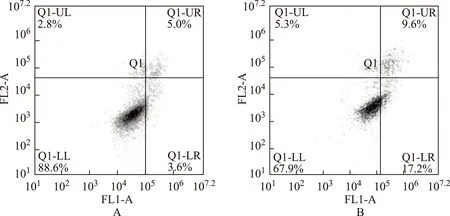
FL1-A:通道1-A,代表碘化丙啶染色;FL2-A:通道2-A,代表膜联蛋白V染色;Q1-UL:点数1-左上,为碎片及损伤细胞;Q1-UR:点数1-右上,为晚期凋亡及死亡细胞;Q1-LL:点数1-左下,为阴性对照的正常细胞;Q1-LR:点数1-右下,为早期凋亡细胞
FL1-A: flow 1-A,represents propidium iodide staining;FL2-A:flow 2-A,represents annexin V staining;Q1-UL:quantumdots 1-up left,are pieces and damaged cells;Q1-UR:quantumdots 1-up right,are late apoptosis and death cells;Q1-LL:quantumdots 1-low left,are negative control cells;Q1-LR:quantumdots 1-low right,are early apoptosis cells
A. 阴性对照组;B. miR- 125a- 5p抑制剂组
A. negative control group;B. miR- 125a- 5p inhibitor group
图 3转染miR- 125a- 5p抑制剂对Panc- 1细胞早期凋亡的影响
Fig 3Effect on the early apopotosis rate of Panc- 1 cell after transfection with the miR- 125a- 5p inhibitor
A.阴性对照组;B. miR- 125a- 5p抑制剂组
A. negative control group;B. miR- 125a- 5p inhibitor group
图 4转染miR- 125a- 5p抑制剂对MIA PaCa- 2细胞早期凋亡的影响
Fig 4Effect on the early apopotosis rate of MIA PaCa- 2 cell after transfection with the miR- 125a- 5p inhibitor
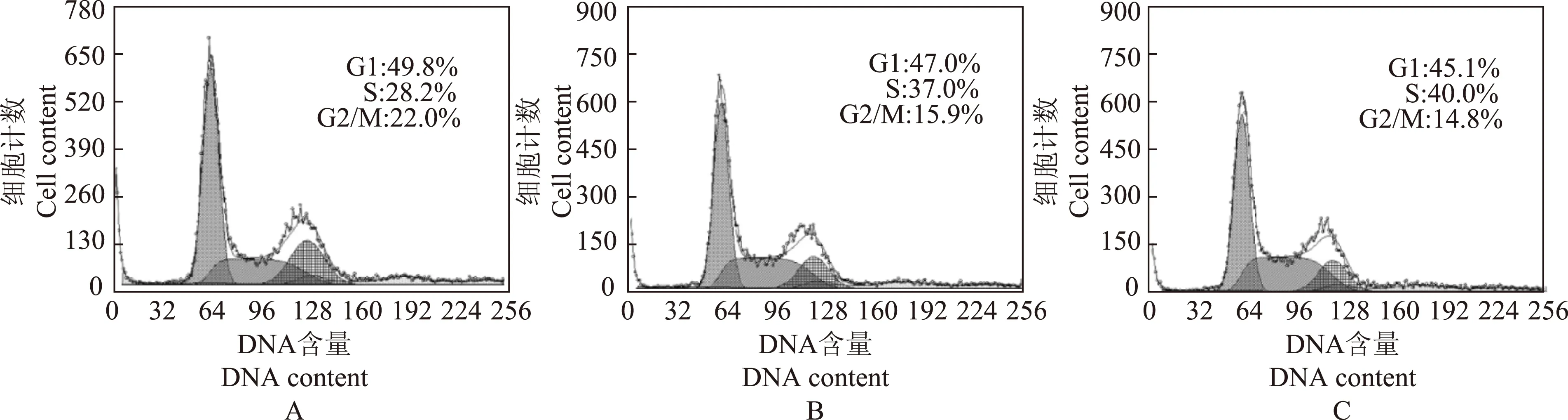
A.miR- 125a- 5p抑制剂;B. 空白对照;C. 阴性对照
A.miR- 125a- 5p inhibitor;B. mock;C.negative control
图 5转染miR- 125a- 5p抑制剂对Panc- 1细胞周期的影响
Fig 5Effect on the cell cycle of Panc- 1 after transfection with the miR- 125a- 5p inhibitor
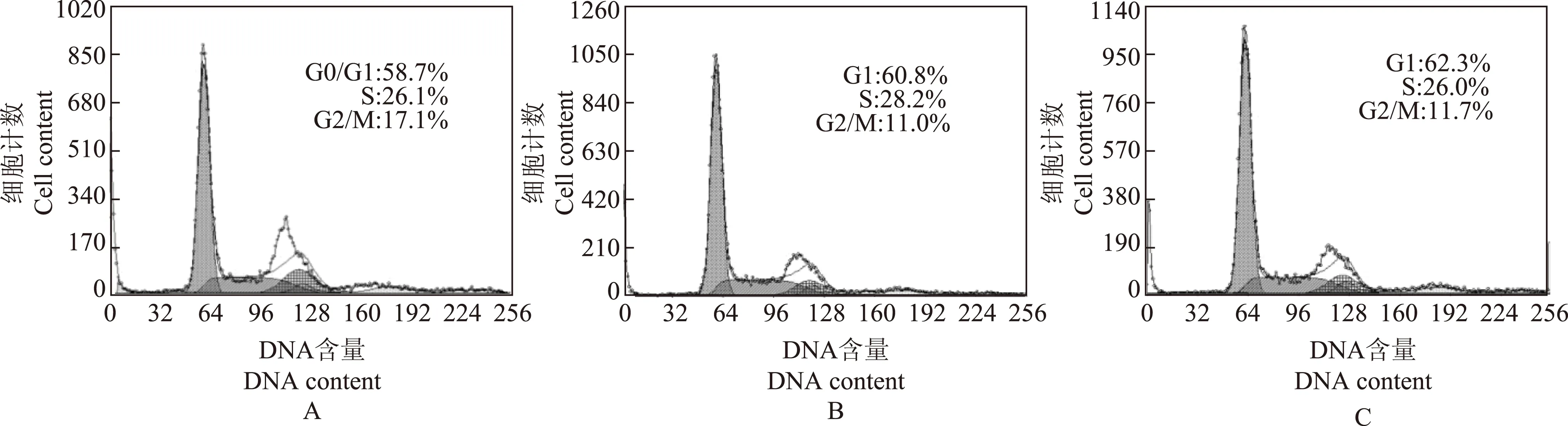
A. miR- 125a- 5p抑制剂;B. 空白对照;C. 阴性对照
A.miR- 125a- 5p inhibitor;B. mock;C.negative control
图 6转染miR- 125a- 5p抑制剂对MIA PaCa- 2细胞周期的影响
Fig 6Effect on the cell cycle of MIA PaCa- 2 after transfection with the miR- 125a- 5p inhibitor
转染miR- 125a- 5p抑制剂对胰腺癌细胞集落形成能力的影响转染miR- 125a- 5p 抑制剂后胰腺癌细胞的集落形成显著低于阴性对照组(图7、8)。统计数据显示,Panc- 1细胞中,抑制剂组和阴性对照组的集落数分别为(566±44)个和(778±25)个,转染miR- 125a- 5p 抑制剂对集落数目的抑制率为27.3%;MIA PaCa- 2细胞中,抑制剂组和阴性对照组的集落数分别为(323±35)个和(447±50)个,转染miR- 125a- 5p抑制剂对集落数目的抑制率为27.8%,差异均具有统计学意义(P<0.05)。

A. miR- 125a- 5p抑制剂组;B. 阴性对照组
A. miR- 125a- 5p inhibitor group;B. negative control group
图 7转染miR- 125a- 5p抑制剂对Panc- 1细胞集落形成能力的影响
Fig 7Effect on the colony formation ability of Panc- 1 cell after transfection with the miR- 125a- 5p inhibitor

A. miR- 125a- 5p抑制剂组;B. 阴性对照组
A. miR- 125a- 5p inhibitor group;B. negative control group
图 8转染miR- 125a- 5p抑制剂对MIA PaCa- 2细胞集落形成能力的影响
Fig 8Effect on the colony formation ability of MIA PaCa- 2 cell after transfection with the miR- 125a- 5p inhibitor
讨 论
胰腺癌是预后最差的恶性肿瘤之一,其相关分子机制研究具有重要临床意义。本研究小组长期从事胰腺癌分子机制的研究,已筛选出一些作为癌基因或抑癌基因参与胰腺癌发生、发展的miRNAs,并发现一些miRNAs的异常表达与诊断及预后相关。2007年,Bloomston等[7]用组织芯片筛查出miR- 125a在胰腺癌及胰腺炎组织中的表达高于正常胰腺组织,但未进一步研究其在胰腺癌发生发展中的作用机制。随后的研究报道,miR- 125a- 5p在胃癌[8]、乳腺癌[9]、肝癌[10]、肺癌[5]、结肠癌[11]等肿瘤中可抑制肿瘤的生长、浸润和转移,发挥抑癌基因的作用,在不同肿瘤中表达程度亦不相同,提示miR- 125a- 5p在不同肿瘤的发生发展过程中可能发挥不同的作用。为探讨miR- 125a- 5p在胰腺癌中的表达及作用,本研究从表达和功能方面进行研究。
首先,本研究收集10对胰腺癌及癌旁正常组织,提取总RNA,运用荧光定量PCR的方法检测miR- 125a- 5p的表达水平,结果显示miR- 125a- 5p在胰腺癌组织中的表达高于癌旁组织,这与Bloomston等[7]的芯片筛选结果一致。随后检测了4个胰腺癌细胞系(Panc- 1、MIA PaCa- 2、AsPC- 1和BxPC- 3)中miR- 125a- 5p的表达水平,发现4个胰腺癌细胞系miR- 125a- 5p的表达均高于癌旁正常组织。
为了解miR- 125a- 5p在胰腺癌中表达增高在胰腺癌发生发展中的作用,并更好地研究miR- 125a- 5p的功能,本研究首先使用细胞计数试剂盒- 8实验初步探讨miR- 125a- 5p与胰腺癌细胞增殖的关系,通过转染miR- 125a- 5p抑制剂下调miR- 125a- 5p的表达水平后,抑制剂组与空白对照组及阴性对照组相比,增殖率明显降低,表明下调miR- 125a- 5p的表达水平可抑制Panc- 1、MIA PaCa- 2两个细胞系的生长及增殖能力。
细胞计数试剂盒- 8反映的是活细胞数量变化情况,多种因素均可导致活细胞数量变化,包括影响细胞周期、促进凋亡等。研究证实miR- 125a- 5p下游有与凋亡及细胞周期相关的一些靶基因,包括Rock- 1基因、E2F3基因等,并发现表皮生长因子可以通过调节miR- 125a- 5p影响下游通路促进肿瘤生长[12]。为进一步探讨miR- 125a- 5p抑制剂抑制胰腺癌细胞生长、增殖的机制,本研究采用流式细胞术,使用膜联蛋白V-异硫氰酸荧光素/碘化丙啶双染法检测细胞凋亡,碘化丙啶单染法检测细胞周期。结果显示转染miR- 125a- 5p 抑制剂 72 h后,与阴性对照组相比,抑制剂组Panc- 1和MIA PaCa- 2早期凋亡和晚期凋亡的细胞比例均升高;与空白对照组和阴性对照组相比,Panc- 1的S期细胞比例明显降低,而在MIA PaCa- 2细胞系中,细胞周期各期的比例却未发生变化。两个细胞系产生不一样的结果可能与细胞背景不同有关。以上结果提示下调miR- 125a- 5p表达水平抑制细胞生长、增殖的功能,部分通过促进细胞凋亡实现,部分通过影响细胞周期,引起G0/G1期阻滞实现。
每个miRNA都有多个靶基因,miRNA最终体现出的功能是多个靶基因间形成复杂网络综合作用的结果,因此miRNA对肿瘤的影响也是多方面的。为研究miR- 125a- 5p除影响增殖外,是否影响肿瘤细胞的集落形成能力,本研究进一步通过软琼脂集落形成实验检测miR- 125a- 5p在胰腺癌细胞恶性转化中的作用。结果显示转染miR- 125a- 5p 抑制剂的两种胰腺癌细胞Panc- 1和MIA PaCa- 2形成的集落数目显著低于阴性对照组,差异均具有统计学意义。下调miR- 125a- 5p的表达水平可以抑制胰腺癌细胞的集落形成能力,表明miR- 125a- 5p可以通过增加胰腺癌细胞集落形成能力促进胰腺癌的恶性转化。
综上,本研究揭示了miR- 125a- 5p在胰腺癌发生发展中的部分作用机制,提示在胰腺癌中异常高表达的miR- 125a- 5p可能通过影响细胞周期、抑制细胞凋亡,促进胰腺癌细胞生长、增殖;并通过增加胰腺癌细胞集落形成能力,促进胰腺癌恶性转化。这些结果显示miR- 125a- 5p在胰腺癌发生发展过程中通过多种途径发挥癌基因的作用,miR- 125a- 5p有可能成为胰腺癌的治疗靶点。
[1]Siegel RL,Miller KD,Jemal A. Cancer statistics,2015 [J]. CA Cancer J Clin,2015,65(1):5- 29.
[2]Bartel DP. MicroRNAs: genomics,biogenesis,mechanism,and function [J]. Cell,2004,116(2):281- 297.
[3]Zhang W,Dolan ME. The emerging role of microRNAs in drug responses [J]. Curr Opin Mol Ther,2010,12(6):695- 702.
[4]Rederstorff M,Huttenhofer A. Small non-coding RNAs in disease development and host-pathogen interactions [J]. Curr Opin Mol Ther,2010,12(6):684- 694.
[5]Zhu WY,Luo B,An JY,et al. Differential expression of miR- 125a- 5p and let- 7e predicts the progression and prognosis of non-small cell lung cancer [J]. Cancer Invest,2014,32(8):394- 401.
[6]Fassan M,Pizzi M,Realdon S,et al. The HER2-miR125a5p/ miR125b loop in gastric and esophageal carcinogenesis [J]. Hum Pathol,2013,44(9):1804- 1810.
[7]Bloomston M,Frankel WL,Petrocca F,et al. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis [J]. JAMA,2007,297(17):1901- 1908.
[8]Hashiguchi Y,Nishida N,Mimori K,et al. Down-regulation of miR- 125a- 3p in human gastric cancer and its clinicopathological significance [J]. Int J Oncol,2012,40(5):1477- 1482.
[9]Hsieh TH,Hsu CY,Tsai CF,et al. miR- 125a- 5p is a prognostic biomarker that targets HDAC4 to suppress breast tumorigenesis [J]. Oncotarget,2015,6(1):494- 509.
[10]Zheng J,Zhou Z,Xu Z,et al. Serum microRNA- 125a- 5p,a useful biomarker in liver diseases,correlates with disease progression [J].Mol Med Rep,2015,12(1):1584- 1590.
[11]Tong Z,Liu N,Lin L,et al. miR- 125a- 5p inhibits cell proliferation and induces apoptosis in colon cancer via targeting BCL2,BCL2L12 and MCL1 [J]. Biomed Pharmacother,2015,75:129- 136.
[12]Xu Y,Huang Z,Liu Y.Reduced miR- 125a- 5p expression is associated with gastric carcinogenesis through the targeting of E2F3[J].Mol Med Rep, 2014,10(5):2601- 2608.
Effects of miR- 125a- 5p on Cell Proliferation,Apoptosis and Cell Cycle of Pancreatic Cancer Cells
JIA Cong-wei,SUN Yang,ZHANG Ting-ting,LU Zhao-hui,CHEN Jie
Department of Pathology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
CHEN JieTel: 010- 69155389,E-mail: xhblk@163.com
ObjectiveTo investigate the effects of miR- 125a- 5p on cell proliferation,apoptosis and cell cycle of pancreatic cancer cells.MethodsThe expression level of miR- 125a- 5p in pancreatic cancer was determined using quantitative real-time polymerase chain reaction analysis in 4 pairs of pancreatic cancer tissues and matched adjacent normal tissues samples. The expression of miR- 125a- 5p was downregulated in pancreatic cancer cell lines by transfection with miR- 125a- 5p inhibitor. Cell counting kit- 8 assays was conducted to detect the growth ability of pancreatic cancer cell lines. Flow cytometry was applied to detect the cell cycle and apopotosis. Soft agar colony formation test was employed to assess the role of miR- 125a- 5p in process of malignant transformation.ResultsMiR- 125a- 5p was significantly highly expressed in pancreatic ductal adenocarcinoma tissues than adjacent normal tissues(P<0.05). After the expression level of miR- 125a- 5p in Panc- 1 and MIA PaCa- 2 was downregulated,the growth ability was suppressed(P<0.05),early apopotosis rate was promoted by 13.6% and 11.0% respectively(P<0.05),the amount of colony formation was reduced by 27.3% and 27.8%,respectively(P<0.05),and the percentage of S stage of Panc- 1 was reduced by 11.8% (P<0.05).ConclusionsThe expression of miR- 125a- 5p is high in pancreatic ductal adenocarcinoma tissues. After the expression level of miR- 125a- 5p is downregulated,the growth ability,colony formation,and cell cycle of Panc- 1 and MIA PaCa- 2 are suppressed,and the early apopotosis rate will be promoted. Therefore,miR- 125a- 5p may play an oncogenic role in pancreatic ductal adenocarcinoma.
pancreatic ductal adenocarcinoma;miR- 125a- 5p;oncogene
国家自然科学基金(30973470、81172334)Supported by the National Natural Sciences Foundation of China(30973470,81172334)
陈杰电话:010- 69155389,电子邮件: xhblk@163.com
R735.9
A
1000- 503X(2016)04- 0415- 07
10.3881/j.issn.1000- 503X.2016.04.009
2015- 08- 15)

