甲醛在有无苯作用下对细胞因子M-CSF、G-CSF和EPO转录的影响
袁朗月,问华肖,魏晨曦,杨 旭
(华中师范大学生命科学学院 遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
甲醛在有无苯作用下对细胞因子M-CSF、G-CSF和EPO转录的影响
袁朗月,问华肖,魏晨曦,杨旭
(华中师范大学生命科学学院 遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
研究了甲醛在有无苯作用下对3种细胞因子巨噬细胞集落刺激因子(M-CSF)、粒细胞集落刺激因子(G-CSF)和促红细胞生成素(EPO)转录水平的影响。将30只雄性BALA/c小鼠随机分成5组,设为空白对照组、玉米油对照组、苯染毒组、甲醛染毒组、苯与甲醛联合染毒组,每组6只,分别进行玉米油溶液、苯溶液灌胃染毒或甲醛气态吸入染毒;染毒时间模拟工厂工作时间,每天8 h,连续两周,第6 d、第7 d休息,第13 d染毒结束;取小鼠的骨髓和肾脏,提取其总RNA,并用实时荧光定量PCR技术对细胞因子M-CSF、G-CSF和EPO转录水平的变化进行检测。结果表明,甲醛单独作用可使M-CSF、G-CSF、EPO的转录水平下降;与苯联合后,苯加强了甲醛对M-CSF转录水平的影响、削弱了甲醛对G-CSF和EPO转录水平的影响。
甲醛;苯;M-CSF;G-CSF;EPO;转录水平;实时荧光定量PCR
苯和甲醛是人造建筑材料和家居用品中的高危险性空气污染物[1]。甲醛来源广、毒性大。1987年,美国环境保护署(EPA)将甲醛归为可能的人类致癌物(在浓度异常高或持续暴露的情况下)[2];2006年,国际癌症研究机构(IARC)将甲醛归为人类致癌物A1组(可引起鼻咽癌,并可能引起白血病);2009年9月,IARC将甲醛指定为人类已知的白血病诱因[3];2011年,国家毒理学项目(NTP)的科学公告会议也将甲醛确定为人类已知的白血病诱因[4]。许多有关甲醛与白血病关系的证据均来自流行病学调查,但各种流行病学调查结果的不一致及偶然性使得白血病与甲醛暴露有关遭到质疑,因此需要进一步研究甲醛对白血病的影响机制[5-7]。
白血病的可能发病机制:直接损害骨髓干细胞。而干细胞若要发生癌变,就需要发生基因突变和基因组的不稳定[8]。骨髓位于大骨骼的腔体中,含有造血干细胞以及多种其它干细胞。造血是干细胞增殖、分化及成熟为血细胞的动态平衡过程。诸多因素均可调控此过程,最为重要的是细胞因子(一种可以传递细胞增殖分化信号的分泌蛋白)的调控,不仅可以刺激成熟血细胞行使功能,还可调节造血干细胞的增殖、分化及成熟[9]。作者在此选取3种细胞因子M-CSF、G-CSF和EPO作为研究对象,研究甲醛在有无苯作用下对其转录水平的影响。
1 实验
1.1实验动物
BALA/c小鼠,雄性,体重22 g左右,购于武汉大学动物实验中心。
1.2试剂与仪器
甲醛溶液(质量分数10%),Sigma公司;苯(分析纯),国药集团化学试剂有限公司;RNAiso Plus(总RNA提取试剂)、Oligo(dT)12-18 Primer、Reverse Transcriptase M-MLV(RNase H-)、dNTP Mixture、RNase Inhibitor、SYBR®Premix Ex TaqTM(Perfect Real Time),宝生物工程(大连)有限公司。
WH-2型智能环境气候舱,武汉宇信科技开发公司;4160-2型气态甲醛浓度测定仪,美国Interscan公司;5415R型低温冷冻离心机,德国Eppendorf公司;ND-1000、CFX96型荧光定量PCR仪,美国BIO-RAD公司。
1.3方法
1.3.1实验动物分组
将30只小鼠随机分成5组:空白对照组、玉米油对照组、苯染毒组、甲醛染毒组、苯与甲醛联合染毒组,每组6只。每天分别对5组小鼠进行称重,然后采用仿真式暴露染毒。
具体染毒过程:
1)空白对照组:每天在输入新鲜空气的玻璃缸内待8 h。
2)玉米油对照组:每天上午,在相同的时间以浓度为150 mg·kg-1的玉米油进行灌胃染毒。
3)苯染毒组:每天上午,在相同的时间以浓度为150 mg·kg-1的苯溶液进行灌胃染毒。
4)甲醛染毒组:每天连续动态染毒8 h(在玻璃染毒缸中进行),经智能环境气候舱调配后,甲醛以浓度为3.0 mg·m-3(我国2000年前相关职业卫生标准规定的工作场所最高允许浓度)的气体持续稳定地输出。舱参数为:气体湿度45%,气温(23±0.5) ℃,过舱气体流量1 L·min-1。
5)苯与甲醛联合染毒组:按3)、4)方法进行苯与甲醛联合染毒。
染毒期间,所有小鼠禁止进食和饮水。
1.3.2总RNA的提取
1)骨髓和肾脏的处理:染毒结束(第13 d)后将小鼠脱颈处死,取出股骨,用注射器吸取1 mL RNAiso Plus,将骨髓冲入EP管中(反复多次,直至股骨变白),颠倒混匀10下,22 ℃静置15 min,待溶液透明后马上置于冰上,然后可于-70 ℃长期保存。染毒结束(第13 d)后将小鼠脱颈处死,取出肾脏,加液氮研成粉末,加1 mL RNAiso Plus覆盖,液氮溶解后将液体吸入EP管中,颠倒混匀10下,22 ℃静置15 min,待溶液透明后马上置于冰上,然后可于-70 ℃长期保存。
2)提取总RNA:在上述装有骨髓和肾脏的EP管中加入1/5体积的氯仿,颠倒混匀10下,剧烈振荡15 s,22 ℃静置5 min后于4 ℃、12 000 r·min-1离心15 min;将上层水相转入另一EP管中,重复上述操作;加等体积异丙醇,混匀,在低温冰上放置10 min,于4 ℃、12 000×g离心10 min;小心弃上清,加预冷的80%乙醇(用DEPC水配制)1 mL,轻颠倒,于4 ℃、1 000 r·min-1离心5 min;弃上清,EP管口向下在滤纸上尽量吸干管口乙醇;平放EP管,空气干燥5~10 min,溶于20 μL DEPC水中,用紫外分光光度计测定总RNA的浓度和纯度,重复测定3次。OD260和OD280之间的比值应该在1.9~2.0之间。
1.3.3引物设计
由Primer 5.0软件设计并用NCBI的Primer-Blast检测。引物序列如下:
M-CSF:上游TTCCATCCTCACCCTTAGAC,下游TTCTGCTCCTTCTCATCTGTCCTGG;EPO:上游GAATGGAGGTGGAAGAACAGG,下游ACCCGAAGCAGTGAAGTGAG;G-CSF:上游GGGA-AGGAGATGGGTAAAT,下游GCTGCCACTGTT-TCTTTAGGGACTT;β-actin:上游GCATTGTTACCAACTGGGACG,下游TGGCTGGGGTGTTGAAGG。
1.3.4将RNA反转录成cDNA
配制20 μL反转录体系:取Oligo(dT) 2 μL、总RNA 1 μg,加DEPC水至12 μL,点离,70 ℃变性10 min,立即冰浴5 min,继续加入5×M-MLV Buffer 4 μL、dNTP Mixture 1 μL、RRI 0.5 μL、 M-MLV 0.5 μL,加DEPC水至20 μL,42 ℃保温1 h,75 ℃保温15 min,然后于4 ℃保存。
1.3.5实时荧光定量PCR
采用DNA荧光染料SYBR Green I对M-CSF、G-CSF和EPO进行实时荧光定量PCR。反应体系:上下游引物0.4 μL,模板1 μL,SYBR®Premix Ex TaqTM10 μL,RNase Free水8.24 μL。模板分别设有内参组和样品组,每个样品设3个重复。通过预实验,摸索出3种细胞因子的实时荧光定量PCR退火温度T。实时荧光定量PCR反应程序如下:95 ℃预变性30 s;95 ℃变性5 s,T温度退火30 s,72 ℃延伸30 s,荧光检测,共39个循环。绘制3种细胞因子的融解曲线。实验结果用2-△△Ct表示,即3种细胞因子在实验组的表达量是对照组的2-△△Ct倍,△△Ct是指实验组与对照组的△Ct之差,△Ct=Ct样品组-Ct内参组(Ct值为每个反应管内开始指数扩增时对应的循环数)。
1.4统计学分析
用2-△△Ct进行定量分析,用Origin软件进行统计学分析。采用T检验和单因素方差分析检验不同组间数据的差异显著性,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果与讨论
2.1M-CSF的转录水平变化
经过处理后,骨髓细胞中的M-CSF的转录水平变化如图1所示。
由图1可知:(1)相对空白对照组:苯染毒组M-CSF的转录水平有下降趋势,但无显著性(P>0.05);甲醛染毒组M-CSF的转录水平极显著下降(P<0.01);联合染毒组M-CSF的转录水平极显著下降(P<0.01)。(2)相对联合染毒组:苯染毒组M-CSF的转录水平极显著上升(P<0.01);甲醛染毒组M-CSF的转录水平有上升趋势,但无显著性(P>0.05)。表明,甲醛单独作用可使M-CSF的转录水平下降,与苯联合后,苯加强了甲醛对M-CSF转录水平的影响。
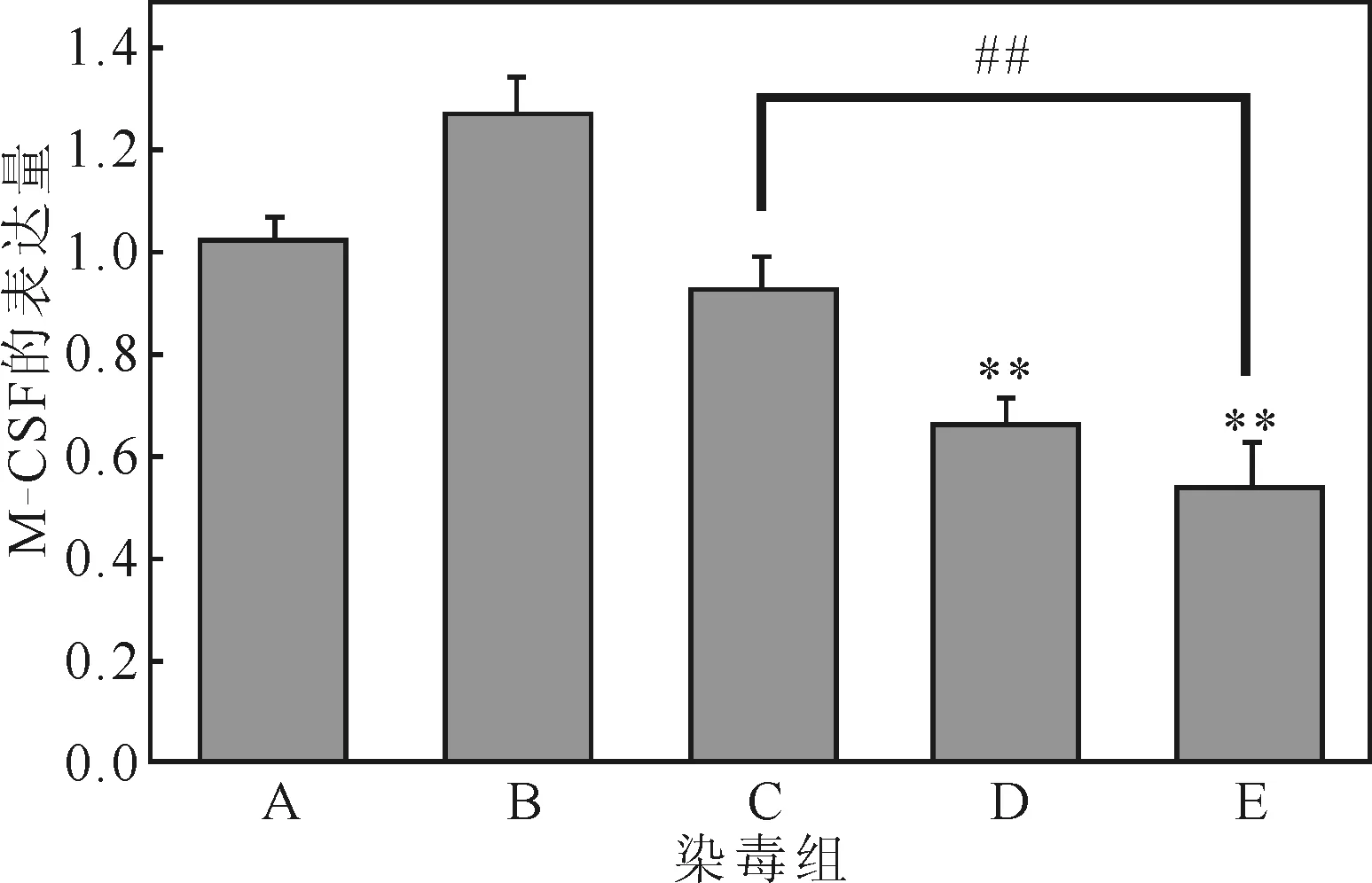
A.空白对照组 B.玉米油对照组 C.苯染毒组 D.甲醛染毒组 E.苯与甲醛联合染毒组 **:与空白组对照,P<0.01 ##:与联合组对照,P<0.01
2.2G-CSF的转录水平变化
经过处理后,骨髓细胞中的G-CSF的转录水平变化如图 2所示。
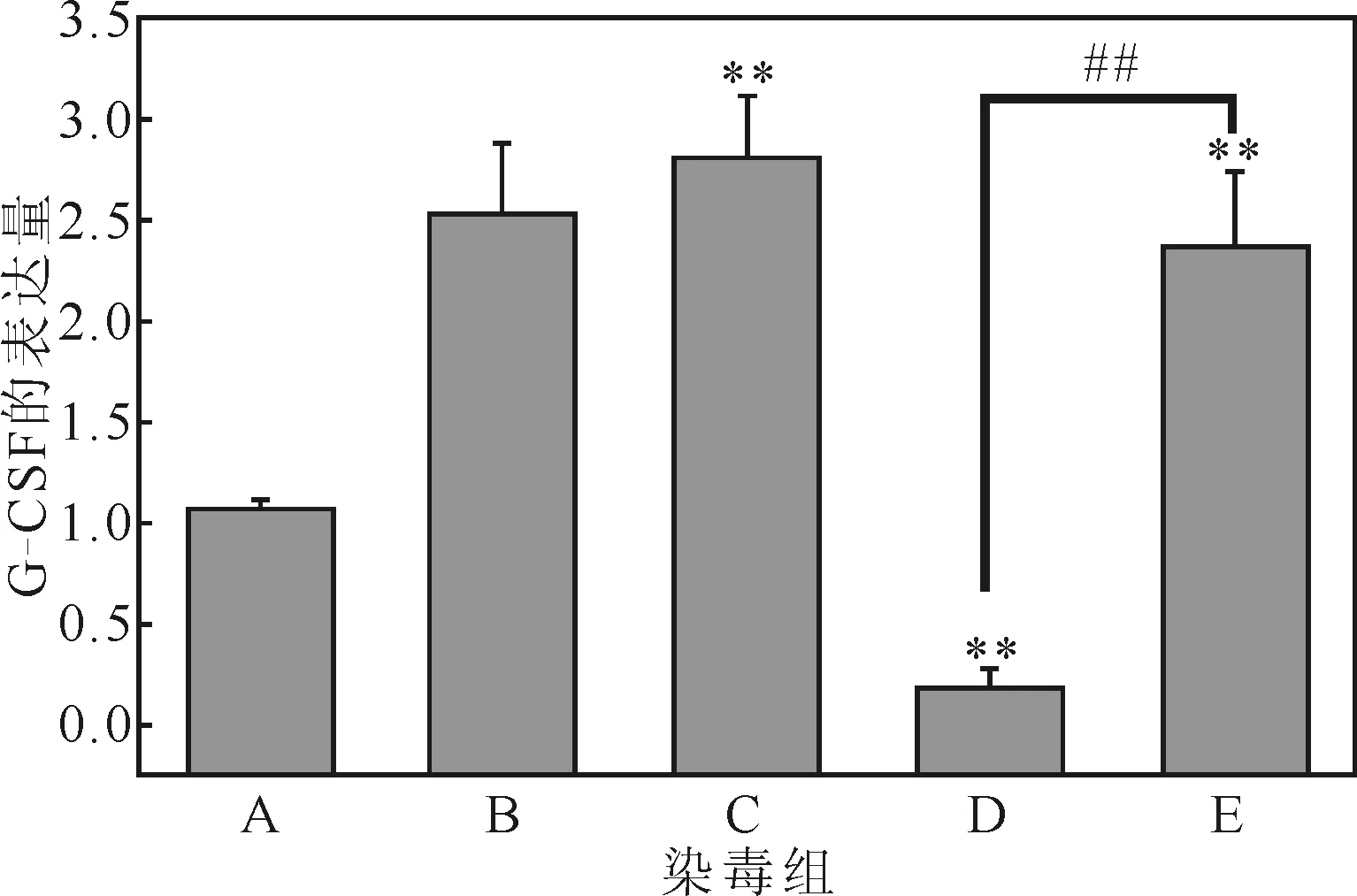
A.空白对照组 B.玉米油对照组 C.苯染毒组 D.甲醛染毒组 E.苯与甲醛联合染毒组 **:与空白组对照,P<0.01 ##:与联合组对照,P<0.01
由图 2 可知:(1) 相对空白对照组:苯染毒组G-CSF的转录水平极显著上升(P<0.01);甲醛染毒组G-CSF的转录水平极显著下降(P<0.01) ;联合染毒组G-CSF的转录水平极显著上升。(2)相对联合染毒组:苯染毒组G-CSF的转录水平有上升趋势,但无显著性(P>0.05);甲醛染毒组G-CSF的转录水平极显著下降(P<0.01)。表明,甲醛单独作用可使G-CSF的转录水平下降,与苯联合后,苯削弱了甲醛对G-CSF转录水平的影响。
2.3EPO的转录水平变化
经过处理后,肾脏中EPO的转录水平变化如图3所示。
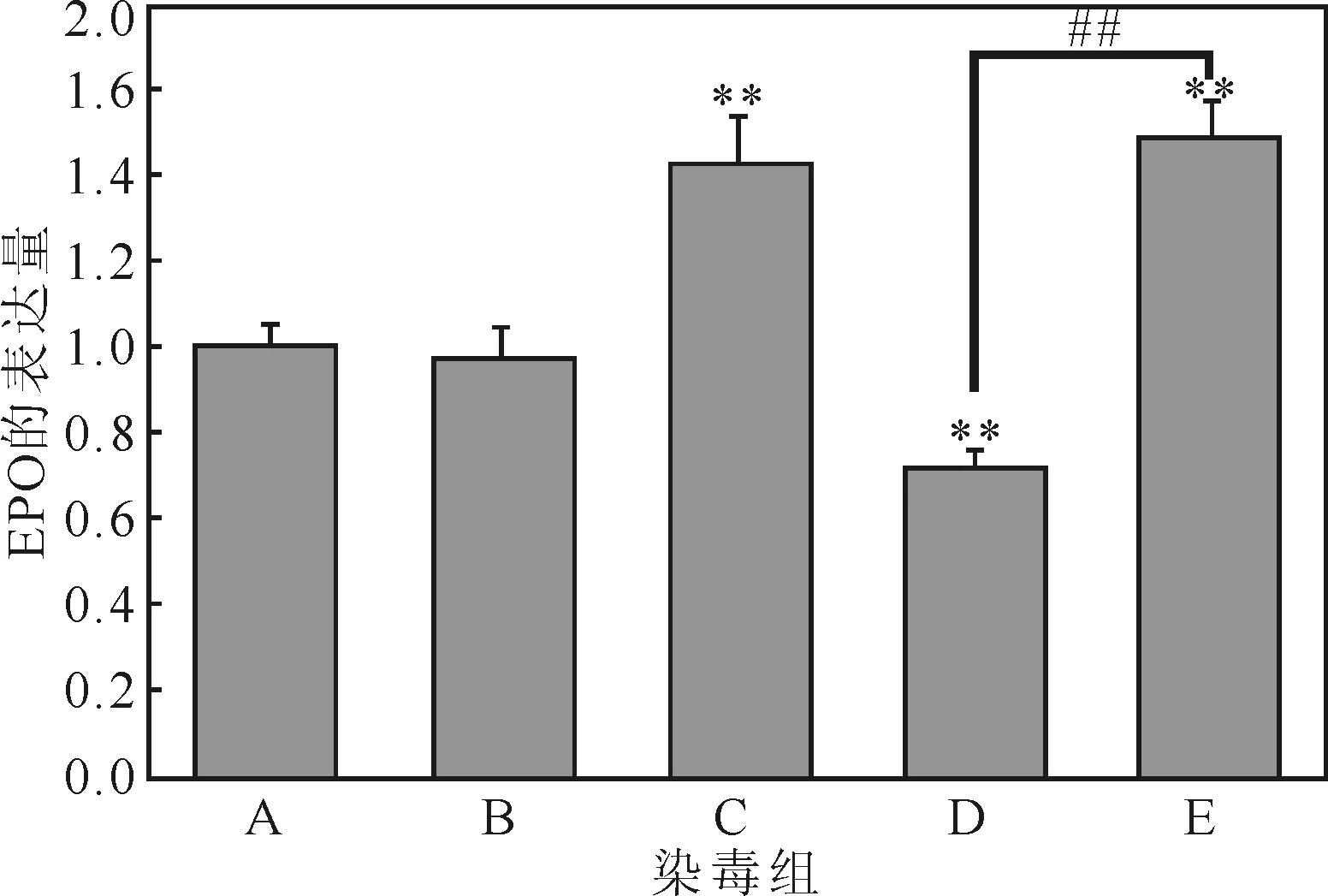
A.空白对照组 B.玉米油对照组 C.苯染毒组 D.甲醛染毒组 E.苯与甲醛联合染毒组 **:与空白组对照,P<0.01 ##:与联合组对照,P<0.01
由图 3 可知:(1) 相对空白对照组:苯染毒组EPO的转录水平极显著上升(P<0.01);甲醛染毒组EPO的转录水平极显著下降(P<0.01) ;联合染毒组EPO的转录水平极显著上升。(2)相对联合染毒组:苯染毒组EPO的转录水平有下降趋势,但无显著性(P>0.05);甲醛染毒组EPO的转录水平极显著下降(P<0.01)。表明,甲醛单独作用可使EPO的转录水平下降,与苯联合后,苯削弱了甲醛对EPO转录水平的影响。
2.4讨论
流行病学和实验数据均显示甲醛可导致白血病,尤其是骨髓性的白血病,然而其致病机理却不清楚[6]。氧化应激被认为是甲醛可能引发损伤的一种机制[10],多项研究表明,ROS(尤其是H2O2)的产生在甲醛引起的毒性中扮演重要角色[11-12]。H2O2可打开MPTP(线粒体通透性转换孔),降低基因转录、翻译的活度,从而减少细胞凋亡[13-14]。由此可以解释甲醛单独作用时M-CSF、G-CSF和EPO的转录水平下降。
Wei等[15]通过miRNA的表达谱法研究苯暴露对小鼠造血作用的影响,将C57BL/6小鼠暴露于浓度为150 mg·kg-1的苯中,结果发现,苯暴露可使小鼠的白细胞、红细胞、淋巴细胞的数量减少。本研究中,苯的暴露浓度为150 mg·kg-1,因而小鼠的白细胞、红细胞、粒细胞、淋巴细胞的数量较空白对照组应降低。
G-CSF能刺激骨髓粒细胞前体,使之分化增殖为成熟粒细胞的集落[16-17]。EPO主要通过促进骨髓中红系祖细胞的存活、增殖和分化以调控红细胞的生成[18]。本研究中,在苯作用下,G-CSF和EPO的转录水平上升可能是机体反馈调节的作用所致。
Andrews等[19]研究表明,甲醛作为苯的代谢竞争抑制剂,可以降低苯的代谢和毒性。本研究中,甲醛与苯联合作用后,苯削弱了甲醛对G-CSF和EPO转录水平的影响,可能是因为甲醛是苯的代谢竞争抑制剂。然而对于M-CSF的转录水平变化,甲醛与苯联合作用后,苯却加强了甲醛对M-CSF的转录水平的影响。这可能是因为,苯具有高挥发性,实验操作时因挥发使其浓度降低,Wetmore等[20]研究表明,在低浓度时,苯可以加强甲醛对小鼠的代谢和基因毒性,这也是本研究中苯可以加强甲醛对M-CSF转录水平的影响的原因。
3 结论
研究了甲醛在有无苯作用下对巨噬细胞集落刺激因子(M-CSF)、粒细胞集落刺激因子(G-CSF)和促红细胞生成素(EPO)等3种细胞因子转录水平的影响。结果表明,甲醛单独作用可使M-CSF的转录水平下降;与苯联合后,苯加强了甲醛对M-CSF转录水平的影响、削弱了甲醛对G-CSF和EPO的转录水平的影响。
[1]张娟.苯、甲醛联合暴露致白血病危险性及关键代谢酶功能SNPs的研究[D].南京:东南大学,2009.
[2]ZHANG L P,FREEMAN L E,NAKAMURA J,et al.Formaldehyde and leukemia:epidemiology,potential mechanisms,and implications for risk assessment[J].Environmental and Molecular Mutagenesis,2010,51(3):181-191.
[3]ZHANG L P,TANG X J,ROTHMAN N,et al.Occupational exposure to formaldehyde,hematotoxicity,and leukemia-specific chr-omosome changes in cultured myeloid progenitor cells [J].Cancer Epidemiol Biomarkers Prev,2010,19(1):80-88.
[4]McMARTIN K E,RICHARDSON D B,AKBAR-KHAZADEH F,et al.Formaldehyde expert panel report:Part B:recommendation for listing status for formaldehyde and scientific justification for the recommendation[R].Carcinogens:NIEHS,Research Triangle Park,NC,2009.
[5]COLE P,AXTEN C.Formaldehyde and leukemia:an improbable causal relationship[J].Regulatory Toxicology and Pharmacology,2004,40(2):107-112.
[6]SCHWILK E,ZHANG L M,SMITH A H,et al.Formaldehyde and leukemia:an updated meta-analysis and evaluation of bias[J].Journal of Occupational and Environmental Medicine,2010,52(9):878-886.
[7]SPEIT G,GELBKE H P,PALLAPIES D,et al.Occupational exposure to formaldehyde,hematotoxicity,and leukemia-specific chr-omosome changes in cultured myeloid progenitor cells[J].Cancer Epidemiology Biomarkers & Prevention,2010,19(9):1882-1884.
[8]TANG X J,BAI Y,DUONG A,et al.Formaldehyde in China:production,consumption,exposure levels,and health effects[J].Environment International,2009,35(8):1210-1224.
[9]姚尔固.细胞因子在造血系统疾病中的临床应用[J].医学进修杂志,2000,23(11):1-3.
[10]ZHOU D X,QIU S D,ZHANG J,et al.The protective effect of vitamin E against oxidative damage caused by formaldehyde in the testes of adult rats[J].Asian Journal of Andrology,2006,8(5):584-588.
[11]YE X,JI Z Y,WEI C X,et al.Inhaled formaldehyde induces DNA-protein crosslinks and oxidative stress in bone marrow and other distant organs of exposed mice[J].Environmental and Molecular Mutagenesis,2013,54(9):705-718.
[12]LIN Z X,LUO W H,LI H,et al.The effect of endogenous formaldehyde on the rat aorta endothelial cells[J].Toxicology Letters,2005,159(2):134-143.
[13]KIM D S,JEON S E,JEONG Y M,et al.Hydrogen peroxide is a mediator of indole-3-acetic acid/horseradish peroxidase-induced apoptosis[J].FEBS Letters,2006,580(5):1439-1446.
[14]GREEN D R,REED J C.Mitochondria and apoptosis[J].Science,1998,281(5381):1309-1312.
[15]WEI H Y,ZHANG J,TAN K H,et al.Benzene-induced aberrant miRNA expression profile in hematopoietic progenitor cells in C57BL/6 mice[J].Molecular Sciences,2015,16(11):27058-27071.
[16]林桂真,陈美莲,黄仁魏,等.粒细胞集落刺激因子应用后骨髓粒系统细胞形态学改变及其临床意义[J].广东医学,2005,26(4):487-488.
[17]马玉杰,梁辉.粒细胞集落刺激因子与血液病[J].中国组织工程研究与临床康复,2009,13(14):2755-2758.
[18]李北冰,杨莹,侯晓薇.促红素的研究综述[J].黑龙江医药, 2010,23(4):594-596.
[19]ANDREWS L S,LEE E W,WITMER C M,et al.Effects of toluene on the metabolism,disposition and hemopoietic toxicity of [3H]benzene[J].Biochemical Pharmacology,1997,26(4):293-300.
[20]WETMORE B A,STRUVE M F,GAO P,et al.Genotoxicity of intermittent co-exposure to benzene and toluene in male CD-1 mice[J].Chemico-Biological Interactions,2008,173(3):166-178.
Effect of Formaldehyde on Transcription of Cytokine M-CSF,G-CSF and EPO in the Presence and Absence of Benzene
YUAN Lang-yue,WEN Hua-xiao,WEI Chen-xi,YANG Xu
(HubeiKeyLaboratoryofGeneticRegulationandIntegrativeBiology,CollegeofLifeSciences,CentralChinaNormalUniversity,Wuhan430079,China)
Effectsofformaldehydeonthetranscriptionlevelofmacrophagecolonystimulatingfactor(M-CSF),granulocytecolonystimulatingfactor(G-CSF)anderythropoietin(EPO)inthepresenceandabsenceofbenzenewereinvestigated.ThirtyBALA/cmalemicewererandomlydividedinto5groups(6foreachgroup):blankcontrolgroup,cornoilcontrolgroup,benzeneexposuregroup,formaldehydeexposuregroup,benzeneassociatedwithformaldehydeexposuregroup.Andthemicewereexposedbyintragastricadministrationofcornoilsolutionorbenzenesolution,formaldehydegassuction,respectively.Exposuretimewassimulatedfactoryworkschedule,8hadayfortwoweeks,withanexposure-free“weekend”ondays6and7,sacrificedonday13.ThebonemarrowandkidneywerepreparedtoextracttotalRNA,thenreal-timefluorescencequantitativePCRtechniquewasappliedtotestthechangeoftranscriptionlevelforcytokineM-CSF,G-CSFandEPO.Resultsshowedthat,formaldehydealonecoulddecreasethetranscriptionlevelofM-CSF,G-CSFandEPO,whenformaldehydeassociatedwithbenzene,benzenecouldenhancetheinfluenceofformaldehydeontranscriptionlevelofM-CSF,weakentheinfluenceofformaldehydeontranscriptionlevelofG-CSFandEPO.
formaldehyde;benzene;M-CSF;G-CSF;EPO;transcriptionlevel;real-timefluorescencequantitativePCR
10.3969/j.issn.1672-5425.2016.08.007
国家自然科学基金资助项目(51136002)
2016-03-27
袁朗月(1989-),女,湖北武汉人,硕士研究生,研究方向:分子毒理学,E-mail:1048896082@qq.com;通讯作者:杨旭,教授,E-mail:yangxu@mail.ccnu.edu.cn。
R 994.6R 318
A
1672-5425(2016)08-0031-04
袁朗月,问华肖,魏晨曦,等.甲醛在有无苯作用下对细胞因子M-CSF、G-CSF和EPO转录的影响[J].化学与生物工程,2016,33(8):31-34,38.

