D-半乳糖与牛血清白蛋白相互作用的光谱分析
张怀斌,徐 畅,邢汝月
(滨州医学院药学院,山东 烟台 264003)
D-半乳糖与牛血清白蛋白相互作用的光谱分析
张怀斌,徐畅,邢汝月
(滨州医学院药学院,山东 烟台 264003)
用光谱法研究了D-半乳糖(D-Gal)与牛血清白蛋白(BSA)的相互作用。结果表明,随着D-Gal浓度的增大,BSA的荧光光谱发生猝灭,猝灭机制为静态猝灭,且BSA的最大发射峰蓝移;紫外吸收光谱和同步荧光光谱表明,D-Gal使BSA的疏水性增强,骨架变得松散;热力学分析表明,疏水作用力是D-Gal与BSA间的主要作用力。
D-半乳糖(D-Gal);牛血清白蛋白(BSA);光谱分析;疏水作用力
D-半乳糖(D-Gal)又叫氨基半乳糖,是维持体内正常生理活动的营养成分之一,在糖代谢中起重要作用,若过量会导致糖代谢紊乱。而且D-Gal在代谢过程中会产生超氧阴离子自由基,损伤多种生物大分子(如蛋白质、DNA)、改变细胞内基因的表达以及机体的调节系统、降低细胞转录水平[1],导致肝损伤等[2]。牛血清白蛋白(BSA)是体外实验中重要的模型蛋白[3-5]。作者研究D-Gal与BSA相互作用的光谱变化,以期为D-Gal在药理、药效方面的研究提供参考。
1 实验
1.1试剂与仪器
BSA(纯度>98%),北京奥博星生物有限公司;D-Gal,北京化工厂;其它试剂均为分析纯。Tris-HCl缓冲溶液0.1mol·L-1(pH=7.40,NaCl浓度0.05mol·L-1),BSA溶液的浓度为1.0×10-6mol·L-1;D-Gal水溶液的浓度为1.0×10-3mol·L-1。
LS-55型荧光光谱仪,美国PE公司;T1901型紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2方法
将BSA与不同浓度的D-Gal均匀混合,以285nm的光作为激发光,调节激发和发射狭缝宽度比为6∶8,在不同温度下测定BSA的荧光光谱;在190~300nm范围测定BSA的紫外吸收光谱。
2 结果与讨论
2.1D-Gal与BSA相互作用的荧光光谱
BSA的荧光主要来源于色氨酸残基[6],通过BSA荧光光谱的变化可以判断药物小分子对BSA结构的影响和色氨酸残基周围疏水腔环境的微变化[4]。不同浓度的D-Gal对BSA的荧光猝灭光谱见图1。

1~7,D-Gal浓度(×10-6 mol·L-1):0,3.3,6.6,9.9,13.2,16.5,19.8
由图1可知,BSA的最大发射峰位于350 nm处,随着D-Gal浓度的增大,BSA的荧光强度不断减弱,最大发射峰蓝移了4 nm。表明D-Gal对BSA的荧光具有猝灭作用。
2.2D-Gal与BSA相互作用的猝灭机制
荧光猝灭机制分为动态猝灭和静态猝灭两类,猝灭机制可以通过Stern-Volmer方程F0/F=1+KSVc=1+Kqτ0c来判断[3](式中:F、F0分别为有、无猝灭剂时的荧光强度;KSV为Stern-Volmer动态猝灭常数;c为猝灭剂浓度;Kq为双分子猝灭过程速率常数;τ0为生物大分子的平均荧光寿命,为10-8s)。
图2为不同温度下D-Gal与BSA相互作用的Stern-Volmer曲线,根据直线斜率求出KSV,进一步求出Kq,结果见表1。

图2 D-Gal与BSA相互作用的Stern-Volmer曲线
表1D-Gal与BSA相互作用的猝灭常数及猝灭速率常数
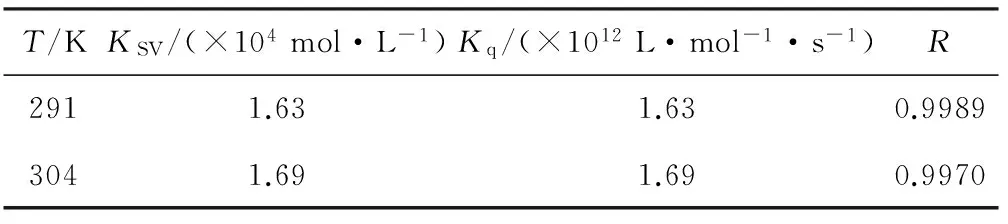
Tab.1 Quenching constant(KSV) and quenching rate constant(Kq) of the interaction between D-Gal and BSA
由表1可知,Kq远大于动态猝灭的最大扩散速率常数2.0×1010L·mol-1·s-1,初步推断D-Gal对BSA的荧光猝灭机制为静态猝灭[4-7]。随着温度的升高,二者作用的斜率略有增大,说明动态猝灭在整个荧光猝灭过程中贡献微弱。
BSA的猝灭机制还可以通过BSA紫外吸收光谱的变化来判断,静态猝灭时BSA的紫外吸收光谱会发生改变;动态猝灭不会发生变化[5]。图3为不同浓度的D-Gal与BSA相互作用的紫外吸收光谱。

1~3,D-Gal浓度(μmol·L-1):0,6.6,13.2
由图3可知,210 nm附近的吸收峰为BSA骨架的吸收峰,280 nm附近的吸收峰是色氨酸、酪氨酸残基的吸收峰[8]。由图3插图可知,随着D-Gal浓度的增大,280 nm附近的吸收峰强度略微减弱,且发生红移,说明在BSA中加入D-Gal后,二者发生了相互作用,改变了BSA发色团周围的微环境;随着D-Gal浓度的增大,210 nm附近的吸收峰强度明显减弱,并发生红移,说明BSA的骨架变得松散[3]。这是因为,D-Gal与BSA生成了基态复合物,改变了BSA的吸收光谱。因此,推断D-Gal对BSA的猝灭机制为静态猝灭。
2.3D-Gal与BSA相互作用的同步荧光光谱(图4)
以285 nm为激发光,当△λ=60 nm时会显示出色氨酸(Trp)残基的荧光特性[7]。从图4可以看出,随着D-Gal浓度的增大,色氨酸残基的荧光强度逐渐减弱,最大发射峰略有红移;△λ=15 nm时显示酪氨酸(Tyr)残基的荧光特性,本实验条件下,酪氨酸残基的最大发射峰的位置和荧光强度没有明显变化(图略)。说明在激发光波长为285 nm时BSA的荧光主要由色氨酸残基贡献,在D-Gal作用下色氨酸残基所处的微环境的极性发生了改变,疏水性增强,从而使得BSA的荧光光谱发生了变化[7]。

1~7,D-Gal浓度(μmol·L-1):0,3.3,6.6,9.9,13.2,16.5,19.8;△λ=60 nm
2.4D-Gal与BSA相互作用的热力学参数
药物小分子与蛋白质之间的相互作用符合方程[9]:lg(F0/F-1)=lgKA+nlgc,以lg(F0/F-1) 对lgc作图(图5),可求出D-Gal与BSA的结合常数KA及结合位点数n,结果见表2。
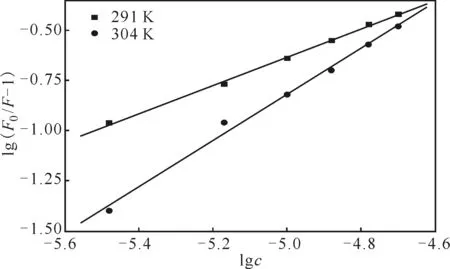
图5 lg(F0/F-1)与lgc的关系曲线
表2不同温度下,D-Gal与BSA相互作用的热力学参数

Tab.2 Thermodynamic parameters of interaction between D-Gal and BSA at different temperatures
Ross等[10]研究表明,△H和△S均为正值时,相互之间的作用力主要为疏水作用力;△G小于零,说明二者之间的结合可自发进行;△H大于零,表明该结合作用为吸热过程,升高温度,结合作用增强。从表2可知,△H和△S均为正值,表明D-Gal与BSA之间的主要作用力是疏水作用力。
3 结论
采用光谱法研究了D-Gal与BSA的相互作用。结果表明,D-Gal与BSA可以形成基态复合物猝灭BSA的内源荧光,疏水作用力是其主要作用力,D-Gal能改变BSA色氨酸残基的微环境。
[1]BRENNER D A,SIGMUND S.Pathogenesis of alcoholic hepatitis[J].Journal of Gastroenterol and Hepatology,2004,19(S7):S229-S235.
[2]李淑波,鞠文博,王春梅.D-半乳糖肝脏损伤动物模型的建立及其检测[J].北华大学学报(自然科学版),2015,16(5):601-604.
[3]SHAHABADI N,HADIDI S.Molecular modeling and spectrosco-pic studies on the interaction of the chiral drug venlafaxine hydrochloride with bovine serum albumin[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,122:100-106.
[4]CAO S H,JIANG X Y,CHEN J W.Effect of zinc(Ⅱ) on the interactions of bovine serum albumin with flavonols bearing different number of hydroxyl substituent on B-ring[J].Journal of Inorganic Biochemistry,2010,104(2):146-152.
[5]许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006:27-85.
[6]宋玉民,吴锦绣,郑秀荣,等.稀土金属离子与人血清白蛋白的相互作用[J].无机化学学报,2006,22(9):1615-1622.
[7]LIAO Z X,YU X Y,YAO Q,et al.Interactions between pirenoxine and bovine serum albumin in aqueous solution[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,129:314-319.
[8]刘保生,王晶,薛春丽,等.头孢噻肟钠和氯霉素与牛血清白蛋白相互作用的荧光光谱分析[J].发光学报,2011,32(6):628-635.
[9]张玉霖,雷迪,陈莉.荧光光谱法研究盐酸二甲双胍与牛血清白蛋白的相互作用[J].化学与生物工程,2015,32(6):46-49.
[10]ROSS P D,SUBRAMAIAN S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3101.
Spectra Analysis of Interaction Between D-Galactose and Bovine Serum Albumin
ZHANG Huai-bin,XU Chang,XING Ru-yue
(SchoolofPharmacy,BinzhouMedicalUniversity,Yantai264003,China)
TheinteractionbetweenD-galactose(D-Gal)andbovineserumalbumin(BSA)wasinvestigatedbyaspectraanalysis.Resultsindicatedthat,thefluorescencespectrumofBSAwasquenchedwiththeincreasingofD-Galconcentration,andthequenchingprocesswasastaticmechanism.ThemaximumemissionpeakofBSAemergedablueshift.TheultravioletabsorptionspectrumandsynchronousfluorescencespectrumindicatedthatD-GalloosenedtheskeletonofBSAandimprovedthehydrophobicityofBSA.ThethermodynamicanalysisindicatedthatthemainactingforceofinteractionbetweenD-GalandBSAwashydrophobicforce.
D-galactose(D-Gal);bovineserumalbumin(BSA);spectrumanalysis;hydrophobicforce
10.3969/j.issn.1672-5425.2016.08.016
山东省医药卫生科技计划资助项目(2015WS0495),山东省高等学校科技计划资助项目(J12LD550),滨州医学院大学生科技创新项目(BY2014DKCX092,BY2015DKCX025)
2016-03-22
张怀斌(1978-),男,山东青州人,讲师,研究方向:生物分析化学,E-mail:zhanghuaibinhua@163.com。
O 657.3
A
1672-5425(2016)08-0067-03
张怀斌,徐畅,邢汝月.D-半乳糖与牛血清白蛋白相互作用的光谱分析[J].化学与生物工程,2016,33(8):67-69.

