不同活性污泥中菌群多样性及差异分析
闫来洪,张振冲,郗丽君,梁文龙
(中国石油大学(华东)化学工程学院,山东 青岛 266580)
不同活性污泥中菌群多样性及差异分析
闫来洪,张振冲,郗丽君,梁文龙
(中国石油大学(华东)化学工程学院,山东 青岛 266580)
采用Illumina MiSeq第二代深度高通量测序方法测定了5种不同活性污泥中的菌群多样性,通过稀释度曲线、丰度分布曲线、活性污泥中菌群组成分析、微生物群落的聚类树与条形图组合分析、主坐标分析(PCoA)等对5种不同活性污泥中的菌群差异进行了分析。结果表明,不同活性污泥中的优势细菌相似,但某些细菌的含量存在较大差异,如:正常污泥中浮霉状菌含量几乎是泡沫中的2倍,而正常污泥中放线菌含量不足泡沫中的一半;泡沫中WCHB1-60和Candidate division TM7的含量分别比正常污泥多1.3倍和3.2倍,而泡沫中硝化螺旋菌的含量仅仅是正常污泥中的1/5。表明,活性污泥中的菌群组成与环境相似度呈正相关,且细菌含量与活性污泥的状态密切相关。
活性污泥;高通量测序;菌群多样性;差异
活性污泥是一个独特的人工微生物生态系统,具有高的生物多样性(超过700属)及生物量浓度(2~10g·L-1)[1-2]。高度多样化的细菌群落形成以菌胶团为骨架的活性污泥絮体,有效保证了稳定、良好的废水生物处理性能[3-5]。
由于技术方法的限制,目前多数研究报道未能全面比较分析不同状态活性污泥中的细菌群落变化及其是否存在区域差异[6-7]。而利用高通量测序技术及先进的数据分析方法可以较全面地分析活性污泥及泡沫中微生物[8-9]。作者采用IlluminaMiSeq第二代深度高通量测序方法对来自污水处理厂和实验室人工模拟装置中不同状态的活性污泥的微生物组成进行详细的测定解析,同时分析了不同活性污泥的物种差异及其与区域特异性间的联系,拟为维持实际生产中活性污泥的良好状态提供理论指导。
1 实验
1.1材料
1#、2#、4#、5#活性污泥样品分别来自青岛泥布湾污水处理厂(1#、2#、4#样品)和镰湾河水质净化厂(5#样品),3#活性污泥样品来自实验室人工模拟装置。样品经处理后移至-70 ℃低温冰箱中长期保存。
泥布湾污水处理厂采用倒置A2/O工艺,主要处理生活污水;镰湾河水质净化厂采用百乐克工艺,主要处理生活用水。两污水处理厂污水经处理后均可达到《城镇污水处理厂污染物排放标准》规定的一级B类排放标准。
实验室人工模拟装置采用最基本的活性污泥法,由均质池、曝气池、二沉池及回流装置组成。曝气池与二沉池采用相同的圆柱形有机玻璃管(直径10cm、高40cm、容积3.14L)。实验室人工模拟装置进水为人工配水,其配方为:葡萄糖220mg·L-1、蛋白胨200mg·L-1、氯化铵58mg·L-1、磷酸氢二钾19mg·L-1、氯化钙4mg·L-1、硫酸镁2mg·L-1。
1.2仪器
超净工作台,全自动灭菌锅,超纯水仪,哈希水质检测仪,蠕动泵驱动器,高速离心机,扩增仪,水平电泳槽,凝胶成像系统,低温冰箱,漩涡混合器,岛津紫外分光光度计,ABIGeneAmp®9700型PCR仪。
1.3方法
1.3.1样品采集
从泥布湾污水处理厂采集曝气池中的正常活性污泥(1#)、上浮的污泥泡沫(2#)及二沉池中的回流上浮污泥(4#);从实验室人工模拟装置中采集好氧池中的正常活性污泥(3#);从镰湾河水质净化厂采集正常的活性污泥(5#)。每种类型的污泥样品分别在3个不同的采样点同时采集,混合后进行总DNA的提取。
1.3.2总DNA的提取
将混合污泥样品放入50 mL离心管中于6 000 r·min-1高速离心10 min,去上层清液,用基因组提取试剂盒(E.Z.N.A.TM Soil DNA Kit,Omega公司)提取总DNA后取5 μL用1%琼脂糖凝胶电泳检测。剩余污泥于-70 ℃冷冻备用。每种样品做3个平行,电泳检测后混合。
1.3.3PCR扩增
按指定测序区域,合成带有barcode的特异引物。5种污泥样品均在正式实验条件下进行,每种样品做3个重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl缓冲液洗脱,2%琼脂糖凝胶电泳检测。
1.3.4荧光定量
根据电泳初步定量结果,用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)检测PCR产物,再按照每种样品的测序量要求进行相应比例的混合。
1.3.5MiSeq测序
MiSeq文库构建:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA片段。
MiSeq测序:(1)DNA片段的一端与引物碱基互补,固定在芯片上;另一端随机与附近的另外一个引物互补,也被固定住,形成“桥”;(2)PCR扩增,产生DNA簇;(3)DNA扩增子线性化成为单链;(4)加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成一个碱基;(5)用激光扫描反应板表面,读取每条模板序列第一轮反应聚合上的核苷酸种类;(6)将“荧光基团”和“终止基团”化学切割,恢复3′端粘性,继续聚合第二个核苷酸;(7)统计每轮收集到的荧光信号结果,获得模板DNA片段的序列。
1.3.6生物信息分析
MiSeq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析。基于OTU聚类分析结果,对OTU进行多样性指数分析及测序深度的检测;基于分类学分析结果,在各个分类水平上进行群落结构的统计分析。
2 结果与讨论
2.1MiSeq测序结果
5种样品的高通量测序结果如表1所示,5种样品所含操作分类单元及所含序列数目见图1。
由图1可知,1#样品中含细菌种类969个,2#样品中含1 027个,3#样品中含435个,4#样品中含1 066个,5#样品中含829个;1#、2#、4#样品来自同一污水处理厂,有相同种类833个;1#、5#样品是同一性质的污泥,有相同种类635个;1#、2#、4#、5#样品全部来自实际运行工艺中,共有相同种类566个;1#、2#、3#、4#、5#样品共有相同种类248个。1#~5#样品特有的微生物种类分别是5个、1个、46个、20个、85个。
表15种样品的高通量测序结果
Tab.1High throughput sequencing results of five samples

样品序列数碱基数/bp平均长度/bp1#4737018741233395.642#4733918733986395.743#4114216260732395.234#4892119349945395.535#4294416987670395.58

图1 操作分类单元维恩图[10]
2.2物种丰度及群落结构分析
2.2.1稀释度曲线(图2)

图2 5种样品的稀释度曲线
稀释度曲线[11]是从样品中随机抽取一定数量的个体,用来说明测序数量是否合理,也可比较测序数量不同的样品的物种丰度,反映每种样品物种丰度与取样深度的关系。
从图2可以看出,1#、2#、4#样品具有非常相似的变化趋势与幅度,5#样品与1#、2#、4#样品差异较大,但相比2#、4#样品,5#样品与1#样品更接近,3#样品与其它样品差异最大。说明同一污水处理厂不同样品(1#、2#、4#)的物种丰度最接近,不同污水处理厂相同状态(1#、5#样品皆为正常污泥)样品次之,实验室人工模拟装置中样品(3#)的物种丰度与实际污水处理厂中样品的物种丰度差异最大。
2.2.2丰度分布曲线
丰度分布曲线[12]是分析菌群多样性的一种方法,既可用来解释物种丰度也可解释物种均匀度。5种样品的OTU等级丰度分布曲线如图3所示。
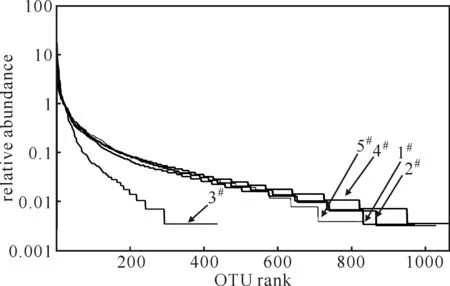
图3 5种样品的OTU等级丰度分布曲线
从图3可以看出,1#、2#、4#、5#样品的斜率较小且非常接近,又以1#、2#样品斜率最接近,3#样品斜率最大。说明1#、2#样品因取自同一位置所以均匀度最相似且最好,1#、2#、4#、5#样品因取自实际污水处理厂不同位置所以均匀度较相似,3#样品因取自实验室人工模拟装置所以均匀度最差。此外,丰度分布曲线在横轴上的宽度再次印证了5种样品的相对丰度及其相互关系。
2.2.3活性污泥中菌群组成分析
图4反映了5种活性污泥样品在属的层次上包含的微生物种类及各物种的相对含量。
从图4可知,5种活性污泥样品所含微生物属的种类基本一致,但其相对含量差异较大。对所含主要微生物属进行分析和归类发现,1#、2#、4#、5#样品主要物种为丛毛单胞菌、腐败螺旋菌和光合细菌;3#样品与其它样品明显不同,含有大量的丛毛单胞菌和嗜酸菌,而光合细菌的含量却非常少;相比于其它样品,2#样品中存在大量的未培养的Candidate division TM7、下水道杆菌、水单胞菌、盐单胞菌、分枝杆菌、斯科曼氏菌。
表2是正常污泥与泡沫中微生物主要组成。
从表2可知,2种样品中的微生物组成差异主要表现在:对于高丰度微生物而言,正常污泥中浮霉状菌(Planctomycetes)的含量几乎是泡沫中的2倍,而正常污泥中放线菌(Actinobacteria)的含量不足泡沫中的一半;对于低丰度微生物而言,泡沫中WCHB1-60、Candidate division TM7的含量高达3.72%、2.31%,分别比正常污泥多1.3倍、3.2倍,而泡沫中硝化螺旋菌(Nitrospirae)的含量只有0.26%,仅为正常污泥样品中的1/5,该菌是亚硝酸盐氧化菌中的一个主要谱系,在废水生物处理中具有重要作用。

图45种样品的微生物菌群分布图
Fig.4Microbial community distribution barplot of five samples
表2正常污泥与泡沫中微生物主要组成

Tab.2 Main components of microbacteria in normal sludge and foaming sludge
据报道,放线菌中的某些种属与泡沫的形成密切相关,如本实验发现:(1)分枝杆菌,能在体内合成大量的分枝菌酸,因而细胞壁中含有大量的分枝菌酸,细胞壁中所含的长链枝状的分枝菌酸导致细胞表面的疏水性(CSH),而CSH 正是泡沫形成的选择性浮选的必要条件[13],因而分枝杆菌是泡沫形成的重要原因之一。(2)斯科曼氏菌,原属于诺卡氏菌,可产生与分枝杆菌不同的分枝菌酸,是造成泡沫的另一主要微生物[14]。(3)戈登氏菌,在泡沫中含量为0.24%,1#样品中含量为0.021%,5#样品中含量为0.024%,可以推断戈登氏菌在泡沫中大量增殖,表明戈登氏菌是重要的发泡微生物,与泡沫的形成有重要关系[15]。
2.2.4微生物群落聚类树与条形图组合分析
5种样品的微生物群落聚类树与条形图如图5所示。
图5中左边是5种样品基于群落组成的层次聚类分析[16](bray-curtis算法),右边是5种样品的微生物群落条形图[17]。通过聚类树可以看出,不同地区不同工艺的样品微生物差异最大,同一地区不同状态的样品微生物差异次之,同一状态不同类型的样品微生物差异最小。通过5种样品的条形图可以看出每种菌属的相对含量。聚类树与条形图组合分析定量而直观地反映了5种样品的相似性及菌属含量差异性。

图5 5种样品的微生物群落的聚类树与条形图
2.2.5主坐标分析
主坐标分析(principal coordinate analysis,PCoA),可用来研究群落组成的相似性或差异性,与PCA[18]类似。通过降维找出影响5种样品群落组成差异的潜在主成分,样品间距离通过各样品序列间的进化信息计算得出,从而可以确定5种不同活性污泥样品间的多样性差异,如图6所示。
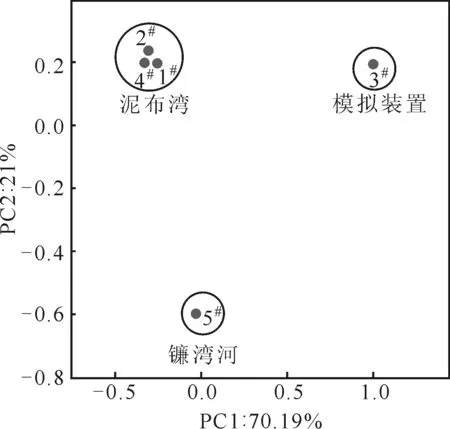
图6 5种样品的主坐标分析
从图6可知,1#、2#、4#样品聚在了一起,而3#、5#样品与它们相距较远。表明5种活性污泥样品群落处于同一地点相同处理工艺中的差异很小,处于不同地点不同处理工艺中的差异很大,因此区域特征及处理工艺对活性污泥中微生物群落有着重要影响。
2.3讨论
据报道,环境条件(主要是污泥停留时间和无机氮等)对微生物的影响主要体现在相对含量上,而微生物间的相互作用则对微生物的群落组成与结构起主导作用[19]。本实验发现,在属的水平上一些稀有微生物只存在于某一个水厂或实验室人工模拟装置中,如泥布湾污水处理厂中特有微生物有(括号中为正常污泥中微生物含量)AKYG587(0.063%)、Actinobacteria unclassified(0.17%)、Armatimonadales unclassified(0.17%)、CL500-3(0.063%)等;镰湾河水质净化厂中特有微生物有Alcaligenaceae uncultured(0.11%)、Burkholderiales unclassified(0.096%)、Byssovorax(0.016%)等;实验室人工模拟装置中特有微生物有Achromobacter(0.093%)、Aquitalea(0.054%)等。说明除环境条件影响微生物相对含量外,不同地方活性污泥中微生物组成并不相同,即不同状态的活性污泥中微生物群落具有区域性分布特点。
3 结论
采用Illumina MiSeq测序方法,从5种活性污泥样品中共分离了细菌门36个、纲78个、目140个、科248个。
泥布湾污水处理厂正常活性污泥样品中主要包含5个类群(含量>5%),其中变形菌门与拟杆菌门所占比例最大,分别为33.9%、16.01%;其次是绿菌、绿弯菌、浮霉状菌,分别为12.88%、8.97%和9.28%。好氧池上浮的污泥泡沫中主要包含6个类群(含量>5%),其中变形菌门与拟杆菌门所占比例最大,分别为32.44%和20.64%;其次是放线菌、绿菌、绿弯菌、浮霉状菌,分别为10.44%、8.5%、6.19%、5.05%;其中放线菌中的分枝杆菌、斯科曼氏菌和戈登氏菌含量均高于正常污泥,它们为主要的泡沫产生菌。二沉池中的回流上浮污泥中主要包含5个类群(含量>5%),其中变形菌门与拟杆菌门所占比例最大,分别为38.13%、20.67%;其次是绿菌、绿弯菌、浮霉状菌,分别为10.6%、7.52%、6.15%。
实验室人工模拟装置污泥样品中主要包含2个类群(含量>5%),其中变形菌门与拟杆菌门所占比例最大,分别为70.36%、17.15%。
镰湾河水质净化厂正常污泥中主要包含5个类群(含量>5%),其中变形菌门与拟杆菌门所占比例最大,分别为33.69%、18.54%;其次是绿菌、绿弯菌、酸杆菌,分别为12.66%、12.23%、5.54%。
稀释度曲线、丰度分布曲线、活性污泥中菌群组成分析、微生物群落的聚类树与条形图组合分析、主坐标分析结果表明,同一水厂同一位置不同状态污泥样品中的微生物群落结构最相似,同一水厂不同位置次之,不同水厂样品差异最大。因此,微生物群落组成与环境相似度呈正相关且微生物种群相对含量变化与活性污泥的状态密切相关。人工模拟装置样品与其它样品对比结果表明,小型模拟装置难以模拟实际污水的处理过程。
[1]ZHANG T,SHAO M F,YE L.454 Pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J].The Isme Journal,2012,6(6):1137-1147.
[2]GRADY C P,DAIGGER G T,LOVE N G.Biological wastewater treatment[J].Biological Wastewater Treatment,2011,15(2):275-290.
[3]DAIMS H,TAYLOR M W,WAGNER M.Wastewater treatment:a model system for microbial ecology[J].Trends in Biotechnology,2006,24(11):483-489.
[4]NIELSEN P H,SAUNDERS A M,HANSEN A A,et al.Microbial communities involved in enhanced biological phosphorus removal from wastewater:a model system in environmental biotechnology[J].Current Opinion in Biotechnology,2012,23(3):452-459.
[5]JU F,GUO F,YE L,et al.Metagenomic analysis on seasonal microbial variations of activated sludge from a full-scale wastewater treatment plant over 4 years[J].Environmental Microbiology Reports,2014,6(1):80-89.
[6]GODDARD A J,FORSTER C F.Stable foams in activated sludge plants[J].Enzyme & Microbial Technology,1987,9(3):164-168.
[7]JENKINS D.Towards a comprehensive model of activated sludge bulking and foaming[J].Water Science & Technology,1992,25(6):215-230.
[8]LOGARES R,HAVERKAMP T H,KUMAR S,et al.Environmental microbiology through the lens of high-throughput DNA sequencing:synopsis of current platforms and bioinformatics approaches[J].Journal of Microbiological Methods,2012,91(1):106-113.
[9]MACLEAN D,JONES J D,STUDHOLME D J.Application of “next-generation” sequencing technologies to microbial genetics
[J].Nature Reviews Microbiology,2009,7(4):287-296.
[10]FOUTS D E,SZPAKOWSKI S,PURUSHE J,et al.Next generation sequencing to define prokaryotic and fungal diversity in the bovine rumen[J].PLoS One,2012,7(11):482-489.
[11]AMATO K R,YEOMAN C J,KENT A,et al.Habitat degradation impacts black howler monkey(Alouattapigra) gastrointestinal microbiomes[J].The Isme Journal,2013,7(7):1344-1353.
[12]BATES S T,CLEMENTE J C,FLORES G E,et al.Global biogeography of highly diverse protistan communities in soil[J].The Isme Journal,2013,7(3):652-659.
[13]STRATTON H M,BROOKS P R,GRIFFITHS P C,et al.Cell surface hydrophobicity and mycolic acid composition ofRhodococcusstrains isolated from activated sludge foam[J].Journal of Industrial Microbiology & Biotechnology,2002,28(5):264-267.
[14]SODDELL J,SEVIOUR R.Growth of an activated sludge foam-forming bacterium,Nocardiapinensis,on hydrophobic substra-tes[J].Water Science & Technology,1996,34(5):113-118.
[15]GUO F,ZHANG T.Profiling bulking and foaming bacteria in activated sludge by high throughput sequencing[J].Water Resear-ch,2012,46(8):2772-2782.
[16]JIANG X T,PENG X,DENG G H,et al.Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J].Microbial Ecology,2013,66(1):96-104.
[17]SRINIVASAN S.Bacterial communities in women with bacterial vaginosis:high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria[J].PLoS One,2012,7(6):e37818.
[18]WANG Y,SHENG H F,HE Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of illumina tags[J].Applied & Environmental Microbiology,2012,78(23):8264-8271.
[19]JU F,ZHANG T.Bacterial assembly and temporal dynamics in activated sludge of a full-scale municipal wastewater treatment plant[J].The Isme Journal,2015,9(3):683-695.
Bacteria Community Diversity and Differences in Different Types of Activated Sludge
YAN Lai-hong,ZHANG Zhen-chong,XI Li-jun,LIANG Wen-long
(CollegeofChemicalEngineering,ChinaUniversityofPetroleum,Qingdao266580,China)
Thebacteriacommunitydiversityoffivetypesofactivatedsludgewasdetectedbyusingasecondgenerationhighthroughputdeepsequencingtechnology(IlluminaMiSeq).Throughtherarefactioncurves,theabundancedistributioncurves,analysisofbacteriacommunitycomponents,clusteringtreecombinedbarplotanalysisofbacteriacommunityandprincipalcoordinateanalysis(PCoA),thedifferencesinfivetypesofactivatedsludgewereanalyzed.Resultsindicatedthat,dominantbacteriaindifferentactivatedsludgeweresimilartoeachother,butthecontentofsomebacteriahadsignificantdifference.Forexample,thecontentofPlanctomycetesinnormalsludgewasalmostdoubleofthatinfoam,whilethecontentofActinomycetesinnormalsludgewaslessthanhalfofthatinfoam;thecontentofWCHB1-60andCandidatedivisionTM7infoamwas1.3times,3.2timesmorethanthatinnormalsludge,respectively,whilethecontentofNitrospiraeinfoamwasone-fifthofthatinnormalsludge.Bacteriacommunitycompositionwaspositivelycorrelatedwithenvironmentalsimilarity,andthecontentsofbacteriawerecloselyrelatedtothestateoftheactivatedsludge.
activatedsludge;highthroughputsequencing;bacteriacommunitydiversity;difference
10.3969/j.issn.1672-5425.2016.08.014
国家自然科学基金资助项目(31400005),山东省自然科学基金资助项目(ZR2013CL028),中央高校专项基金资助项目(R1304006A)
2016-04-07
闫来洪(1952-),男,山东东营人,副教授,主要从事水污染治理及环境影响评价,E-mail:yanlh918@126.com。
X 172
A
1672-5425(2016)08-0057-06
闫来洪,张振冲,郗丽君,等.不同活性污泥中菌群多样性及差异分析[J].化学与生物工程,2016,33(8):57-62.

