烟曲霉Asp f3和Asp f4线性B细胞抗原表位最小基序鉴定
石晶,高岩,霍克克,季朝能,2,唐海平,徐万祥,谢毅,2,顾少华,2
1. 复旦大学生命科学学院遗传工程国家重点实验室,上海 200438; 2. 上海市工业菌株工程技术研究中心,上海 200438; 3. 上海市计划生育科学研究所,国家人口和计划生育委员会重点实验室,上海 200032
·论著·
烟曲霉Asp f3和Asp f4线性B细胞抗原表位最小基序鉴定
石晶1,2,高岩1,2,霍克克1,季朝能1,2,唐海平3,徐万祥3,谢毅1,2,顾少华1,2
1. 复旦大学生命科学学院遗传工程国家重点实验室,上海 200438; 2. 上海市工业菌株工程技术研究中心,上海 200438; 3. 上海市计划生育科学研究所,国家人口和计划生育委员会重点实验室,上海 200032
烟曲霉(Aspergillusfumigatus)是一种广泛存在于自然界中的条件致病菌,其产生的分生孢子被易感人群吸入后定植于肺部,引起3种曲霉病:致咯血的曲霉肿、致肺纤维化的变应性支气管肺曲霉病、致较高死亡率的侵袭性曲霉病。目前临床上用于诊断烟曲霉感染的血清免疫学指标有半乳甘露聚糖和1,3-β-D-葡聚糖,但特异度和灵敏度方面存在一定的局限性。Asp f3 和Asp f4为烟曲霉主要抗原,在感染者血清中存在相应的循环抗体。本研究分别用兔抗Asp f3 和Asp f4抗血清对其进行抗原表位扫描,鉴定了8个Asp f3和6个Asp f4最小表位基序肽。用所鉴定的最小表位基序与烟曲霉其他抗原的最小表位基序构建嵌合肽,可能有助于提高烟曲霉感染诊断的特异度和灵敏度。
烟曲霉;Asp f3;Asp f4;线性B细胞表位;最小基序
烟曲霉(Aspergillusfumigatus)是一种广泛存在于自然界中的条件致病菌,其孢子被易感人群吸入后定植于肺部,可引起3种曲霉病:致咯血的曲霉肿(aspergilloma)、致肺纤维化的变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)和致高死亡率的侵袭性曲霉病(invasive aspergillosis,IA)[1]。
曲霉肿由前期定植于空腔、囊肿、肺大泡或扩张性支气管的非侵袭性曲霉造成[1],常见于肺结核、肉状瘤病和扩张性支气管炎患者中[2]。变应性支气管肺曲霉病表现为长期哮喘病和囊包性纤维症患者对烟曲霉的过敏性反应[2]。而侵袭性曲霉病则以烟曲霉在肺部定植、侵袭为主。变应性支气管肺曲霉病与侵袭性曲霉病的不同之处在于,前者引起过敏性反应的烟曲霉或嗜酸性粒细胞继续留存于支气管腔内[2]。
血清免疫学指标对曲霉病的诊断非常重要[3]。半乳甘露聚糖(galactomannan,GM)和1,3-β-D-葡聚糖(1,3-β-D-glucan,BG)是烟曲霉细胞壁的多糖成分,随孢子萌发和菌丝体生长进入宿主血循环。因此,可分别用GM和BG单克隆抗体(简称单抗)检测血清中的相应循环抗原,目前常用于临床诊断烟曲霉感染,但特异度和灵敏度方面存在一定的局限性[3]。已有研究表明,利用烟曲霉免疫原性强的体外重组蛋白,可检测感染者血清中的相应循环抗体,但单个重组蛋白同样在特异度和灵敏度方面存在一定的局限性[4]。一个蛋白抗原的长表位肽可能与其他蛋白抗原的抗体起交叉反应,因此鉴定蛋白抗原表位的最小基序可提高检测的特异度;将多个蛋白抗原表位的最小基序组成嵌合肽可提高检测的灵敏度。Asp f3作为变应原,由世界卫生组织和国际免疫学会联合会变应原命名分委员会(World Health Organization and International Union of Immunological Societies Allergen Nomenclature Sub-committee)命名,为过氧化物酶体蛋白。Asp f4也是烟曲霉的主要免疫原,生物学功能未知[5]。人体感染烟曲霉会产生抗Asp f3和Asp f4的IgG、IgE和IgA抗体[6]。
本研究制备Asp f3和Asp f4重组蛋白,免疫新西兰白兔,获得相应的兔抗血清[7]。用兔抗Asp f3和Asp f4抗血清进行抗原表位扫描,鉴定出8个Asp f3和6个Asp f4最小基序。将所鉴定的最小基序与烟曲霉其他抗原的最小基序构建嵌合肽,可能有助于提高烟曲霉感染诊断的特异度和灵敏度。
根据基本局部比对检索工具(Basic Local Alignment Search Tool,BLAST)及文献阅读结果,应用http://www.ebi.ac.uk/Tools/msa/clustal和http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi这两个网站的同源蛋白分析工具,将烟曲霉Asp f3 和Asp f4分别与黄曲霉(Aspergillusflavus)、黑曲霉(Aspergillusniger)和土曲霉(Aspergillusterreus)同源蛋白的序列进行比对分析,发现烟曲霉与另外3种曲霉的相关同源蛋白高度一致,故将获得的最小基序与这些同源序列进行比对,得到曲霉种属的拟保守序列。
1 材料与方法
1.1材料
菌株与质粒:大肠埃希菌BL21(DE3)、DH5α及质粒pXXGST-1、pXXGST-2为本实验室保存。
主要试剂和酶:限制性内切酶SalⅠ-HF和BamHⅠ-HF购自New England Biolabs公司,T4 DNA连接酶购自Thermo-Fermentas公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔IgG二抗购自Santa Cruz Biotechnology公司,12.5%和15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)预制胶购自上海熠晨生物科技有限公司。
主要耗材:聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜购自Millipore公司
1.2方法
1.2.1重组蛋白Asp f3和Asp f4 18肽克隆构建与表达鉴定
1.2.1.1Asp f3和Asp f4 18肽上下游引物设计根据烟曲霉Af293菌株的Asp f3(NCBI accession No:XP_747849)和Asp f4(NCBI accession No:XP_749515)的蛋白序列,设计覆盖重组蛋白Asp f3(168个氨基酸)和Asp f4(322个氨基酸)全长的前后相互重叠9个氨基酸的18肽,最终将Asp f3拆分为18个覆盖此蛋白全长且前后相互重叠9个氨基酸的18肽,Asp f4拆分为34个覆盖此蛋白全长且前后相互重叠9个氨基酸的18肽。在每个肽段的正链编码5′端加入“GATCC”序列,3′端加入“TAAG”序列;负链编码5′端加入“TCGACTTA”序列,3′端加入“G”序列[8]。根据SignalP软件预测,Asp f4的信号肽为第1~14位氨基酸,故pET-22(b)-Asp f4重组质粒中,Asp f4的序列为第15~322位氨基酸,用Asp f415-322表示。
1.2.1.2引物退火、体系连接(10 μL)、构建克隆、测序验证95 ℃使上下游引物退火,T4连接酶将退火所得引物与目的片段连接,然后按常规方法构建克隆。
1.2.1.3重组蛋白Asp f3和Asp f4 18肽的高温诱导表达将测序成功(NCBI BLAST 系统比对完全匹配)的重组18肽保种菌于30 ℃过夜培养至一定密度(OD600值为0.6~0.8)后,42 ℃诱导4 h(pXXGST质粒表达系统为热诱导表达),对表达蛋白制样保存。
1.2.1.4重组蛋白Asp f3和Asp f4 18肽的蛋白免疫印迹鉴定对SDS-PAGE确定表达了的样品进行蛋白免疫印迹鉴定。鉴定Asp f3所用一抗兔抗血清浓度为1∶10 000,而鉴定Asp f4所用一抗兔抗血清浓度为1∶100 000。二抗全部用羊抗兔IgG,浓度为1∶5 000。通过色差分析软件调整蛋白上样量,以确保每一短肽的上样量统一,尽量消除后续鉴定实验中因蛋白量不同而可能引起的误差。
1.2.2重组蛋白 Asp f3 和 Asp f4 9肽克隆构建与表达鉴定将表达阳性的12条Asp f3 18肽和13条Asp f4 18肽分别合成前后相互重叠8个氨基酸的9肽。但由于前一条18肽的最后一条9肽与相邻的后一条18肽的第一条9肽重合,故进行表达免疫时每条18肽只选取9条9肽来进行后续实验,并按1~9编号。例如:1号18肽分成的9条9肽分别为1-1~1-9。其他克隆构建与表达鉴定方法均同18肽,并根据9肽蛋白免疫印迹鉴定图分析两个蛋白的最小基序。
1.2.3Asp f3和Asp f4最小基序的比对分析将烟曲霉Asp f3、Aspf4最小基序与黄曲霉、黑曲霉和土曲霉的相关同源序列通过Bioedit 软件比对分析以获得拟保守表位。
2 结果
2.1Asp f3 18肽表达鉴定
Asp f3 18个18肽免疫兔抗血清的结果显示,阳性18肽有12个:Asp f31-18、Asp f39-26、Asp f317-34、Asp f325-42、Asp f349-66、Asp f357-74、Asp f365-82、Asp f389-106、Asp f397-114、 Asp f3105-122、Asp f3121-138、Asp f3129-146,在图1中分别以1、2、3、4、7、8、9、12、13、14、16、17标出。
2.2Asp f4 18肽表达鉴定
Asp f4 34个18肽免疫兔抗血清结果显示,阳性18肽共13个:Asp f447-64、Asp f455-72、 Asp f463-80、Asp f487-104、 Asp f495-112、 Asp f4111-128、 Asp f4119-136、

Column 0: protein pXXGST-2 as blank control; Columns 1-18: Asp f3 18mer peptides 1-18; Row 1: SDS-PAGE of Asp f3 18mer peptides; Row 2: immunogenicity identification of Asp f3 18mer peptides 1-18 using rabbit antisera as the first antibody.
图1Asp f3 18肽的免疫原性鉴定
Fig.1Immunogenicity identification of Asp f3 18mer peptides

Column 0: protein pXXGST-2 as blank control; Columns 1-34: Asp f4 18mer peptides 1-34; Row 1: SDS-PAGE of Asp f4 18mer peptides; Row 2: immunogenicity identification of Asp f4 18mer peptides 1-34 using rabbit antisera as the first antibody.
图2Asp f4 18肽的免疫原性鉴定
Fig.2Immunogenicity identification of Asp f4 18mer peptides
Asp f4127-144、Asp f4177-194、Asp f4185-202、Asp f4201-218、Asp f4225-242、Asp f4241-258,在图2中分别以5、6、7、10、11、13、14、15、23、24、26、29、31标出。将这13条18肽继续合成前后相互重叠8个氨基酸的9肽。
2.3Asp f3最小基序分析
鉴定出的8条最小基序分别为Asp f35-9、Asp f312-17、Asp f316-23、Asp f335-41、Asp f367-72、Asp f372-78、Asp f3123-127、Asp f3141-148(图3)。
2.4Asp f4 最小基序分析
鉴定出的6条最小基序分别为Asp f456-61、Asp f4104-109、Asp f4130-134、Asp f4136-141、Asp f4219-226、Asp f4226-232(图4)。

A: Minimal motif KAGDS of Asp f3. B: Minimal motif SDVVFS of Asp f3. C: Minimal motif FSYIPWSE of Asp f3. D: Minimal motif INYNASK of Asp f3. E: Minimal motif PEYIEK of Asp f3. F: Minimal motif KLPEIRA of Asp f3. G: Minimal motif IGWAD of Asp f3. H: Minimal motif HGKITYAA of Asp f3.
图3Asp f3蛋白最小基序
Fig.3The minimal motifs of Asp f3
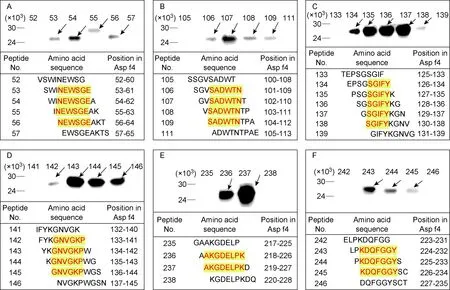
A: Minimal motif NEWSGE of Asp f4. B: Minimal motif SADWTN of Asp f4. C: Minimal motif SGIFY of Asp f4. D: Minimal motif GNVGKP of Asp f4. E: Minimal motif AKGDELPK of Asp f4. F: Minimal motif KDQFGGY of Asp f4.
图4Asp f4蛋白最小基序
Fig.4The minimal motifs of Asp f4
2.5Asp f3最小基序同源比对分析
将鉴定出的烟曲霉Aspf3最小基序与黄曲霉同源蛋白TR|A0A0D9MXZ2、TR|B8N6G4,黑曲霉同源蛋白TR|G3XWC6、TR|A2R0G9、TR|G3Y523、TR|A2R6R3,土曲霉同源蛋白TR|Q0CGH0、TR|Q0C982的相关同源序列(图5中所示TR号均为该菌在UniProtKB中的对应编号)通过Bioedit 软件比对,结果如下。

A: Comparison of minimal motifs KAGDS, SDVVFS, FSYIPWSE, INYNASK and PEYIEK of Asp f3 with homology sequences ofAspergillusflavus,AspergillusnigerandAspergillusterreus. B: Comparison of minimal motifs IGWAD, DEEGRTKRY and HGKITYAA of Asp f3 with homology sequences ofAspergillusflavus,AspergillusnigerandAspergillusterreus.
图5Asp f3蛋白最小基序与黄曲霉、黑曲霉和土曲霉相关同源序列的比对
Fig.5Comparison of minimal motifs of Asp f3 with homology sequences ofAspergillusflavus,AspergillusnigerandAspergillusterreus
鉴定出的最小基序中,表位Asp f35-9、Asp f312-17、Asp f335-41、Asp f367-72、Asp f372-78、Asp f3141-148与黄曲霉同源蛋白TR|A0A0D9MXZ2、TR|B8N6G4,黑曲霉同源蛋白TR|G3XWC6、TR|A2R0G9 、TR|G3Y523、TR|A2R6R3,土曲霉同源蛋白TR|Q0CGH0、TR|Q0C982的相关同源序列匹配较多,可作为重点鉴定对象,为总结保守性表位及进行后续广谱性嵌合肽检测抗原的研制提供基础。
2.6Asp f4最小基序同源比对分析
将鉴定出的烟曲霉Aspf4最小基序与黄曲霉同源蛋白TR|B8N0A2、TR|A0A0D9MQD1、TR|B8NS76、TR|A0A0D9NBG0、TR|A0A0D9ND49、TR|B8NKD2,黑曲霉同源蛋白TR|Q1ZZ48、TR|G3XZE6、TR|A2QP69、TR|G3Y854、TR|A2QFU1、TR|G3XTJ1,土曲霉同源蛋白TR|Q0C9X7、TR|Q0CB03的相关同源序列(图6中所示TR号均为该菌在UniProtKB中的对应编号)通过Bioedit 软件比对,结果如下。
最小基序中,表位Asp f4219-226、Asp f4226-232与黄曲霉同源蛋白TR|A0A0D9MQD1、TR|B8N0A2,黑曲霉同源蛋白TR|G3XZE6、TR|A2QP69、TR|G3Y854、TR|A2QFU1,土曲霉同源蛋白TR|Q0C9X7、TR|Q0CB03的相关同源序列匹配较多,可作为重点鉴定对象,为总结该蛋白的保守性表位及进行后续广谱性嵌合肽检测抗原的研制提供基础。

A: Comparison of minimal motif SADWTN of Asp f4 with homology sequence ofAspergillusflavus,AspergillusnigerandAspergillusterreus;B: Comparison of minimal motifs AKGDELPK, KDQFGGY and MKICNHAGE of Asp f4 with homology sequence ofAspergillusflavus,AspergillusnigerandAspergillusterreus.
图6Asp f4蛋白最小基序与黄曲霉、黑曲霉和土曲霉相关同源序列的比对
Fig.6Comparison of minimal motifs of Asp f4 with homology sequences ofAspergillusflavus,AspergillusnigerandAspergillusterreus
3 讨论
对于任何一种疾病,早期、快速诊断能大大降低其致死率[9-10]。真菌感染引起的疾病中,曲霉肿、变应性支气管肺曲霉病和侵袭性曲霉病尤为如此,关键免疫原的表位筛选在疾病确诊中非常重要。例如,侵袭性曲霉病病死率为50%~95%, 约90%由烟曲霉感染引起,很多患者往往在尸检时才能明确诊断,因此早期诊断和及时使用抗真菌药物能大大提高生存率。
有研究发现,所有曲霉变应原能在致敏患者中引起Ⅰ型超敏反应,并产生高水平的IgG、IgE抗体[11]。本研究选取烟曲霉变应原中的Asp f3和Asp f4进行线性B细胞表位最小基序的筛选。在蛋白免疫印迹鉴定中对两种抗体的比例进行摸索与尝试,结合蛋白表达量,最终确定Asp f3鉴定实验中所用一抗兔抗血清浓度为1∶10 000,而Asp f4鉴定实验中所用一抗兔抗血清浓度为1∶100 000; 二抗全部用羊抗兔IgG,浓度为1∶5 000。
本研究的局限性在于,烟曲霉为真菌,真菌蛋白易被糖基化,可能影响对疾病的判断。因此,在以后相应试剂盒研发过程中要注意规避此缺陷。
本研究发现,Asp f4第55号9肽在考马斯亮蓝染色鉴定表达图和蛋白免疫印迹鉴定图中位置均比正常条带偏上,这是基因工程中目的蛋白表达的常见现象,由重组蛋白的氨基酸电荷导致[12]。
靶蛋白抗原性的基础是表位[13]。在获得最小基序后,应将其用兔抗血清和志愿者血清进一步检验,以利于后续广谱性嵌合肽的合成和相应检测疾病试剂盒的研发。
在9肽鉴定中,有10个连续阳性条带出现,可能是对应的18肽中有不止一个最小基序存在,后续实验中应将其拆分为8肽进一步行最小基序鉴定。本研究还将鉴定出的Asp f3和Asp f4两个重组蛋白的最小基序分别与黄曲霉、黑曲霉和土曲霉的同源蛋白进行BLAST分析。结果发现,Asp f3的8条较小基序中,表位Asp f35-9、Asp f312-17、Asp f335-41、Asp f367-72、Asp f372-78、Asp f3141-148与其他同源序列匹配较多;而Asp f4的6条最小基序中,表位Asp f4219-226、Asp f4226-232与其他同源序列匹配较多。对于这些匹配较多的拟保守表位,替换其中少数不同氨基酸可研发相关疾病的广谱性表位。
Warris A. The biology of pulmonary aspergillus infections [J]. J Infect, 2014, 69(Suppl 1): S36-S41.
[2]Chabi ML, Goracci A, Roche N, Paugam A, Lupo A, Revel MP. Pulmonary aspergillosis [J]. Diagn Interv Imaging, 2015, 96(5): 435-442.
[3]廖万清.侵袭性真菌感染的实验室诊断 [J].检验医学,2010,25(7):503-506.
[4]Sarfati J, Monod M, Recco P, Sulahian A, Pinel C, Candolfi E, Fontaine T, Debeaupuis JP, Tabouret M, Latgé JP. Recombinant antigens as diagnostic markers for aspergillosis [J]. Diagn Microbiol Infect Dis, 2006, 55(4): 279-291.
[5]Kurup VP, Banerjee B, Hemmann S, Greenberger PA, Blaser K, Crameri R. Selected recombinant Aspergillus fumigatus allergens bind specifically to IgE in ABPA [J]. Clin Exp Allergy, 2000, 30(7): 988-993.
[6]Kurup VP, Barrios CS, Johnson BD, Fink JN. Intragastric curcumin downregulates aspergillus antigen induced Th2 response in a murine model of allergic aspergillosis [J/OL]. J Allergy Clin Immunol, 2006. http://www.sciencedirect.com/science/article/pii/S0091674905035244.
[7]高岩,霍克克,季朝能,唐海平,徐万祥,谢毅,顾少华.烟曲霉Asp f3和Asp f4的表达纯化与多克隆抗体的制备 [J].复旦学报(自然科学版),2015,54(5):601-608.
[8]薛冰,高锦阳,唐海平,王健,谢毅,徐万祥,顾少华. HPV58型E1~E4蛋白的表达纯化和多克隆抗体的制备[J]. 生殖与避孕, 2012, 32(7): 433-437.
[9]Guinea J, Bouza E. Current challenges in the microbiological diagnosis of invasive aspergillosis [J]. Mycopathologia, 2014, 178(5/6): 403-416.
[10]Tǎnase A, Colitǎ A, Coriu D, Orban C, Barbarii L, Streinu-Cercel A. Invasive aspergillosis in hematology malignancies—a disease difficult to diagnose [J]. Rev Romana Med Lab, 2012, 20(1): 7-14.
[11]Chung CY, Seo H, Sonntag KC, Brooks A, Lin L, Isacson O. Cell type-specific gene expression of midbrain dopaminergic neurons reveals molecules involved in their vulnerability and protection [J]. Hum Mol Genet, 2005, 14(13): 1709-1725.
[12]Xu WX, He YP, Tang HP, Jia XF, Ji CN, Gu SH, Sun XX, Xie Y. Minimal motif mapping of a known epitope on human zona pellucida protein-4 using a peptide biosynthesis strategy [J]. J Reprod Immunol, 2009, 81(1): 9-16.
[13]吴敬,吴梧桐.B细胞蛋白质抗原表位的研究方法进展 [J].药物生物技术,2000,7(4):239-242.
Identification of minimal motifs of linear B cell epitope on Asp f3 and Asp f4 ofAspergillusfumigatus
SHI Jing1,2, GAO Yan1,2, HUO Keke1, JI Chaoneng1,2, TANG Haiping3, XU Wanxiang3, XIE Yi1,2, GU Shaohua1,2
1. State Key Laboratory of Genetic Engineering, School of Life Sciences, Fudan University, Shanghai 200438, China; 2. Shanghai Engineering Research Center of Industrial Microorganisms, Shanghai 200438, China; 3. National Population and Family Planning Key Laboratory of Contraceptive Drugs and Devices, Shanghai Institute of Planned Parenthood Research, Shanghai 200032, China
Aspergillusfumigatus(A.fumigatus) is a widespread opportunistic pathogen. The conidia produced byA.fumigatusare colonized in lungs after inhalation, leading to aspergilloma, allergic bronchopulmonary aspergillosis (ABPA) and invasive aspergillosis (IA). Currently, 1,3-β-D-glucan and galactomannan are used as serum immunological indexes for clinical diagnosis ofA.fumigatusinfection. Asp f3 and Asp f4 are two of the major antigens ofA.fumigatus, and the corresponding circulating antibodies are present in the sera of infected persons. In this study, anti-Asp f3 and anti-Asp f4 rabbit sera were used to carry out antigen epitope scanning. Eight Asp f3 and six Asp f4 minimal motifs were identified. These identified minimal motifs can be used for constructing chimera antigens to improve the specificity and sensitivity of the diagnosis forA.fumigatusinfection.
Aspergillusfumigatus; Asp f3; Asp f4; Linear B cell epitope; Minimal motif
国家重点基础研究发展计划(2013CB531603),上海市科学技术委员会项目(13DZ2252000)
顾少华
Corresponding author. GU Shaohua, E-mail: shaohuagu@fudan.edu.cn
2016-05-06)

