HPLC-MS/MS法同时检测鸡肉中的氯霉素和地塞米松
孙清荣,郭礼强(.山东科技职业学院,山东潍坊6053;.潍坊出入境检验检疫局,山东潍坊604)
HPLC-MS/MS法同时检测鸡肉中的氯霉素和地塞米松
孙清荣1,郭礼强2
(1.山东科技职业学院,山东潍坊261053;2.潍坊出入境检验检疫局,山东潍坊261041)
建立了鸡肉中氯霉素和地塞米松残留量的高效液相色谱-串联质谱的测定方法。样品经乙酸乙酯提取氮气吹干,正己烷脱脂后再经乙酸乙酯反提取净化,经ZORBAX Eclipse Plus C18(1.7 μm,3.0 mm×100 mm)柱分离,最后经电喷雾离子化(ESI±)以多反应离子监测方式(MRM)内标法定量检测。氯霉素和地塞米松的线性范围分别为0.10 ng/ mL~40.0ng/mL和0.20ng/mL~40.0ng/mL,相关系数均不低于0.99;其定量下限分别为0.10 μg/kg和0.20 μg/kg,方法平均回收率分别为93.6%~102.2%之间和90.3%~95.8%,批内和批间相对标准偏差(RSD)不高于5%。
串联四级杆/线性离子肼质谱;鸡肉;氯霉素;地塞米松
2012央视曝光了“速生鸡”事件,养殖户为追求利益,违规超量使用抗生素和激素,从而进一步引起人们对食品安全的关注。氯霉素是一种抑菌类合成抗生素,因对革兰氏阳性菌和革兰氏阴性菌具有很强的活性,而表现出广谱的抗菌能力,广泛地应用于动物养殖业。由于氯霉素类抗生素能导致人体产生严重的再生不良性贫血[1],欧盟、美国等对氯霉素的使用主要限定在外用,不得用于畜牧养殖业中,动物源性食品中氯霉素的最高残留限量为0.1 μg/kg,虽然在动物体内残留量低,但毒副作用依然存在。地塞米松属于合成的糖皮质激素[2],具有抗炎、抗过敏和抗休克等作用,主要作为危重疾病的急救用药和各类炎症的治疗。由于其能提高饲料转化率,促进畜禽生长,在畜牧生产中使用广泛。过量使用该类激素有很大的副作用,如创口愈合不良、痤疮或股骨头缺血性坏死、骨质疏松及儿童生长受到抑制、青光眼、白内障等。动物生长过程中过量使用氯霉素和地塞米松会导致其在动物源性食品中的残留,由食物链进而影响人类健康。因此,开展鸡肉中氯霉素和地塞米松的检测方法具有重要意义。
目前国内外关于氯霉素和地塞米松药物的残留检测方法主要采用高效液相色谱法[3-8]、气相色谱-质谱法[9-10]、液相色谱-串联质谱法[11-15],但由于鸡肉基质干扰较大,氯霉素和地塞米松性质的差异,同时进行样品处理经质谱法检测鲜见报道。本文利用高效液相色谱串联四级杆/线性离子肼质谱的高选择性、快速正负切换和强抗干扰能力等特点,建立了鸡肉中氯霉素和地塞米松残留的快速定性定量检测方法,能满足鸡肉进出口检测和国家药物残留监控的要求。
1 材料与方法
1.1仪器与试剂
高效液相色谱-线性离子阱质谱联用仪 [AB eksigent ultra LC 100-XL/Qtrap 5500,配电喷雾离子源(ESI),工作站Analyst1.6.1]:美国AB公司;电子天平[AB135-S(0.01 mg)和PL202-L(0.01 g)各一台]:英国Liselotte Mettler公司;离心机(5810型):德国Eppendorf公司;移液器(100-1 000 μL):德国Eppendorf公司;均质器(T25型,18G刀头):德国IKA公司;振荡器(MMV-1000W):ETELA公司;氮吹仪(N-EVAP):美国Organomation Associates公司;涡流混匀器(MS3 basic):德国IKA公司。
氯霉素和氯霉素-D5标准品(德国Laboratories of Dr.Ehrenstorfer公司,纯度≥98%,批号:201312);地塞米松标准品(美国Sigma-Aldich公司,纯度≥98.5%,批号:201207),做氯霉素内标使用。
甲基强的松龙标准品(美国DON公司,纯度≥98%,批号:201309),做地塞米松内标使用;甲醇为色谱纯;乙酸乙酯和正己烷为分析纯。
1.2标准溶液的配制
1)精密称取氯霉素、氯霉素-D5、地塞米松、甲基强的松龙标准品各10 mg,置100 mL量瓶中,甲醇溶解,定容。分别制成浓度为100 μg/mL的标准储备液;甲基强的松龙用丙酮溶解配成浓度为100 μg/mL的标准储备液。于4℃冰箱中放置,备用。
2)用移液器分别移取1 mL氯霉素、氯霉素-D5、地塞米松和甲基强的松龙储备液用甲醇定容至100 mL,分别配成浓度为1 μg/mL的中间储备液;
3)分别移取氯霉素中间储备液1 mL到100 mL容量瓶,地塞米松中间储备液2 mL到100 mL容量瓶,用甲醇定容至100 mL,混标工作液中氯霉素浓度为10 ng/mL,地塞米松浓度为20 ng/mL;分别移取氯霉素-D5中间储备液2 mL到100 mL容量瓶,甲基强的松龙中间储备液4 mL,用甲醇定容至100 mL,氯霉素-D5浓度为20ng/mL、甲基强的松龙浓度为40ng/mL。
试验中用甲醇配制混合标准溶液,氯霉素标准品终浓度为0、0.10、0.50、2.0、10.0、40.0 ng/mL,氯霉素-D5终浓度为2.0 ng/mL;地塞米松标准品终浓度为0、0.20、0.50、2.0、10.0、40.0 ng/mL,甲基强的松龙终浓度为4.0 ng/mL。
1.3提取
精密称取(10±0.01)g鸡肉样品于具塞离心管中,各样品管加入内标混合标准工作液100 μL,加标回收管再加入100 μL外标工作液。各管加入15 mL乙酸乙酯均质,28 000 g离心10 min,上清液移入30 mL做好标记的玻璃管;具塞离心管重新加入15 mL乙酸乙酯重复以上操作,合并上清液氮气吹干。在玻璃管中各添加5 mL正己烷和5 mL水,涡混1 min,去除上层溶液;若下层溶液不干净,重复操作1次。各管添加5 mL乙酸乙酯,涡混1 min,取上层溶液到10 mL玻璃管氮气吹干。用甲醇-水(3∶7,体积比)定容到1 mL,过0.22 μm的滤膜后待用。
1.4试验方法
采用内标法定量,分别以氯霉素-D5为内标物测定氯霉素的含量;甲基强的松龙为内标物测定地塞米松的含量。
1.5仪器参数与测定条件
1.5.1液相色谱条件
色谱柱:ZORBAX Eclipse Plus C18(1.7 μm,3.0× 100 mm);柱温:40℃,流速:0.4 mL/min,进样量:10 μL;流动相:A纯水,B甲醇,梯度洗脱程序:0→2.0 min,由15%B→85%B;2.0→3.5 min,85%B;3.6 min,15%B,平衡2.4 min。
1.5.2质谱条件
电离方式:ESI±;扫描方式:多反应监测(MRM);干燥气温度:450℃;GAS1:55 L;GAS2:60 L;电子倍增器电压:4 500 V;碰撞气:高纯氮,99.99%,4种化合物质谱参数见表1。
2 结果与讨论
2.1质谱条件的建立和优化
为摸索最佳质谱条件,减少仪器干扰和污染,配制混合标准品氯霉素和地塞米松含量在50 ng/mL,控制信号强度在106范围内,采用针泵直接进质谱方法筛选条件,流速20 μL/min,根据文献资料[16],先在负离子模式进行扫描查找氯霉素和氯霉素-D5母离子,找出后对其子离子进行全扫描,通过优化碎裂电压和碰撞能量,找出丰度较强的碎片离子,组成监测离子对。将扫描模式改为正离子模式,重复以上操作找到地塞米松和甲基强的松龙的监测离子对。以纯水和甲醇作为流动相,设定优化液相条件数据见图1。
在上述色谱和质谱条件下,氯霉素(0.10 ng/mL)和地塞米松(0.20 ng/mL)能够分离良好,且峰形很好,在空白组织中未见干扰。

表1 氯霉素和地塞米松的质谱采集参数Table 1 Mass spectrometric acquisition parameters of chloramphenicol and dexamethasone
2.2提取和净化条件的选择
氯霉素和地塞米松等属于极性物质,可以通过有机溶剂进行提取。由于鸡肉中含有大量的蛋白质、氨基酸、脂肪等符合组分,基质复杂,本研究考察了甲醇、乙腈、丙酮、乙酸乙酯4种溶剂对氯霉素和地塞米松的提取回收率的影响,结果见图2。

图1 氯霉素和地塞米松标准溶液内、外标和鸡肉空白样品的提取离子色谱图Fig.1 Extracted ion chromatograms of chloramphenicol and dexamethasone in standard solution,internal standard solution and blank chicken samples
结果证明,乙酸乙酯的提取效率最高,两种药物的提取回收率达到了90%以上,适合鸡肉组织中氯霉素和地塞米松的提取。鸡肉基质中非极性脂类物质较多,基质干扰较大,影响结果的判定,经过多次试验比较,最终选定用乙酸乙酯萃取两次,氮气吹干后加水溶解再用正己烷脱脂,再次用乙酸乙酯反提取,氮气吹干过滤膜后经质谱检测,空白基质加标回收率在90%~107%之间。以本试验开发的方法可以有效去除基质干扰,省去了固相萃取柱的使用,节约了费用,可以同时对氯霉素和地塞米松进行提取纯化,减少了样品前处理的时间和成本,可以满足日常监测的要求。

图2 不同提取溶剂时氯霉素和地塞米松的回收率Fig.2 Recoveries of chloramphenicol and dexamethasone using different extraction solvents
2.3线性范围、检出限、定量下限
在优化的色谱条件下对所配制的系列浓度的混合标准溶液进行测定,从低浓度到高浓度依次进样,以测得的化合物峰面积的比值(氯霉素峰面积/氯霉素-D5峰面积或地塞米松峰面积/甲基强的松龙峰面积)Y为纵坐标,标准溶液的质量浓度X(ng/mL)为横坐标,绘制标准曲线,两种化合物的线性范围、回归方程和相关系数如表2所示。在空白鸡肉基质中添加混合标准品,调整适合的浓度,以3倍的信噪比计算方法的检出限(LOD);10倍的信噪比计算方法的定量下限(LOQ),两种化合物的检出限和定量下限见表2。

表2 氯霉素和地塞米松的回归方程、相关系数、检出限和定量限(n=6)Table 2 Linear equation,correlation coefficients(r),limits of detection(LOD)and limits of quantitation(LOQ)of chloramphenicol and dexamethasone(n=6)
从表2可知,所有指标都符合我国和欧盟的残留检测标准。
2.4回收率和精密度
选取阴性鸡肉样品,添加氯霉素和地塞米松混合标准品,对鸡肉基质进行了6天次添加回收率重复试验,氯霉素的3个添加浓度分别为0.1、0.2.1.0 μg/kg,地塞米松的3个添加浓度分别为0.2、0.4、2.0 μg/kg,每次每个浓度点重复试验6次。结果表明,鸡肉基质中氯霉素平均添加回收率在93.6%~102.2%之间,批内相对标准偏差(RSD)在2.7%~4.5%之间,批间RSD 在3.1%~4.7%之间;鸡肉基质中地塞米松平均添加回收率在90.3%~95.8%之间,批内相对标准偏差(RSD)在3.1%~4.3%之间,批间RSD在3.7%~4.6%之间,两种化合物的回收率和RSD见表3。
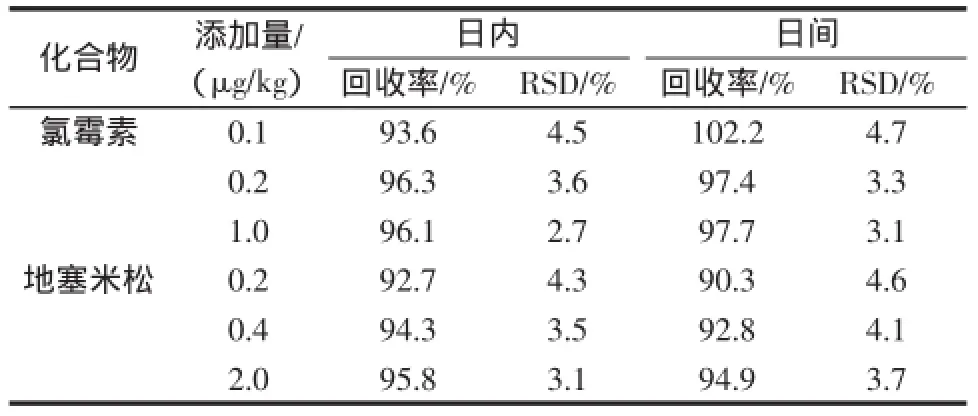
表3 阴性鸡肉样品中添加氯霉素和地塞米松的加标回收率和精密度(n=6)Table 3 Spiked recoveries and RSDs of chloramphenicol and dexamethasone in chicken samples(n=6)
2.5实际样品的检测
应用本方法对200个鸡肉样品同时进行氯霉素和地塞米松检测,其中1个样品中的氯霉素残留量为0.16 μg/kg,达到了欧盟进口的限量标准,阳性率为0.5%;地塞米松未检出。但上述样品的药物残留量均小于国家残留监控的限量要求,结果见图3。
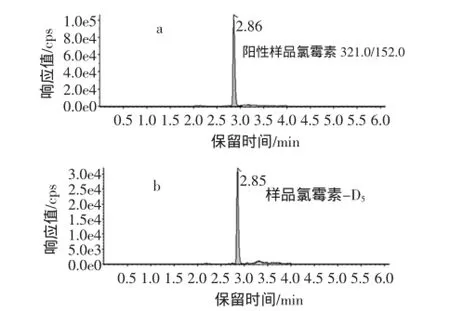
图3 氯霉素和地塞米松阳性样品的提取离子色谱图Fig.3 Extracted ion chromatograms of chloramphenicol and dexamethasone in positive chicken samples
3 结论
本文建立了鸡肉中氯霉素和地塞米松残留同时测定的串联四级杆/线性离子肼质谱的分析检测方法。该方法提高了方法定性定量的准确性,操作简便,省去了固相萃取步骤,灵敏度和回收率好,可满足实际检测工作的需要。
[1]Turton J A,Havard A C,Robinson S,et al.An assessment of chloramphenicol and thiamphenicol in the induction of aplastic anaemia in the BALB/c mouse[J].Food Chem Toxicol,2000,38:925-938
[2]李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:589
[3]唐军,郑志伟,方焱,等.高效液相色谱法同时测定氯地乳膏中氯霉素与地塞米松的含量及其稳定性研究[J].安徽医药,2007,11 (4):298-300
[4]Iqbal M S,Shad M A,Ashraf M W,et al.Detection of Exposure to Environmental Pesticides During Pregnancy by the Analysis of Maternal Hair Using GC-MS[J].Chromatographia.2006,64(3/4):219-222
[5]卢艳芬,周莹,丑亚琴,等.固相萃取-高效液相色谱法测定畜禽肉中氯霉素残留量[J].中国卫生检验杂志,2008,18(1):57-59
[6]张利平,林伟萍,陈健苗,等.高效液相色谱法测定氯霉素地塞米松乳膏中两组分含量[J].中国药业,2008,17(15):26-27
[7]Bourdon F,Lecoeur M,Odou P,et al.Complementarity of UV-PLS and HPLC for the simultaneous evaluation of antiemetic drugs[J]. Talanta,2014,120:274-282
[8]Heda A A,Kathiriya J M,Gadade D D,et al.Development and Validation of RP-HPLC Method for Simultaneous Determination of Granisetron and Dexamethasone[J].Indian J Pharm Sci,2011,73(6):696-699
[9]Wang C,He L,Wang N,et al.Screening anti-inflammatory components from Chinese traditional medicines using a peritoneal macrophage/cell membrane chromatography-offline-GC/MS method [J].J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(27):3019-3024
[10]谢孟峡,刘媛,邱月明,等.固相萃取-气相色谱质谱测定动物组织中氯霉素的残留量[J].分析化学,2005,33(1):1-4
[11]Sheridan R,Policastro B,Thomas S,et al.Analysis and occurrence of 14 sulfonamide antibacterials and chloramphenicol in honey by solid-phase extraction followed by LC/MS/MS analysis[J].Jagric Food Chem,2008,56(3):3509-3516
[12]Garza-Ocañas L,Badillo-Castañeda C T,Montoya-Eguía S L,et al. Dexamethasone and diclofenac by LC-MS-MS as herbal product adulterants[J].Salud Publica Mex,2013,55(5):498-504
[13]侯亚莉,徐飞,李海燕,等.液相色谱-电喷雾串联四极杆质谱法同时测定牛肉中地塞米松、倍他米松和倍氯米松残留[J].中国农学通报,2008,24(1):127-131
[14]Deceuninck Y,Bichon E,Monteau F,et al.Fast and multiresidue determination of twenty glucocorticoids in bovine milk using ultra high performance liquid chromatography-tandem mass spectrometry [J].J Chromatogr A,2013,1294:76-86
[15]Li L,Ma P,Wei J,et al.LC-ESI-MS method for the determination of dexamethasone acetate in skin of nude mouse[J].J Chromatogr B Analyt Technol Biomed Life Sci,2013,933:44-49
[16]冯民,魏云计,朱臻怡,等.高效液相色谱-串联质谱法同时测定饲料中氯霉素、甲砜霉素与氟甲砜霉素残留量[J].分析测试学报,2013,32(1):117-121
Simultaneous Determination of Chloramphenicol and Dexamethasone in Chicken by HPLC-MS/MS
SUN Qing-rong1,GUO Li-qiang2
(1.Shandong Vocational College of Science and Technology,Weifang 261053,Shandong,China;2.Weifang Entry-Exit Inspection and Quarantine Bureau,Weifang 261041,Shandong,China)
A method for the determination of chloramphenicol and dexamethasone in chicken was developed using high performance liquid chromatography coupled tandem quadrupole linear ion trap mass spectrometry. The target analytes were extracted with ethyl acetate,and evaporated to dryness.The extracts were defatted with hexane and extracted by ethyl acetate again.chloramphenicol and dexamethasone were detected with electrospray ionization in both positive and negative modes using multiple reaction monitoring,and quantified by the internal standard method after separation through ZORBAX Eclipse Plus C18(1.7 μm,3.0 mm×100 mm).With the optimal conditions,the calibration curves of chloramphenicol and dexamethasone were linear in the ranges of 0.10 ng/mL-40.0 ng/mL and 0.20 ng/mL-40.0 ng/mL,and correlation coefficients no less than 0.99.The limits of quantitation(LOQs)were 0.1μg/kg and 0.2μg/kg respectively.The average recoveries of chloramphenicol and dexamethasone were ranged from 93.6%to 102.2%and 90.3%to 95.8%respectively with both RSD not more than 5%.
tandemquadrupolelineariontrapmassspectrometry;chicken;chloramphenicol;dexamethasone
10.3969/j.issn.1005-6521.2016.15.038
潍坊市2015年科学技术发展计划(2015ZJ1101);科技部星火计划(2014GA740082)
孙清荣(1970—),女(汉),副教授,硕士,研究方向:分析检测。
2015-02-17

