蚕蛹虫草片剂对体液免疫和细胞免疫功能的影响
张 岚,王 丹,聂晶石
(1.吉林医药学院公共卫生学院,吉林吉林 132013;2.吉林省中医药管理局二级实验室,吉林吉林 132013;3.吉林省敦化市蚕业科技发展有限责任公司,吉林敦化 133700)
蚕蛹虫草片剂对体液免疫和细胞免疫功能的影响
张岚1,2,王丹1,2,聂晶石3
(1.吉林医药学院公共卫生学院,吉林吉林 132013;2.吉林省中医药管理局二级实验室,吉林吉林 132013;3.吉林省敦化市蚕业科技发展有限责任公司,吉林敦化 133700)
本文研究了蛹虫草片剂对小鼠体液免疫和细胞免疫功能影响。将雄性ICR小鼠随机分为I、II、III三个大组,每大组随机分为阴性对照组、蛹虫草低(0.167 g/kg·bw)、中(0.333 g/kg·bw)、高(0.999 g/kg·bw)剂量组,每组10 只。每天灌胃一次,连续30 d。分别进行淋巴细胞转化实验、迟发型变态反应实验、并测定抗体生成细胞及血清溶血素。结果表明,与阴性对照组相比,蛹虫草片剂对ConA诱导小鼠的体重,脾脏/体重比值,胸腺/体重比值无显著性影响(p>0.05)。蛹虫草中、高剂量组对ConA诱导小鼠细胞免疫调节有显著性影响(p<0.05);蚕蛹虫草对小鼠体液免疫功能也具有一定调节作用,蛹虫草低、中、高剂量组对抗体生成细胞作用均有显著性影响(p<0.05),且中、高剂量组对HC50值影响有显著性影响(p<0.05)。说明一定剂量的蛹虫草片具有调节机体免疫能力,也为蛹虫草片剂对小鼠免疫调节机制研究奠定基础。
蛹虫草片剂,体液免疫,细胞免疫
蛹虫草(Cordycepsmilitaris,CM)指寄生于鳞翅目昆虫蛹体后能形成虫菌复合体的真菌,也是人们通常所说的北冬虫夏草,多出现在北半球的大部分地区[1]。与冬虫夏草都属于虫草属,但是属于不同种类的药用真菌。蛹虫草对于寄主和生存环境并没有严格的要求[2],加之蛹虫草已实现大规模人工栽培,使其逐渐成为野生冬虫夏草的替代品,由于具有极高的营养价值和保健功效,已被越来越多的消费者所接受[3]。蛹虫草中目前已被确定的药理学活性成分有多种,这其中包括虫草素,虫草氨基酸,多糖,大环内脂类和麦角甾醇等[4]。虫草素属于核苷类物质,是蛹虫草中的主要活性物质之一,也是虫草中含量最大的脱氧核苷类物质。科研人员曾从蛹虫草的培养液中分离得到虫草素[5],研究发现虫草素能够促进细胞分化、增强某些细胞株的抗肿瘤活性和巨噬细胞系的趋化性,具有调节机体免疫、抗病毒、抗肿瘤等药理作用[6]。蛹虫草中含有丰富的蛋白质和多肽,在实验动物和人体中,很多具有生物活性的蛋白质具有抗肿瘤作用[4]。另外,蛹虫草多糖也已经被证明具有增强免疫系统、延缓衰老、抗肿瘤、抗辐射、降血糖等功能作用[7]。许多研究倾向于蛹虫草多糖的分离纯化,尤其针对不同部位多糖含量的研究[8],研究证明蛹虫草多糖能够潜在调节免疫反应[9]。此外,蛹虫草中富含多达30种的微量元素,其中硒是一种极其重要的元素,硒的缺乏会引发机体发生多种疾病。经过富硒培养,蛹虫草可将无机硒转变为有机硒,提高其药用价值。综上可以看出关于蛹虫草单一成分的功效作用研究较多,但是关于蛹虫草的免疫作用报道较少。目前许多慢性疾病的发生都与机体免疫力下降有直接关系,而在日常生活中通过饮食提高机体免疫力至关重要。而蛹虫草中含有多种活性成分,本实验室前期利用蛹虫草的活性成分以其为原料开发蛹虫草片保健食品,本论文将进一步研究蛹虫草片对机体免疫力的作用,研究其增强免疫力生理活性的作用机理,为其应用于临床实践,实现蛹虫草对多种疾病的靶向治疗奠定基础。
1 材料与方法
1.1材料与仪器
柞蚕蛹虫草粉敦化市蚕业科技发展有限责任公司提供。
RPM1640细胞培养液,小牛血清,MTT上海研瑾生物有限公司;刀豆蛋白A(ConA),Hank’s液上海抚生酶联试剂公司;绵羊红细胞北京博尔西科技有限公司;补体C豚鼠血清郑州百基生物科技有限公司;SA缓冲液百浩天生物科技有限公司;台酚蓝染色液北京美科美生物技术开发有限公司;异丙醇、生理盐水南京安培化工科技有限公司;琼脂糖上海江莱生物科技有限公司;行知生物科技有限公司。
二氧化碳培养箱上海智城;酶标仪美国伯腾;721分光光度计上海精科;离心机美国贝克曼库尔特;手持式细胞计数器美国默克密理博。
1.2实验方法
1.2.1蚕蛹虫草片剂制备

1.2.2实验动物分组及给药方式清洁级雄性ICR小鼠160只,体重为18~22 g,由吉林大学实验动物中心提供,实验动物生产许可证号SCXK(吉)-2011-0004。将动物分为I、II、III、Ⅳ四个大组,每大组40只动物。免疫I 组进行ConA 诱导的小鼠淋巴细胞转化实验;免疫II组进行迟发型变态反应实验;免疫III组半数溶血值(HC50)的测定;免疫Ⅳ组抗体生成细胞数测定。每大组又随机分为阴性对照组、蛹虫草低、中、高剂量组,每组10 只小鼠。实验组给药剂量分别按人体推荐量的2.0 g/60 kg·bw(折算成人的每公斤体重剂量0.0333 g/kg·bw),5倍(0.1665 g/kg·bw)为低剂量组,10倍(0.3333 g/kg·bw)为中剂量组,30倍(0.9999 g/kg·bw)为高剂量组。每天灌胃一次,灌胃容积0.1 mL/10 g·bw,每三天称一次体重,连续给药30 d,阴性对照组灌胃同体积的蒸馏水。小鼠培养条件为:室温20~24 ℃,湿度50%~70%。
1.2.3蚕蛹虫草片剂对小鼠细胞免疫功能作用
1.2.3.1蚕蛹虫草片剂对ConA诱导小鼠脾淋巴细胞转化实验(MTT法)无菌取脾,置于无菌Hank’s液内,制成单个细胞悬液。经过200目筛网过滤,用Hank’s液洗2次,每次在1000 r/min下离心10 min,然后将细胞悬浮于1 mL的完全培养液中,用台酚蓝染色计数活细胞数(95%以上),调整细胞浓度为3×106个/mL。淋巴增殖反应:将每一只小鼠脾细胞悬浮液分两孔加入24孔培养板中,每孔1 mL,一孔加75 μL ConA液,另一孔作为对照孔,加培养液75 μL,置于50% CO2,37 ℃孵箱中培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI 1640培养液,同时加入MTT 50 μL/孔,继续培养4 h,培养结束后,每孔加入1 mL 酸性异丙醇,吹打混匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔200μL,作3个平行,用酶标仪,以570 nm 波长测定光密度值。受试样品的光密度值显著高于对照组的光密度值,可判定该项实验结果呈阳性。
淋巴细胞的增殖能力=ConA孔的光密度值-不加ConA孔的光密度值
1.2.3.2蚕蛹虫草片剂对小鼠迟发型变态反应(DTH)的影响每只小鼠用2%(v/v)绵羊红细胞(SRBC)腹腔免疫,每只鼠注射0.2 mL(约为1×108个SRBC)。免疫后4 d,测量左后足趾部厚度,然后在测量部位皮下注射2%(v/v)SRBC,每只鼠20 μL(约为1×108个SRBC),注射后24h测量左后足趾部厚度,同一部位测量三次,取平均值。结果以攻击前后足趾厚度的差值来表示DTH的程度,受试样品组的差值显著高于对照组的差值,可判定该项实验结果呈阳性。
1.2.4蚕蛹虫草片剂对小鼠体液免疫功能作用
1.2.4.1蚕蛹虫草片剂对抗体生成细胞的检测(Jerne改良玻片法)将1 mL压积SRBC加入到5 mL豚鼠血清中,4 ℃冰箱放置30 min,每隔几分钟振荡一次,离心上清,分装后于-70 ℃保存。同时以SA缓冲液按1∶8稀释,在清洁玻片上刷一薄层琼脂粉,干后保存备用。将压积SRBC用生理盐水制成2%(v/v)的细胞悬浮液,每只鼠腹腔注射0.2 mL。在实验结束前5 d后的小鼠颈椎脱臼处死,取出脾脏,放在盛有Hank’s液的小平皿内,轻轻磨碎脾脏,制成细胞悬液,经200目筛网过滤,1000 r/min离心10 min,用Hank’s液洗2次,最后将细胞悬浮液在5 mL RPMI 1640培养液中,计算细胞将细胞浓度调整为5×106个/mL。将表层培养基加热溶解后,放于45 ℃水浴保温,与等量pH7.2,2倍浓度的Hank’s液混合,分装小试管,每管0.5 mL,再向管内加50 μL 10% SRBC(v/v用SA缓冲液配制)20 μL脾细胞悬液(5×106个/mL)迅速混匀倾倒于刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平在片架上,放入二氧化碳培养箱中孵育1.5 h,然后用SA缓冲液稀释剂(1∶8),加入到玻片架凹槽内,继续温育1.5 h后,计数溶血空斑数。用空斑数/106脾细胞来表示,受试样品组的空斑数显著高于对照组的空斑数。
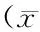
表2 蚕蛹虫草片剂对ConA诱导小鼠脾淋巴细胞转化的影响±SD,n=10)Table 2 Effect of CM on the spleen lymphocyte proliferation in ConA-treated ±SD,n=10)
1.2.4.2蚕蛹虫草片剂对血清溶血素的测定将1 mL压积SRBC加入到5 mL豚鼠血清中,放4 ℃冰箱30 min,每隔几分钟振荡一次,离心取上清,分装,-70 ℃保存。用时以SA液按1∶8稀释。将压积SRBC用生理盐水配成2%的细胞悬浮液,每只小鼠腹腔注射0.2 mL进行免疫,5 d后,摘除眼球取血于离心管内,放置1 h,使血清充分析出,2000 r/min离心10 min,收集血清。取血用SA缓冲液稀释200倍,将稀释后的血清1 mL置试管内,依次加入10%(v/v)SRBC 0.5 mL,补体1 mL(用SA液按1∶8稀释)。另设不加血清的对照管(以SA缓冲液代替)。置于37 ℃恒温水浴中体温30 min后,冰浴终止反应,2000 r/min离心10 min。取上清液1 mL,加都氏试剂3 mL,同时取10%(v/v)SRBC 0.25 mL加都氏试剂至4 mL,充分混匀,放置10 min后,于540 nm处以对照管作空白,分别测定各管光密度值。溶血素的量以半数溶血值(HC50)表示,按下列公式计算,受试样品组的HC50显著高于阴性对照组的HC50,可判定该项实验结果阳性。
HC50=(样品光密度值/SCBC半数溶血时间的光密度值)×稀释倍数
2 结果与讨论
2.1蚕蛹虫草片剂对小鼠脏器系数影响
胸腺的主要功能是产生T淋巴细胞和分泌胸腺素,主要参与细胞免疫;脾脏中有丰富的淋巴细胞和巨噬细胞,但B淋巴细胞比例较大,因此与体液免疫关系更为密切[10]。胸腺和脾脏指数的高低取决于其中淋巴细胞增殖的程度,在一定程度上能够反映机体免疫功能的强弱。胸腺指数降低,机体免疫功能也会下降[11]。表1表明蚕蛹虫草片剂量组对ConA诱导小鼠的体重,脾脏/体重比值,胸腺/体重比值的影响情况。与阴性对照组相比,蚕蛹虫草片剂量组小鼠体重、脾脏/体重比值与胸腺/体重比值变化均不显著(p>0.05)。说明蛹虫草片剂对于小鼠的体重,脾脏/体重比值,胸腺/体重比值的影响较小。可见蚕蛹虫草片剂对ConA诱导小鼠脏器系数调节作用并不明显。
表1蚕蛹虫草片剂对ConA诱导

Table 1Effect of CM on the internal organ indices of
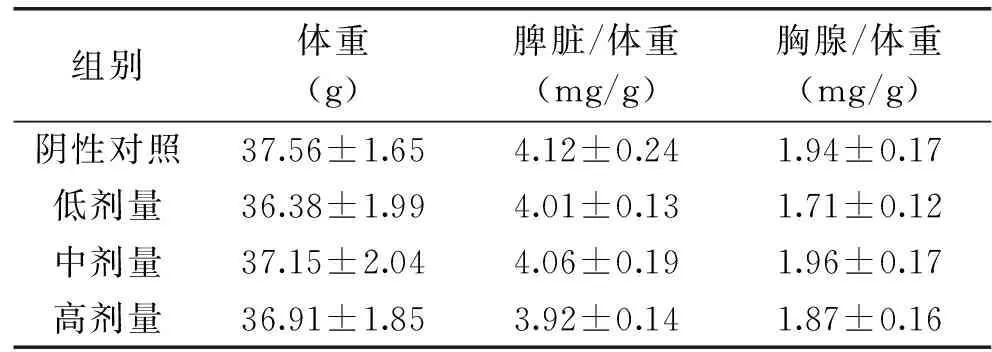
组别体重(g)脾脏/体重(mg/g)胸腺/体重(mg/g)阴性对照37.56±1.654.12±0.241.94±0.17低剂量36.38±1.994.01±0.131.71±0.12中剂量37.15±2.044.06±0.191.96±0.17高剂量36.91±1.853.92±0.141.87±0.16
注:*表示与阴性对照组相比有显著差异,p<0.05,表2~表4同。
2.2蚕蛹虫草片剂对ConA诱导小鼠脾淋巴细胞转化实验
蚕蛹虫草片剂对ConA诱导小鼠脾淋巴细胞转化的影响见表2。
表2表明蚕蛹虫草对ConA诱导小鼠脾淋巴细胞转化影响。光密度值能够反映淋巴细胞增殖程度。与阴性对照组相比,蛹虫草低剂量组对ConA诱导小鼠脾淋巴细胞转化无显著性影响(p>0.05),蛹虫草中高剂量组具有差异显著性(p<0.05),由此可见,中高剂量组可判定实验结果呈阳性。随着蛹虫草剂量的增加,小鼠脾淋巴细胞转化程度逐渐增加。淋巴细胞转化实验能够反映蛹虫草免疫活性机制[12]。相关研究报道黄芪多糖对脾淋巴细胞免疫功能的作用机制是通过改变细胞内信息分子NO、Ca2+及cAMP、cGMP来实现的[13]。因此可以说明脾淋巴细胞转化与细胞内部信号分子密切相关。另外,研究报道蛹虫草多糖能够显著刺激小鼠脾细胞增殖[14]。Wang等人研究报道一定剂量的醇提蛹虫草多糖能显著促进淋巴细胞增殖,增强血清抗体滴度,提高血清中γ-干扰素及白细胞介素的浓度,蛹虫草多糖可以提高新城疫疫苗的免疫功效[15]。所以,蚕蛹虫草片剂对小鼠脾淋巴细胞转化影响可能与其中蛹虫草多糖成分有关,但是关于其对脾淋巴细胞转化的信号通路相关研究报道较少,有待于进一步研究,为蛹虫草相关保健品或者免疫辅助药物的开发奠定基础。
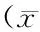
表3 蚕蛹虫草片剂对小鼠迟发型变态反应的影响±SD,n=10)Table 3 Effects of CM on delayed type hypersensitivity of ±SD,n=10)
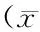
表4 蚕蛹虫草片剂对抗体生成细胞的影响±SD,n=10)Table 4 Effect of CM on quantity ofantibody forming cells of ±SD,n=10)
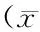
表5 蚕蛹虫草片剂对小鼠半数溶血值的影响±SD,n=10)Table 5 Effects of CM on hemolytic value(HC50)of ±SD,n=10)
2.3蚕蛹虫草片剂对小鼠迟发型变态反应(DTH)的影响
蚕蛹虫草片剂对小鼠迟发型变态反应(DTH)的影响。
绵羊红细胞可以刺激T淋巴细胞增殖成致敏淋巴细胞,4 d后再以绵羊红细胞攻击时,攻击部位会出现肿胀,其肿胀程度可反映迟发型变态反应程度,进而反应T淋巴细胞的增殖能力[16]。蚕蛹虫草中含有虫草素,研究发现虫草素能够抑制伴刀豆球蛋白诱导的脾细胞增殖,Th1和Th2细胞因子增殖,以及T细胞CD4+/CD8+[17]。表3实验结果表示蚕蛹虫草片剂对小鼠迟发型变态反应,随着蚕蛹虫草片剂剂量增加,小鼠左后足趾部厚度逐渐加厚。与阴性对照组相比,中、高剂量组的迟发型变态反应有显著性差异(p<0.05);低剂量组无显著性差异(p>0.05),由此可判断实验结果阳性。说明中高剂量蚕蛹虫草片可以刺激T淋巴细胞增殖。迟发型变态反应与淋巴细胞转化实验共同反应机体细胞免疫功能,两个实验中蛹虫草中、高剂量组均呈阳性,说明中、高剂量对小鼠细胞免疫功能具有显著调节作用。
2.4蚕蛹虫草片剂对抗体生成细胞的检测
蚕蛹虫草片剂对抗体生成细胞的检测见表3。
脾脏抗体形成反映了B细胞介导的免疫应答即体液免疫。应答是指在绵羊红细胞刺激下,抗原特异性B细胞活化增殖分化成熟为浆细胞,进而合成各类免疫球蛋白并产生免疫效应作用的应答过程。由表4结果显示,与阴性对照组相比,蚕蛹虫草片剂低、中、高剂量组空斑数升高,且差异具有显著性(p<0.05),随着蚕蛹虫草剂量的增加,空斑数量逐渐增加。可见蚕蛹虫草三个剂量组实验均呈阳性。说明蛹虫草能增强绵羊红细胞(SRBC)致敏的正常小鼠空斑形成细胞产生抗体的数量,也可以推断蛹虫草能促进IgM抗体生成,提高小鼠的体液免疫功能。
2.5蚕蛹虫草对小鼠半数溶血值的测定
蚕蛹虫草对小鼠半数溶血值的影响见表5。
用SRBC免疫小鼠后,血清中出现SRBC抗体,在补体参与下,与SRBC一起孵育,可以发生溶血反应,释放血红蛋白。通过测定血红蛋白含量反映动物血清中溶血素的含量,HC50可以定量地反映小鼠血清中溶血素抗体的生成量[18]。由表5可以看出蚕蛹虫草片剂量组小鼠半数溶血值高于阴性对照组,而且随着其剂量增加而逐渐增高。与阴性对照组比较,低剂量组小鼠半数溶血值与阴性对照组相比差异无显著性(p>0.05);中剂量组,高剂量组小鼠半数溶血值差异具有显著性(p<0.05),可以判定实验结果为阳性。半数溶血值与抗体生成细胞共同反应小鼠体液免疫变化。两者都呈阳性,说明蛹虫草片能明显提高实验小鼠体液免疫功能,具有很好调节作用。
3 结论
本实验通过研究蛹虫草片剂对小鼠免疫功能作用,结果表明,与阴性对照组相比,蚕蛹虫草片剂对ConA诱导小鼠的体重,脾脏/体重比值,胸腺/体重比值的影响差异无显著性差异(p>0.05)。通过小鼠脾淋巴细胞转化实验和迟发型变态反应实验发现,蚕蛹虫草对ConA诱导小鼠细胞免疫功能具有调节作用,尤其蚕蛹虫草中、高剂量组实验结果具有显著性差异(p<0.05)。通过测定血清溶血素HC50值和抗体生成细胞发现,蚕蛹虫草对小鼠体液免疫功能具有一定调节作用,其中蚕蛹虫草低、中、高剂量组对抗体生成细胞均具有显著性差异(p<0.05),而中、高剂量组对HC50值具有显著性差异(p<0.05)。综上所述,一定剂量的蛹虫草片对调节机体免疫能力具有很好的作用,同时也为减少相关疾病的发生奠定靶向作用,也为蛹虫草片剂对小鼠免疫调节机制研究奠定基础。
[1]Sung GH,Hywel-Jones NL,Sung JM,et al. Phylogenetic classification of Cordyceps and the clavicipitaceous fungi[J]. Stud Mycol,2007,57:5-59.
[2]全国中草药汇编编写组. 全国中草药汇编[M]. 北京:人民卫生出版社,2000.
[3]曾宏彬,宋斌,李泰辉. 蛹虫草研究进展及其产业化前景[J]. 食用菌学报,2011,18(2):70-74.
[4]卢丽丽. 蛹虫草活性组分的提取及其抗肿瘤效果的研究[D]. 杭州:浙江理工大学,2012.
[5]Cunningham K G ,Manson W.,Spring F S,et al. Cordycepin,a metabolic product isolated from cultures of Cordyceps militaris(Linn.)Link[J]. Nature,1950,166(4231):949.
[6]丁向萍,马力. 虫草素抗肿瘤机制研究进展[J]. 第四军医
大学学报,2009,30(8):764-766.
[7]荆添娇.蛹虫草发酵工艺的优化、口服液的制备及其活性研究[D]. 长春:吉林大学,2014.
[8]陈丹,韩建华,杨淑芳,等.柞蚕蛹虫草不同部位多糖含量的测定[J]. 食用菌,2014(5):62-63.
[9]Jong Seok Lee,Eock Kee Hong. Immunostimulating activity of the polysaccharides isolated from Cordyceps militaris[J]. InternationalImmunopharmacology,2011(11):1226-1233.
[10]张巍巍. 注射用重组人胸腺肽a1免疫药效学及抗肿瘤药效学的初步研究[D].长春:吉林大学,2007.
[11]鲍英存,张李峰,程卫东,等.含红芪与含黄芪玉屏风散含药血清对老龄小鼠脾淋巴细胞增殖和抗衰老作用的比较研究[J]. 中药药理与临床,2012,28(4):3-6.
[12]Mi Wang,Meng Xin-yu,Yang Rui-Le,et al. Cordyceps militaris polysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J]. Carbohydrate Polymers,2012(89):461-466.
[13]陈洪亮,禚宝山,李德发,等.黄芪多糖对肉鸡脾淋巴细胞转化及信息分子的影响[J]. 中国兽医杂志,2003,39(10):11-14.
[14]Jing Yong-shuai,Cui Xin-lu,Chen Zhi-yan . Elucidation and biological activities of a new polysaccharide from cultured Cordyceps militaris[J]. Carbohydrate Polymers,2014(102):288-296.
[15]Mi Wang,Xinyu Meng,Ruile Yang. Cordyceps militaris polysaccharides can improve the immune efficacy of Newcastle disease vaccine in chicken[J]. International Journal of Biological Macromolecules,2013(59):178-183
[16]杨海莺,刘爱萍,蒋菁莉. 双歧杆菌 BBMN01 体内免疫刺激功能研究[J]. 食品科学,2008,29(2):369-372.
[17]Ying Xiong,Zhang Shuang,Xu Lin-li . Suppression of T-cell activationinvitroandinvivoby cordycepin from Cordyceps militaris[J]. Journal of Surgical Research,2013,185(2):912-922
[18]E.V. Grizanova,I.M. Dubovskiy,M.M.A. Whitten. Contributions of cellular and humoral immunity of Galleria mellonella larvae in defence against oral infection by Bacillus thuringiensis[J]. Journal of Invertebrate Pathology,2014(119):40-46.
Effect ofCordycepsmilitarison humoral immunity and cellular immunity
ZHANG Lan1,2,WANG Dan1,2,NIE Jing-shi3
(1.Department of Public and Health,Jinlin Medical college,Jilin132013,China;2.Lever Two Laboratory of Administration of Traditional Chinese Medicine of Jilin Province,Jinlin Medical College,Jilin132013,China;3.Jilin Dunhua Sericultural Sericulture Industry Development Co.,Ltd,Dunhua 133700,China)
In order to study effect ofCordycepsmilitarison humoral immunity and cellular immunity functions of mice. ICR male mice were assigned randomly to I,II,III groups. Every group was assigned to the following groups:negative control,low(0.167 g/kg·bw),medium(0.333 g/kg·bw),high(0.999 g/kg·bw)dosage CM for 30 days by intragastric infusion. Then spleen lymphocyte proliferation,delayed type hypersensitivity,quantity of antibody forming cells,and hemolytic value(HC50)were detected. The results showed thatCordycepsmilitarishad no significant effect on body weight increase,ratio of spleen weight to body weight,ratio of thymus weight to body weight(p>0.05). Medium and high dose groups had significant effect on cellular immunity(p<0.05);and had significant effect on humoral immunity,all groups had significant effect on quantity of antibody forming cells,and medium and high dose groups had significant effects on HC50(p<0.05). So it was concluded thatCordycepsmilitariscan strengthen immunity functions of mice,and lay the foundation for mechanism research of immune regulation.
Cordycepsmilitaris(CM);humoral immunity;cellular immunity
2015-07-09
张岚(1980-),女,博士,副教授,研究方向:生物反应器与功能性食品,E-mail:lan4531@163.com。
吉林省科技发展计划项目(20130206022YY)。
TS201.4
A
1002-0306(2016)05-0349-05
10.13386/j.issn1002-0306.2016.05.062

