离子色谱脉冲安培检测法测定原桃胶中的多糖含量
沈 洁,周光明,于 璐
(发光与实时分析教育部重点实验室 西南大学化学化工学院,重庆 400715)

沈洁,周光明*,于璐
(发光与实时分析教育部重点实验室 西南大学化学化工学院,重庆 400715)
建立离子色谱-脉冲安培检测法检测桃胶中的糖类(鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖)含量的方法,采用METROSEP CARB 1(150 mm×4.0 mm)分离柱,以10 mmol/L NaOH溶液在1.0 mL/min下洗脱样品溶液,总分析时间为22 min。鼠李糖、甘露糖线性范围为5.0~100.0 μg/mL,阿拉伯糖、半乳糖、葡萄糖线性范围为2.0~60.0 μg/mL,鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖检出限分别为(进样量20 μL,S/N=3)0.34、0.18、0.17、0.08、0.39 μg/mL,样品加标回收率为92.0%~98.3%,使用样品溶液连续进样6次,测得5种糖RSD为2.25%~4.23%。此方法无需衍生、操作方便、方法快捷、检测灵敏度高,适用于桃胶类糖含量的检测。
离子色谱,脉冲安培检测器,桃胶,多糖
桃胶(又名桃树胶)系蔷薇科植物,如桃树、李树、杏树等树木树干受到机械损伤(如虫咬、切伤等)或致病后分泌出来的胶质半透明物质,经研究表明其主要成分是多糖及其衍生物、少量蛋白质以及杂质等。其中多糖的主要成分为半乳糖、阿拉伯糖,另外还有少量的鼠李糖、甘露糖及葡萄糖[1]。《本草纲目》中有记载桃胶味苦、性平、益气、和血、止渴,具有治疗消渴的作用。近年来的研究表明,桃胶还具有清除结石,保护人体造血功能,改善免疫功能及强身健体等功效,将其运用到血淋、石淋、痢疾、腹泻等治疗中,均有良好的效果[2-4]。
目前有关于桃胶的研究多在于其理化性质,收集、加工及提取工艺上,提取工艺重在研究桃胶的主要成分:多糖,而在研究提取桃胶多糖的文章中,比较常见的检测方法是气相色谱、液相色谱技术,毛细管电泳法[5-8]。但是由于糖类多为中性、极性和亲水性化合物,进行HPLC分离或GC分离之前必须先进行衍生,生成疏水性或挥发性的化合物,而后再使用光度法或示差折光进行检测。在衍生过程中,对于基体组成复杂的样品,往往会由于受到各种因素的影响造成衍生反应进行不彻底或生成多种衍生物,造成检测结果出现偏差。此外,折光和低波长紫外检测器对淋洗液和样品基体非常敏感,这也限制了梯度洗脱方法的使用。本文采用离子色谱脉冲安培检测器,利用糖类在强碱条件下呈离子状态,可以在阴离子色谱柱上被分离出来的特性进行检测,从而实现对多糖含量的测定。
1 材料与方法
1.1材料与仪器
样品桃胶A、B、C分别从网上购自于云南丽江、浙江金华、福建宁德;实验用水 ≥ 18.2 MΩ·cm的去离子水;葡萄糖、D(-)-阿拉伯糖、三氯乙酸成都科龙化工试剂厂;鼠李糖、D-半乳糖、D-甘露糖、阴离子交换树脂上海晶纯生化科技股份有限公司;无水乙醇、氢氧化钠、正丁醇、三氯甲烷、氯化钠川东化工集团有限公司,以上试剂均为分析纯;0.45 μm微孔过滤膜天津市腾达过滤器件厂。
861 Advanced Compact IC离子色谱仪瑞士万通公司(Metrohm),817 Bioscan脉冲安培检测器,METROSEP CARB 1分离柱(150 mm×4.0 mm),Metrohm IC-Net 2.3色谱工作站。恒温油浴锅巩义市予华仪器有限责任公司;超声波清洗仪上海必能信超声波有限公司;80-1台式低速离心机金坛市科技仪器有限公司;隔膜真空泵天津市腾达过滤器件厂;岛津UV-2450紫外分光光度计江苏省科学器材有限公司;恒温干燥箱上海东星建材有限公司。
1.2色谱检测条件
分离柱:METROSEP CARB 1(150 mm×4.0 mm)阴离子交换柱,淋洗液:10.0 mmol/L NaOH溶液,流速:1.0 mL/min,进样量:20 μL,柱温:32 ℃,再生液:200.0 mmol/L NaOH,安培检测器采用四电位脉冲安培法检测,峰面积定量。
1.3桃胶多糖的分离纯化
1.3.1桃胶的预处理将桃胶样品进行干燥、碾磨成细小颗粒后,准确称量1.0000 g的样品,加入一定量的去离子水90 ℃水浴加热、溶解,待充分溶解180 min后,使用60目过滤网过滤收集滤液[9-10]。将滤液加入三氯乙酸溶液至pH=3,静置10 h进行脱蛋白处理后,于4000 r/min的离心机下离心10 min,收集离心后的上清液,调节pH至中性[11-12]。加入4倍的乙醇进行醇沉处理,静置24 h后于4000 r/min的离心机下离心20 min,将得到的沉淀收集干燥后,溶解,将乙醇溶液浓缩、干燥后用去离子水溶解,合并两溶液。用阴离子树脂脱色处理60 min,过滤定容至100 mL后使用0.45 μm微孔滤膜过滤待测。
1.3.2桃胶水解时间选择桃胶B样品分别水解30、60、120、180、240 min后,按照上述方法检测多糖含量,做峰面积柱状图。
1.3.3脱蛋白法使用三氯甲烷与丁醇4∶1的混合溶剂将样品溶液置于250 mL的分液漏斗中混合摇匀、静置5 min后,分离去变性蛋白,重复此项至溶剂与水层间不再有变性蛋白。
使用三氯乙酸溶液调节样品溶液的pH=3,静置10 h左右后离心,取上层清液,将收集的上层清液调节pH至中性。
将savage法对样品B的多糖峰面积与三氯乙酸法(TCA)得到的峰面积做柱状图比较。
1.3.4桃胶多糖水溶液脱色阴离子树脂预处理:将阴离子树脂浸泡在5%的乙醇中24 h,去离子水清洗后用5%的氢氧化钠浸泡4 h,使用去离子水将其冲洗至pH=7后在60 ℃进行烘干[13]。
脱色率的测定及计算:桃胶多糖溶液使用阴离子树脂脱色后,测定在420 nm处有最大紫外吸收,根据脱色前与脱色后的紫外吸光度,计算脱色率。
脱色率(%)=(脱色前吸光度-脱色后吸光度)/脱色前吸光度×100
脱色剂用量:较为常用的多糖的脱色方法一般为双氧水法,活性炭法以及树脂法[14-16]。但是双氧水法具有较强的氧化性,破坏多糖结构,不利于实验分析,活性炭对于粘性较强的桃胶来说,会增加过滤步骤的困难,故选择阴离子交换树脂进行脱色。分别向8份20 mL的待脱色溶液中加入1%、2%、3%、4%、5%、6%、7%、8%的树脂,设定脱色时间相同均为30 min后,检测吸光度,计算脱色率。
脱色时间:向8份20 mL的待脱色溶液中均加入5%的树脂,分别进行10、20、30、40、50、60、70、80 min脱色处理后检测吸光度,计算脱色率。
1.4淋洗液的浓度及流速
分别配制5.0、8.0、10.0、20.0、40.0、60.0 mmol/L的NaOH溶液作为淋洗液,选择最佳浓度。分别使用0.5、0.8、1.0、1.2、1.5 mL/min的流速检测标准样品,选择最佳流速。
1.5标准溶液的配制
称量半乳糖、阿拉伯糖、甘露糖、鼠李糖、葡萄糖各0.1000 g,加水溶解后分别放入100 mL容量瓶中,定容至刻度配成1000 mg/L标准溶液。
分别从1000 mg/L标准溶液中吸取0.2、0.6、1.0、2.0、4.0、6.0 mL半乳糖、阿拉伯糖、葡萄糖溶液,取0.5、1.0、2.0、4.0、6.0、10.0 mL的甘露糖、鼠李糖溶液于100 mL容量瓶中定容配成混合标准溶液。分别得到2.0、6.0、10.0、20.0、40.0、60.0 μg/mL的半乳糖、阿拉伯糖、葡萄糖溶液与5.0、10.0、20.0、40.0、60.0、100.0 μg/mL的甘露糖、鼠李糖标准混合溶液。
2 结果与分析
2.1淋洗液浓度及流速的选择
淋洗液浓度:实验表明在脉冲安培检测器使用碱性流动相洗脱样品,保留时间洗脱顺序依次为酸性糖、中性糖和氨基酸糖,即出峰顺序依次为鼠李糖、阿拉伯糖、半乳糖、葡萄糖和甘露糖[17]。淋洗液浓度低于10.0 mmol/L时除鼠李糖外,另外4种糖可以较好地分离;而高于20.0 mmol/L时,半乳糖、葡萄糖、甘露糖这些差向异构体和位置异构体,无法实现分离;当淋洗液浓度为10.0 mmol/L时,五种糖的分离效果是相对较为理想的,且保留时间适中。因此本实验选择淋洗液浓度为10.0 mmol/L。
淋洗液流速:实验发现改变流速的大小对出峰时间以及灵敏度均有影响,当流速降低时,保留时间明显延长,而增大流速,对糖的分离影响较大。为提高实验效率,综合考虑,本文选择淋洗液流速为1.0 mL/min,此时各组分分离度、灵敏度均较好。
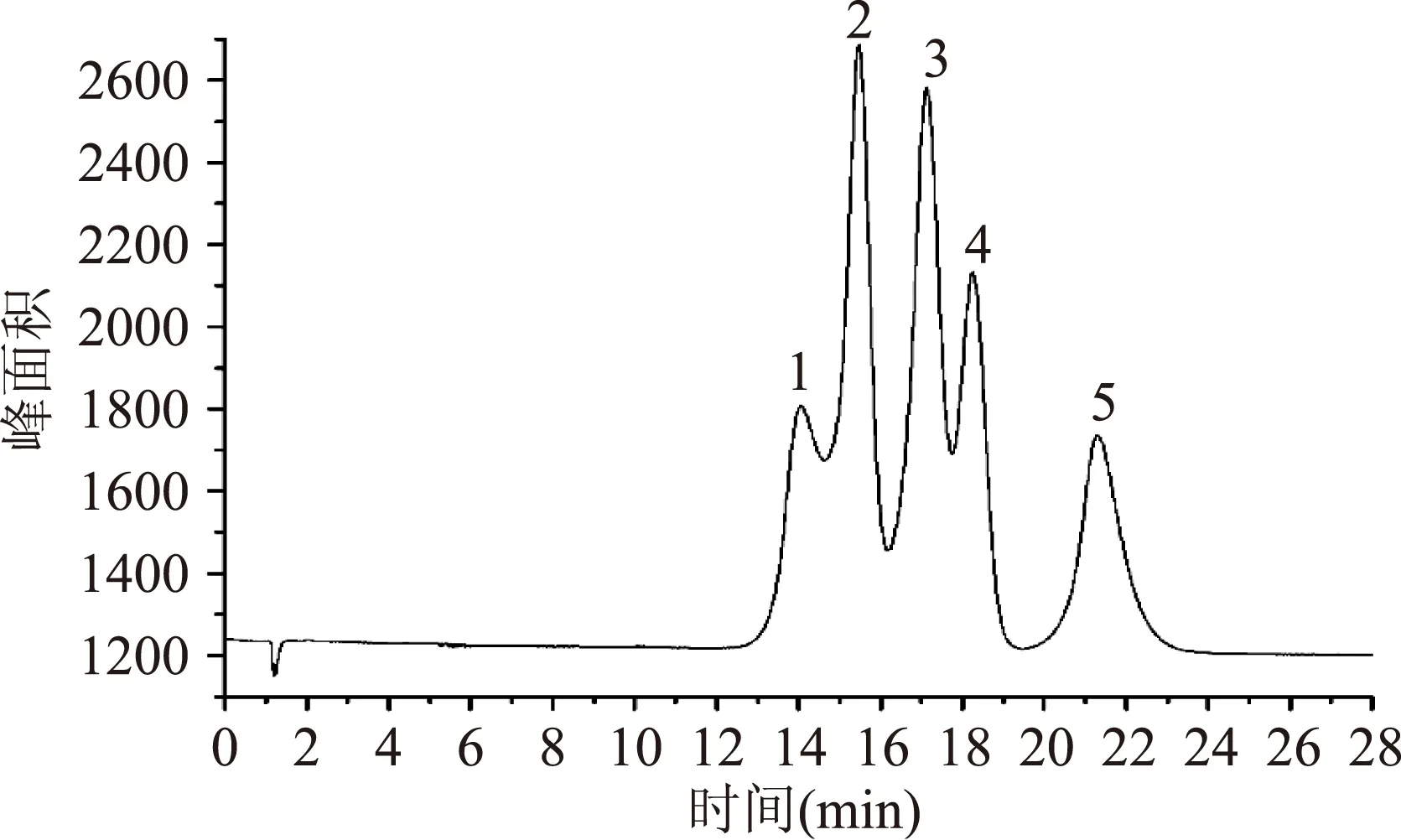
图1 标准样品色谱图Fig.1 Chromatograms of standards注:1:鼠李糖,2:阿拉伯糖,3:半乳糖, 4:葡萄糖,5:甘露糖,流速1.0 mL/min。
2.2水解时间的优化选择
随着反应时间的增加,测得桃胶样品各组分含量随之增加,尤其是阿拉伯糖、甘露糖效果明显。虽然在240 min得到的阿拉伯糖含量最高,但是葡萄糖、甘露糖的含量较之前的180 min增长不明显。故综合考虑反应时间和反应收率,本文选择180 min为最佳反应时间。
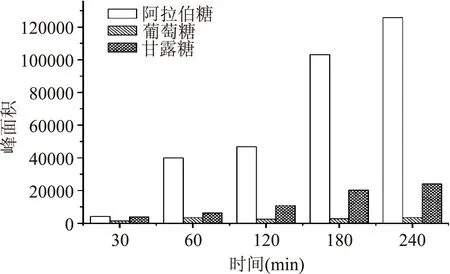
图2 样品B在不同反应时间所测得的各组分含量Fig.2 The content of each component at different reaction time for sample B
2.3脱蛋白试剂的优化选择
由图3可见样品B在经savage法处理后得到的阿拉伯糖、葡萄糖、甘露糖含量明显少于三氯乙酸法,说明savage法对于多糖的损失影响比较大。故本实验采用三氯乙酸脱蛋白法。
2.4脱色剂用量及脱色时间的优化选择
由图4可以看出脱色剂的用量在5%内呈现明显增长趋势,说明脱色剂用量对脱色率的影响较为明显,但是5%后呈现平缓趋势的状态,故本文选择脱色剂用量为5%。
由图5可以明显看到脱色时间越长,脱色效果越明显,但是在60 min后,脱色率的变化呈现一个平缓的趋势,故综合考虑本文选择脱色时间为60 min。
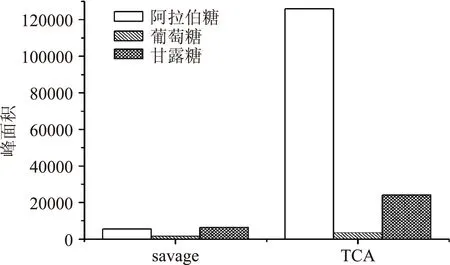
图3 样品B在savage法 与三氯乙酸(TCA)法脱蛋白后的糖含量Fig.3 The content of monosaccharides after taking off the protein by savage and TCA
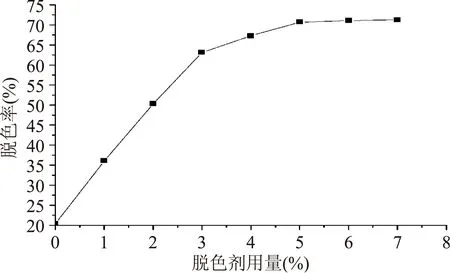
图4 脱色剂用量对桃胶溶液脱色率的影响Fig.4 The effect of different amount of decolorant on peach gum decoloring rate
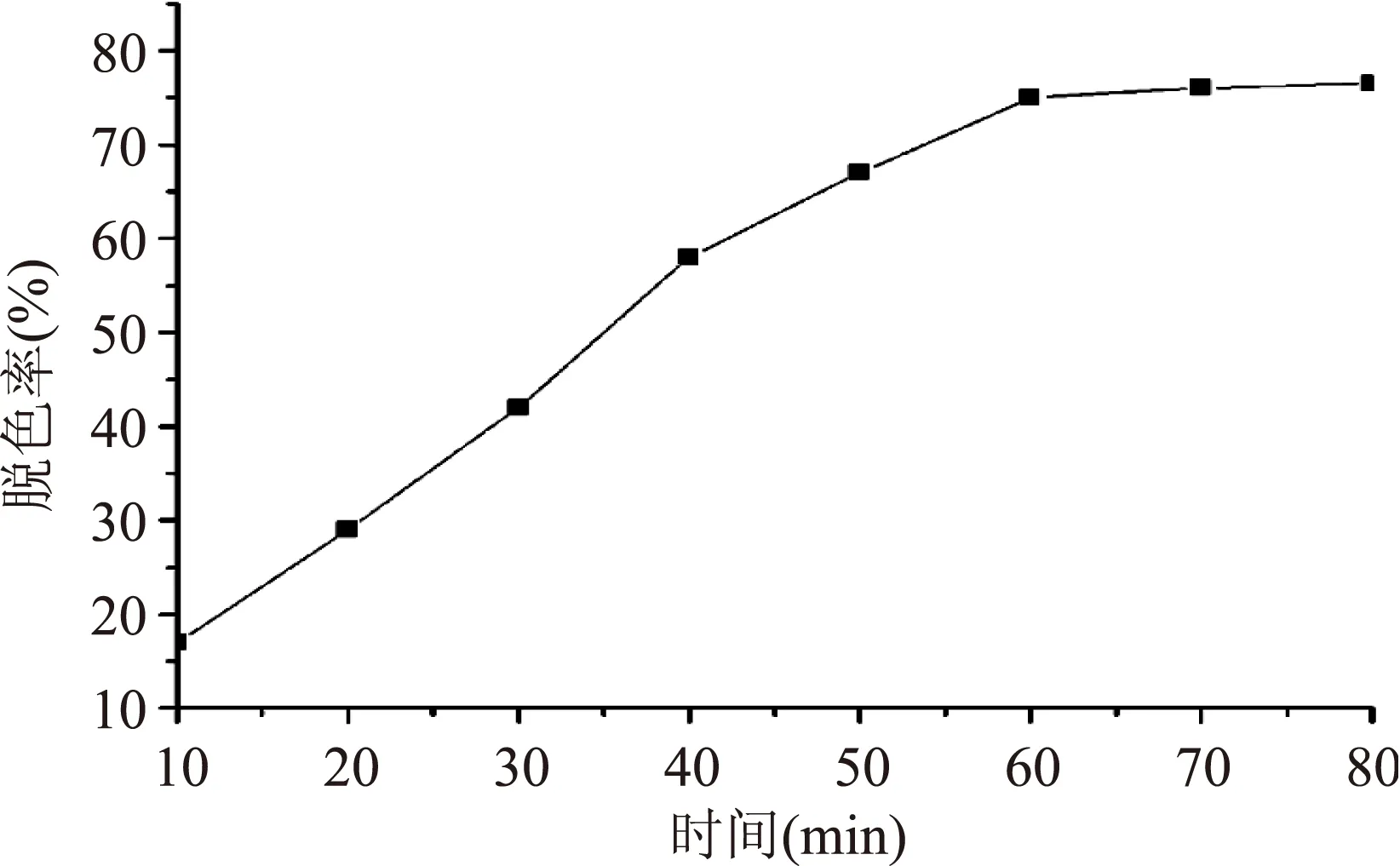
图5 桃胶溶液在不同时间脱色率的变化图Fig.5 The decoloring rate variation of peach gum in different time
2.5标准曲线与检出限
分别测定混合标准溶液,根据峰面积与标准样品浓度,绘制标准曲线。逐渐稀释标准样品溶液,由S/N=3得到各检出限如表1所示。
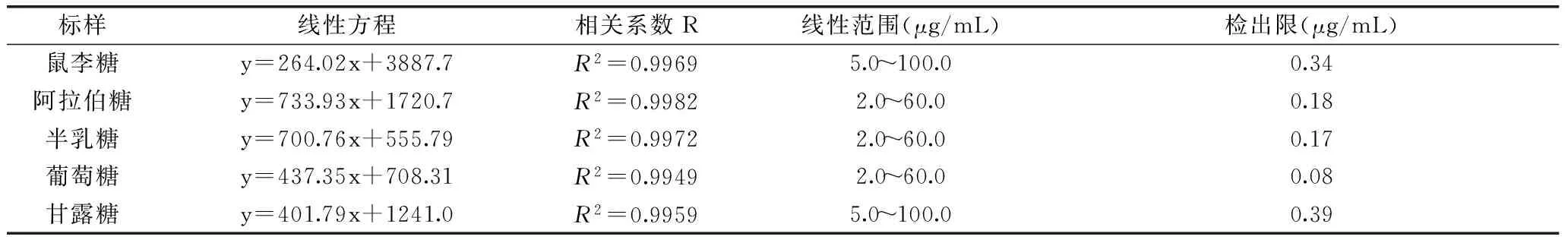
表1 五种单糖的标准曲线与检出限Table 1 The results of regression equation and detection limits for five Monosaccharides
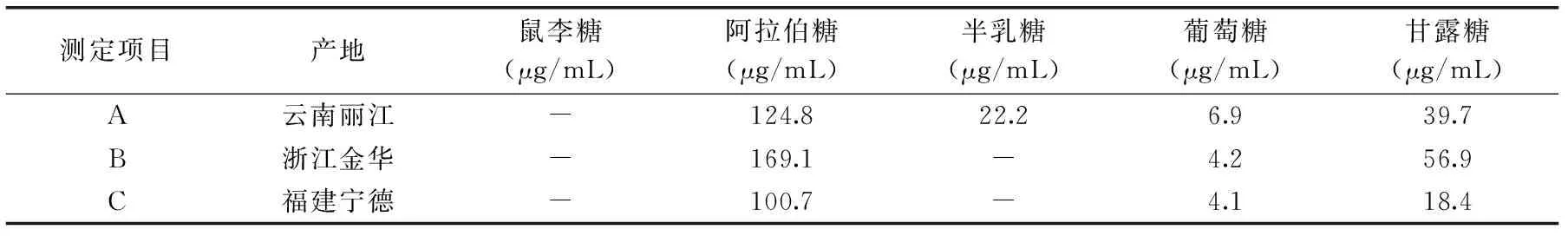
表2 样品含量测定结果Table 2 The content of monosaccharides of peach gum for A,B and C
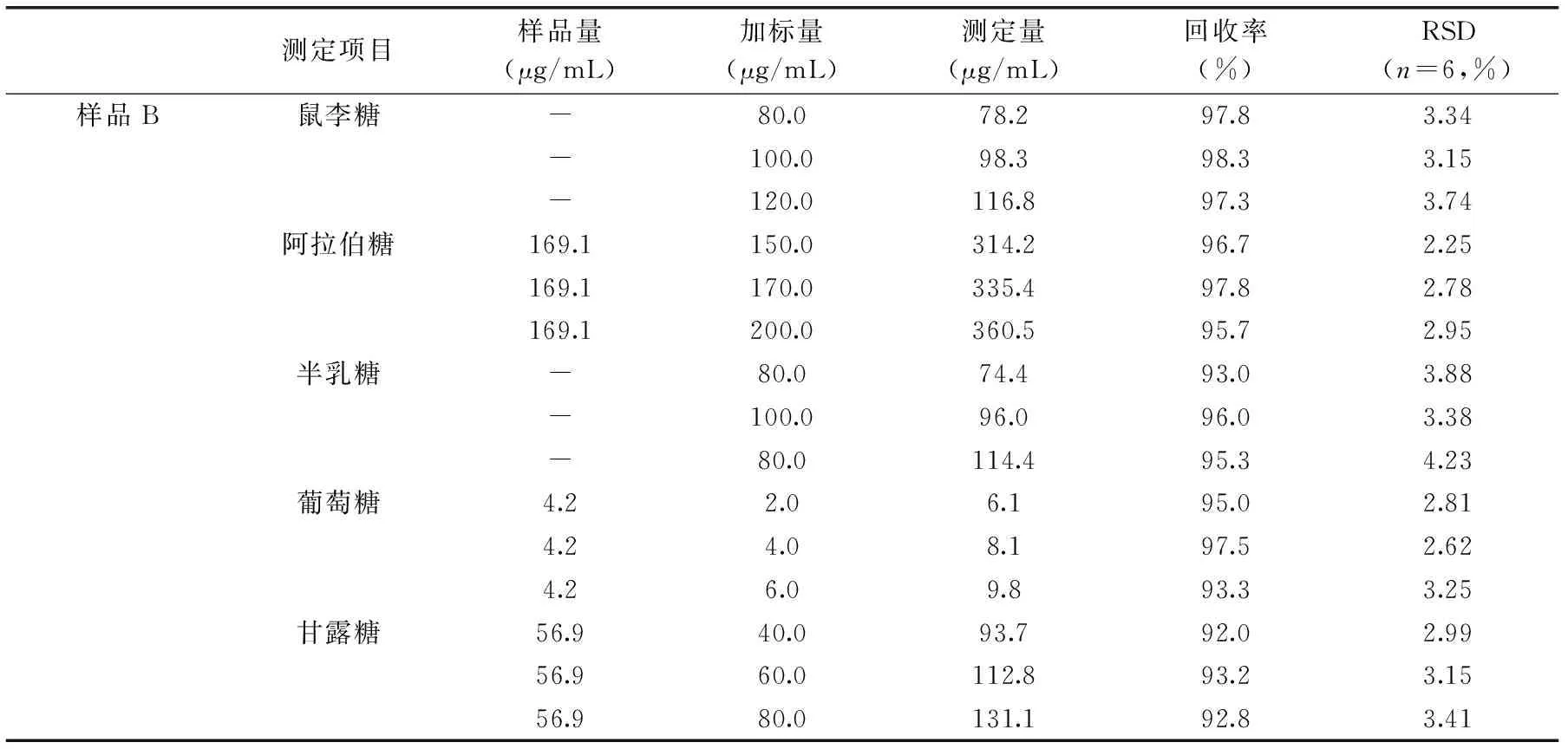
表3 被测化合物加标回收率结果Table 3 The result of adding standard recovery
2.6色谱图与检测结果
样品A、B、C色谱图(图6),组分含量见表2。样品A中检测到了阿拉伯糖、半乳糖、葡萄糖以及甘露糖四种单糖成分,而没有检测到鼠李糖。样品B、C均检测到阿拉伯糖、葡萄糖以及甘露糖,样品B的图可以看出半乳糖的峰的趋势,但是低于检测限。三种样品均没有检测到鼠李糖可能是由于本身桃胶中鼠李糖含量较低,在经过前处理后其样品含量低于检测限。
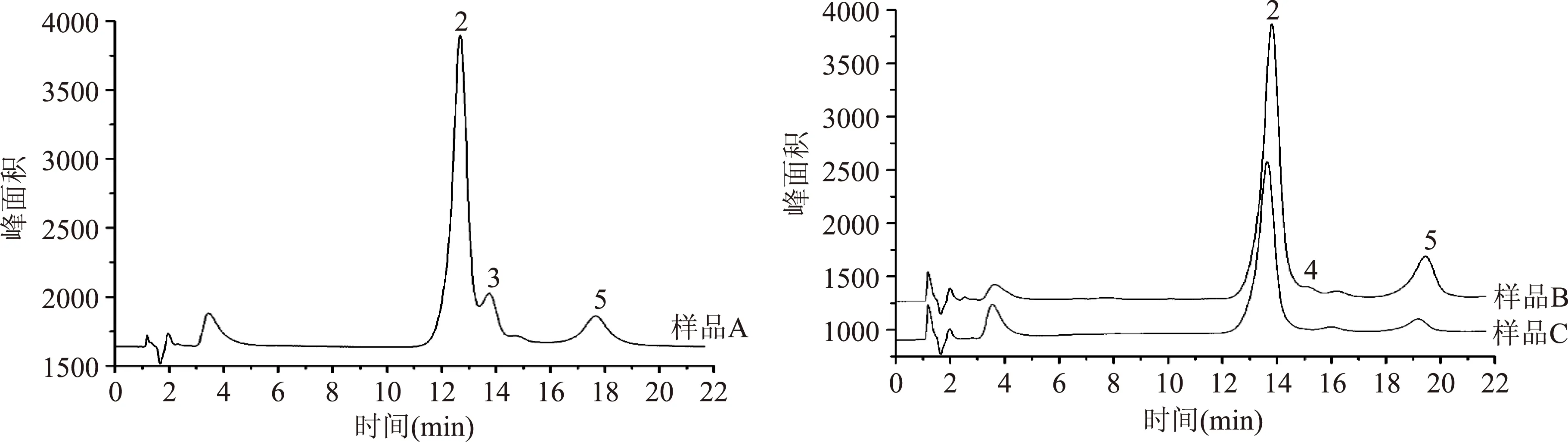
图6 样品A、B、C 3种桃胶样品的色谱图Fig.6 The chromatograms of peach gum for A,B and C
2.7加标回收率与精密性实验
样品B的加标回收率与精密度见表3。样品B桃胶样品回收率为92.0%~98.3%。将每份加标样品分别进样6次,通过峰面积计算精密度为2.25%~4.23%。
3 结论
本研究采用热水浸提法浸提、三氯乙酸脱蛋白、阴离子交换树脂脱色对桃胶样品进行了前处理工作,使用离子色谱-脉冲安培检测法检测桃胶中的多
糖成分。实验表明,此检测方法不需要对其进行柱前衍生,灵敏度高,准确性好,操作简单,适用性强,具有一定的实用价值。可以作为快速检测桃胶中多糖成分的一种方法。
[1]徐燕,朱科学,钱海峰,等.桃胶多糖的提取分离及组成性质研究[J].食品工业科技,2008,29(1):66-68.
[2]Karedosova,J Rosik,J Kubala.Utilization of degraded peach gum polysaccharide by aspergillus flavus[J].Phytochemitry,1975,(14):341-343.
[3]南京中医药大学. 中药大辞典[M]. 上海科学技术出版社(第二版). 2005,2545.
[4]中药大辞典[M].上海人民出版社. 1977:1790-1791.
[5]张璇. 桃树胶研究进展[J].食品科技,2011,18(1):29-31.
[6]丁成丽,刘力,王强. 柱前衍生高效液相色谱法分析新疆桃胶的多糖组成[J].分析科学学报,2012,28(3):319-322.
[7]杨兴斌,赵燕,周四元,等. 柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J]. 分析化学,2005(9):1287-1290.
[8]梁立娜,张萍,蔡亚岐,等. 高效阴离子交换-脉冲安培检测同时分析单糖和糖醛酸[J]. 分析化学,2006,34(10):1371-1374.
[9]黄雪松. 桃胶的性质、加工及其开发利用[J].特产研究,2004(1):47-51.
[10]王文玲,黄雪松. 原桃胶和商品桃胶的生产与应用[J].食品研究与开发,2005,26(4):175-178.
[11]谢清春,符美燕. 灰兜巴粗多糖提取液的脱蛋白工艺研究[J].中成药,2013,35(7):1557-1560.
[12]秦微微,金婷,宋学东,等.米糠多糖脱蛋白工艺的研究[J]. 中国食品添加剂,2014(1):183-187.
[13]肖建中,刘青娥,陈海燕,等.香菇废菌棒多糖树脂脱色工艺研究[J].安徽农业科学,2013,41(8):3647-3649.
[14]姚文华,尹卓容. 大枣多糖脱色的工业化实验[J].食品工业,2006(5):41 - 43.
[15]蒋俊,杨焱,罗玺,等. 猴头菌多糖不同脱色方法的研究[J].天然产物研究与开发,2013(9):1180-1184.
[16]钱丹丹,李新华,杨强,等. 水飞蓟多糖树脂脱色工艺的优化[J]. 食品科技,2015(1):227-231.
[17]丁永胜. 高效阴离子交换色谱-脉冲电化学检测方法和应用[J]. 分析化学,2005,33(4):557-561.
Determination of the polysaccharide content in origin peach gum by ion chromatography with pulsed ampere detector
SHEN Jie,ZHOU Guang-ming*,YU Lu
(Key Laboratory on Luminescence and Real-time Analysis(Southwest University),Ministry of Education,School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
The ion chromatographic method with pulsed amperometric detectorhad was developed for the determination of peach gum polysaccharide content(rhamnose,arabinose,galactose,glucose,mannose). The analytes were separated on a METROSEP CARB 1(150 mm×4.0 mm)anion exchange column with 10 mmol/L NaOH as mobile phase at the flow rate of 1.0 mL/min,and the total analysis time of 22 min. The linear range of rhamnose and mannose was 5.0 to 100.0 μg/mL,the linear range of arabinose,galactose,glucose line arrange was 2.0 to 60.0 μg/mL. The detection limits of rhamnose,arabinose,galactose,glucose and mannose(20 μL injection,S/N=3)were 0.34,0.18,0.17,0.08,0.39 μg/mL,respectively. The recovery rates ranged from 92.0% to 98.3%,and RSDs of 5 polysaccharide contents ranged from 2.25% to 4.23% after 6 consecutive injections. Therefore,the proposed determination method was derivative-free,simple,fast,effective and sensitive,which facilitates the rapid detection and effective quality control of polysaccharide contents in peach gum.
Ion chromatography;pulsed ampere detector;peach gum;polysaccharide
2015-07-15
沈洁(1990-),女,硕士研究生,研究方向:离子色谱,E-mail:shenjiefamily@sina.com。
周光明(1964-),男,博士,教授,研究方向:拉曼光谱学、离子色谱、分子光谱与色谱联用技术,E-mail:gmzhou@swu.edu.cn。
国家自然科学基金(21277110)资助。
TS207.3
A
1002-0306(2016)05-0298-05
10.13386/j.issn1002-0306.2016.05.051

