高产虾青素红法夫酵母菌株的选育和发酵参数优化
胡向东,潘玲燕,叶茂,胡伟卿
(浙江皇冠科技有限公司,浙江杭州 310012)
高产虾青素红法夫酵母菌株的选育和发酵参数优化
胡向东,潘玲燕*,叶茂,胡伟卿
(浙江皇冠科技有限公司,浙江杭州310012)
目的:选育出高产、稳产虾青素的红法夫酵母菌株,并对培养基进行参数优化。方法:以红法夫酵母(P.Rhodozyma02)为出发菌株,分别进行紫外-氯化锂(UV-LiCl)和60Co-γ诱变,从中筛选出高产虾青素的突变株作为基因组重排育种的出发菌株;经过五轮原生质体融合,筛选得到的基因组重排最优菌株。通过富含虾青素合成前体的天然促进剂的添加及对发酵培养基的参数优化,得到最佳培养基条件。结果:最终筛选得到高产、稳产虾青素的融合菌株F5-9,在此基础上优化得到最佳培养基参数条件为葡萄糖30.0 g/L,蛋白胨3.0 g/L,酵母浸出粉7.0 g/L,(NH4)2SO45.0 g/L,MgSO4·7H2O 2.75 g/L,KH2PO41.5 g/L,CaCl2·2H2O 0.2 g/L,胡萝卜汁150 mg/L,最终虾青素的产量高达(83.39±1.03)mg/L,是原始出发菌株的17.56倍。结论:采用传统诱变和基因组重排技术,能显著提高虾青素产量,培养基中添加虾青素前体物质胡萝卜汁能进一步促进虾青素产量的提高。
红法夫酵母,虾青素,诱变,基因组重排,参数优化
虾青素具有极强的生物抗氧化性、还具有促进机体抗体产生、增强免疫力以及抗紫外线辐射等作用[1]。因而在食品添加剂、水产养殖、化妆品、保健品和医药工业方面有广阔的应用前景[2-5]。
红法夫酵母是虾青素的主要生物来源之一,但由于虾青素是胞内色素,是一种与细胞生长相偶联的次级代谢产物,且红法夫酵母最适生长温度低,菌体生长缓慢,所以虾青素的产量也比较低,目前高产虾青素酵母菌株主要是通过反复多次诱变和筛选得到[6-7],但反复多次诱变会产生有毒的突变株,且会产生抗药性,难以再大幅度提高产量。
基因组重排技术是20世纪90年代中期,美国加州Maxgen公司Cardayré等首次提出的,是基于DNA Shuffling的原理[8]将传统诱变技术和细胞融合技术相结合,以整个基因组作为重组对象的多亲本原生质体递推融合技术。2002年Zhang等[9]又进一步提出在细胞水平的基因组重排,该技术模拟自然进化的过程,将诱变育种技术和原生质体融合技术相结合,以分子进化为核心在实验室实现微生物全细胞快速定向进化。目前,基因组重排主要应用于提高微生物代谢产物产率,增强菌株对环境的耐受性,提高底物利用率和范围,改变代谢途径产生新的代谢产物等。Wang等[10]采用紫外线与亚硝基胍(NTG)两种诱变剂分别对干酪乳杆菌进行诱变,以获得的突变菌株作为亲本株进行了3轮原生质体融合,得到的融合子可在pH3.6条件下生长,pH3.8条件下乳酸产量比野生型菌株提高3倍。Wang[11]等对一株产紫杉醇的内生真菌用UV和NTG对原生质体诱变建立突变库,经过1轮重排,筛选到一株能产生3种新的倍半萜类化合物的突变株及一株能产生18种其他化合物的重排融合菌株。
针对野生红法夫酵母菌株虾青素产量低的问题,本文采用基因组重排技术,即将原始出发菌株分别经UV和60Co-γ诱变,筛选高产量正突变菌株,再进行原生质体递归融合,最终得到高产、稳产虾青素的融合菌株,并对虾青素产量最高菌株的发酵工艺进行了合理优化。
1 材料与方法
1.1材料与仪器
亲本菌株红法夫酵母(P.Rhodozyma02),其来源为浙江工商大学食品与生物工程学院保藏,由梁新乐(浙江杭州)赠送,于-80 ℃下保存;
培养基YM培养基、YM-二苯胺选择性培养基、高渗再生培养基、选择性再生培养基、摇瓶发酵培养基均参照文献[12]进行配制,种子培养基为YM液体培养基。
1.2培养及分析方法
1.2.1溶液配制生理盐水:称取8.5 g NaCl溶于1000 mL去离子水中,分装高压蒸气灭菌后待用;KCl高渗缓冲液的配制(0.8 mol/L):称取59.6 g KCl溶解于0.01 mol/L的Tris-HCl(pH7.4)缓冲溶液中,定容到1000 mL,分装高压蒸气灭菌后待用;PTC溶液的配制:分别准确称取70 g PEG-4000,0.22 g无水CaCl2,KCl溶液溶解并定容至200 mL;溶壁酶混合液:分别称取0.6 g溶菌酶,0.6 g蜗牛酶,1.2 g纤维素酶,分别溶于30 mL KCl 缓冲液中,分别用 0.22 μm的无机微孔膜过滤,4 ℃保存,使用时按纤维素酶∶溶菌酶∶蜗牛酶=2∶1∶1 混合。
1.2.2菌种培养菌种的活化、种子培养及摇瓶发酵培养均参照文献[6]的方法进行。
1.2.3虾青素含量的测定紫外分光光度测定法[13]。
1.2.4菌体生物量的测定取5 mL菌悬液,5000 r/min离心10 min,弃上清,菌体用去离子水洗两次,在烘箱中于105 ℃烘至恒重,然后称重。
1.3实验方法
1.3.1复合诱变育种将对数期的出发菌株菌液用无菌生理盐水稀释到106个/mL,参照文献[6]的诱变方法分别进行UV-LiCl复合诱变和60Co-γ射线诱变处理,筛选平板中加入40 μmol/L二苯胺进行抗性筛选。
1.3.2原生质体的制备见参考文献[12]。
1.3.3原生质体形成率和再生率的测定见参考文献[14]。
1.3.4原生质体融合与再生见参考文献[12]。
1.3.5融合子的筛选将融合菌株分别划线于含40 μmol/L浓度二苯胺的YM选择性培养基平板上,22 ℃培养后观察平板上菌落的生长情况,从长出的菌落中选出颜色较红,半径较大的,虾青素产量相对高的几株融合菌株。
1.3.6递归融合将筛选出的虾青素产量相对高的几株融合菌株继续进行步骤1.3.2至1.3.5的操作,将每轮融合菌株分别划线于含有不同浓度(80~360 μmol/L)的二苯胺的YM选择性培养基平板上,筛选出虾青素产量较高的融合菌株,如此循环往复,进行5轮递归融合,最后筛选出虾青素产量相对较高的几株菌株。
1.3.7稳定性实验将最终筛选出虾青素产量相对较高的融合菌株按10%接种量接入装有30 mL液体发酵培养基的250 mL三角瓶中进行发酵培养,22±1 ℃,150 r/min,培养48 h,传代5次,提取发酵液,测定虾青素含量,最终得到虾青素含量稳定的融合菌株。
1.3.8高产融合子发酵生产虾青素的工艺优化影响红法夫酵母高产虾青素的因素有很多,如培养基的成分和配比、发酵pH、发酵温度、发酵时间、转速、装液量等,另有研究报道一些天然促进剂,如橙子、茶叶汁、胡萝卜汁、番茄汁[15-16]等,在红法夫酵母发酵生产虾青素的过程中,对于提高虾青素产量有着重要的作用。本实验主要针对天然促进剂种类及各营养物质的比例对发酵虾青素的影响进行考查,设计5因素4水平正交实验,按正交表L16(45)进行发酵实验,测定虾青素的产量。
2 结果与讨论
2.1诱变育种的结果
2.1.1UV-LiCl复合诱变育种结果参考文献[6],得到H1-2和H1-12两株虾青素产量较高的突变株,产量分别是(9.62±0.16)、(9.44±0.14)mg/L,将其作为第一轮原生质体融合的亲本菌株。
2.1.260Co-γ射线诱变结果P.rhodozyma02菌株经3.5 kGy剂量的60Co-γ射线诱变筛选后,得到10个菌落大、颜色亮而红的菌株,进行摇瓶发酵复筛,测定虾青素含量和生物量。结果见表2。从表2中可以看出,突变株Co-4、Co-5和Co-9的虾青素产量分别是(9.35±0.16)、(9.27±0.07)和(9.46±0.15) mg/L,分别是出发菌株P. Rhodozyma 02的1.97、1.95和1.99倍。因此将Co-4、Co-5和Co-9作为第一轮原生质体融合的亲本菌株。
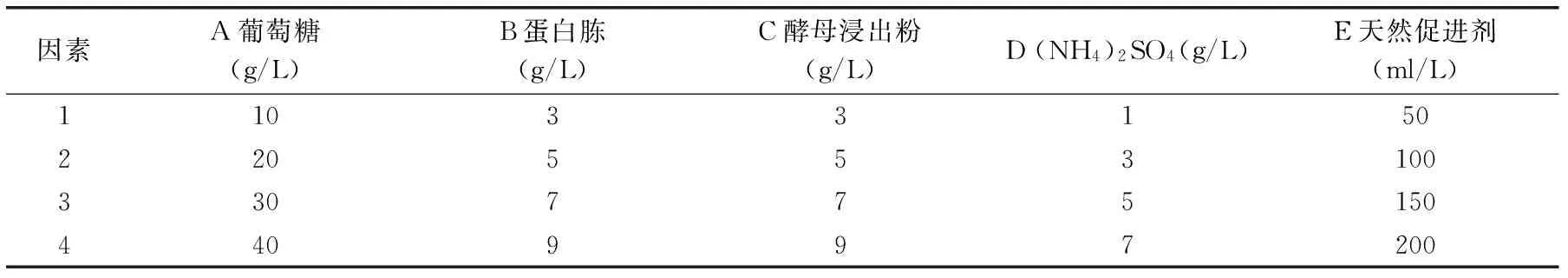
表1 最佳融合菌株发酵工艺条件优化正交实验因素水平Table 1 Factors and levels of fermentation conditions optimization for the best fusion strains
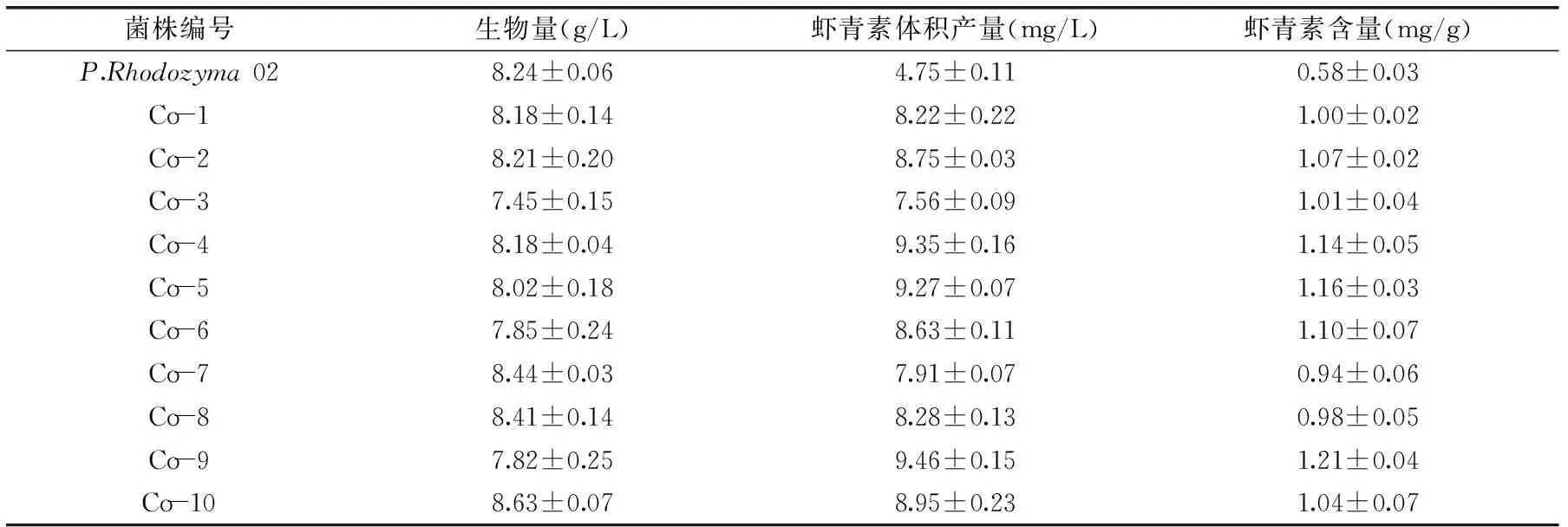
表2 60Co-γ射线诱变突变株的生物量和虾青素产量Table 2 Biomass and astaxanthin production of mutants by 60Co-γ radiation
2.2原生质体融合结果
2.2.1第一轮原生质体融合结果将经UV-LiCl和60Co-γ诱变方式筛选得到的5株突变株作为出发菌株进行第一轮的原生质体融合,从黄色菌株中挑选生长较好的30个菌株进行摇瓶复筛,以菌株编号为横坐标,虾青素产量为纵坐标绘图,如图1。最终得到6株融合子 F1-8、F1-10、F1-12、F1-17、F1-21、F1-27,虾青素产量都有所提高,其中F1-17的虾青素产量为(17.48±0.36) mg/L,是原始出发菌株P.Rhodozyma02的3.68倍。
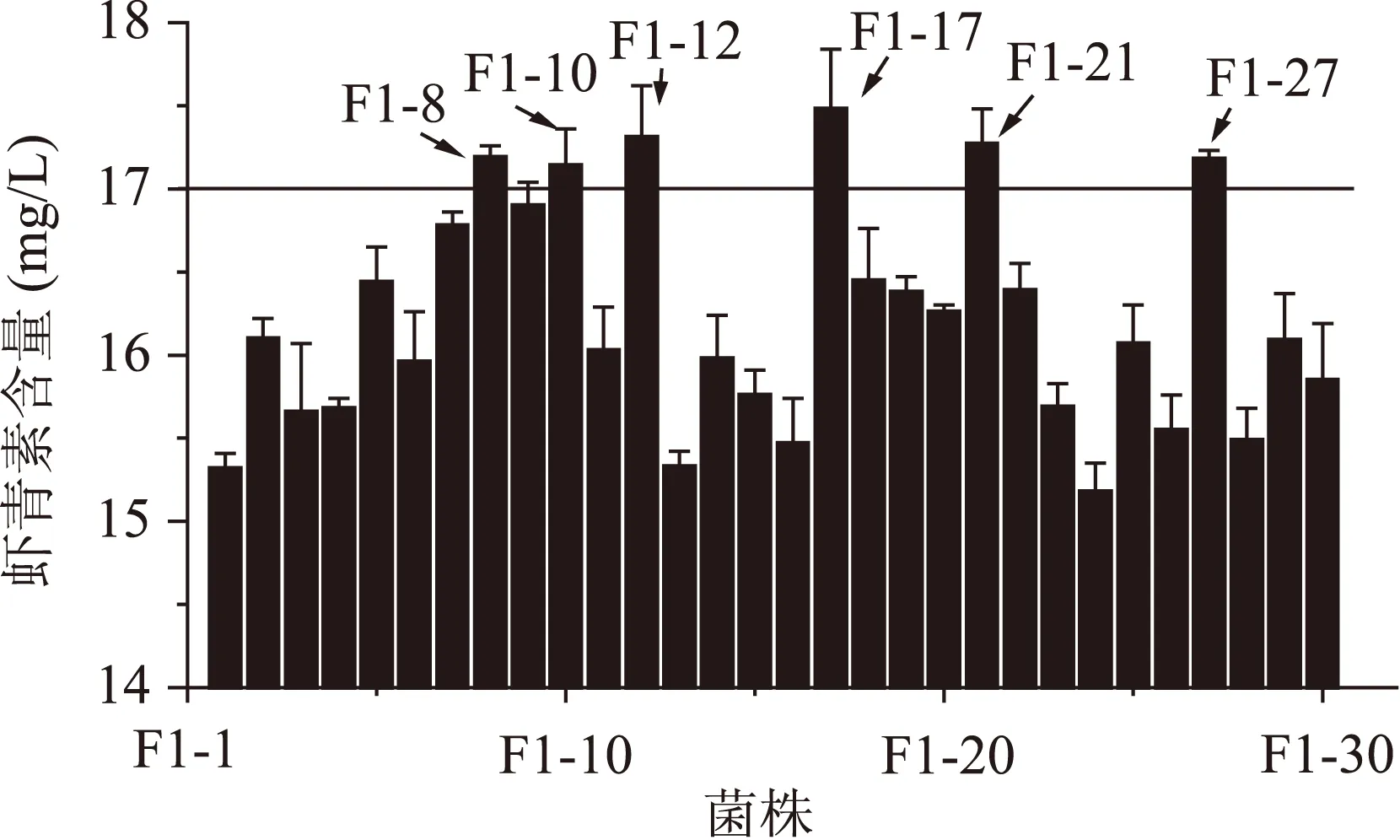
图1 第一轮融合子摇瓶发酵复筛 Fig.1 The screening of the first round generation fusants of shake-flask fermentation
2.2.2第二轮原生质体融合结果第一轮融合子F1-8、F1-10、F1-12、F1-17、F1-21、F1-27作为第二轮融合的出发菌株,进行步骤1.3.2至1.3.5的操作进行原生质体的制备和融合,本轮抗性平板中二苯胺浓度为80 μmol/L。从筛选平板上挑选颜色深且生长较好的30个菌株进行摇瓶复筛,结果如图2。最终得到5株融合子F2-6、F2-11、F2-25、F2-26、F2-28虾青素产量都有所提高,其中F2-28的虾青素产量为(26.91±0.07) mg/L,是原始出发菌株P.Rhodozyma02的5.66倍。
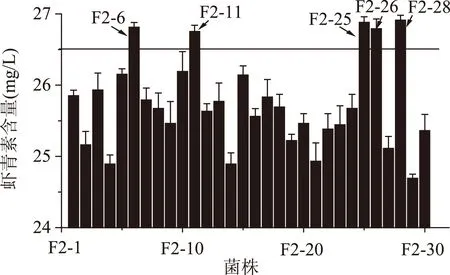
图2 第二轮融合子摇瓶发酵复筛Fig.2 The screening of the second round generation fusants of shake-flask fermentation
2.2.3第三轮原生质体融合结果将第二轮得到的虾青素产量较高的5株融合子作为第三轮融合的出发菌株,步骤同“2.2.2”,本轮抗性平板中二苯胺浓度为160 μmol/L。结果如图3所示,最终得到5株融合子F3-2、F3-8、F3-12、F3-15、F3-19、虾青素产量较高,其中F3-15的虾青素产量为(42.09±1.08) mg/L,是原始出发菌株P.Rhodozyma02的8.86倍。
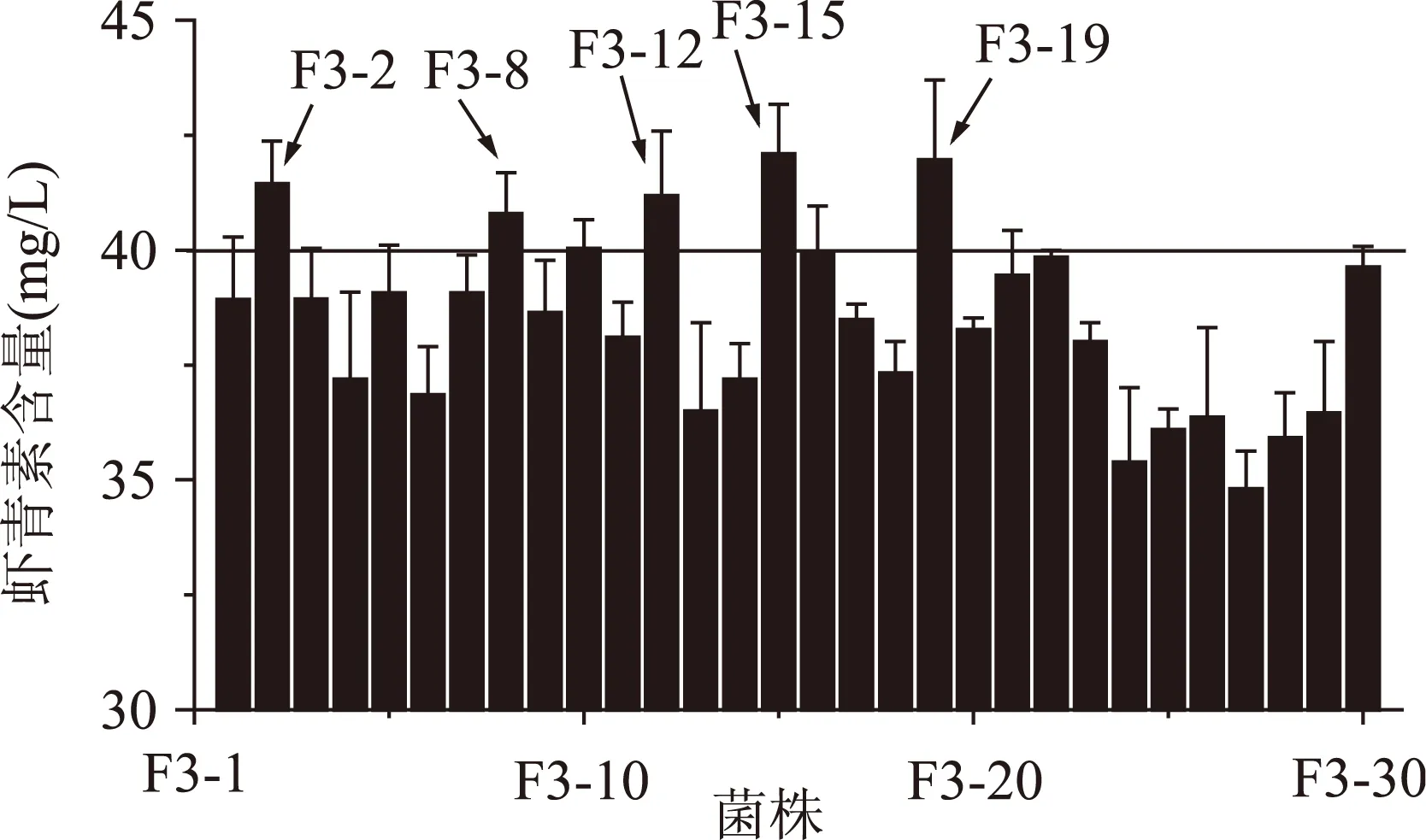
图3 第三轮融合子摇瓶发酵复筛Fig.3 The screening of the third round generation fusants of shake-flask fermentation
2.2.4第四轮原生质体融合结果将第三轮得到的虾青素产量较高的5株融合子作为第四轮融合的出发菌株,步骤同“2.2.2”,本轮抗性平板中二苯胺浓度为240 μmol/L,从筛选平板上挑选颜色深且生长较好的20个菌株进行摇瓶复筛。结果如图4所示,最终得到4株融合子F4-4、F4-7、F4-10、F4-18虾青素产量较高,其中F4-4和F4-10的虾青素产量分别为(56.88±0.74)和(56.89±0.61) mg/L,是原始出发菌株P.Rhodozyma02的11.98倍。
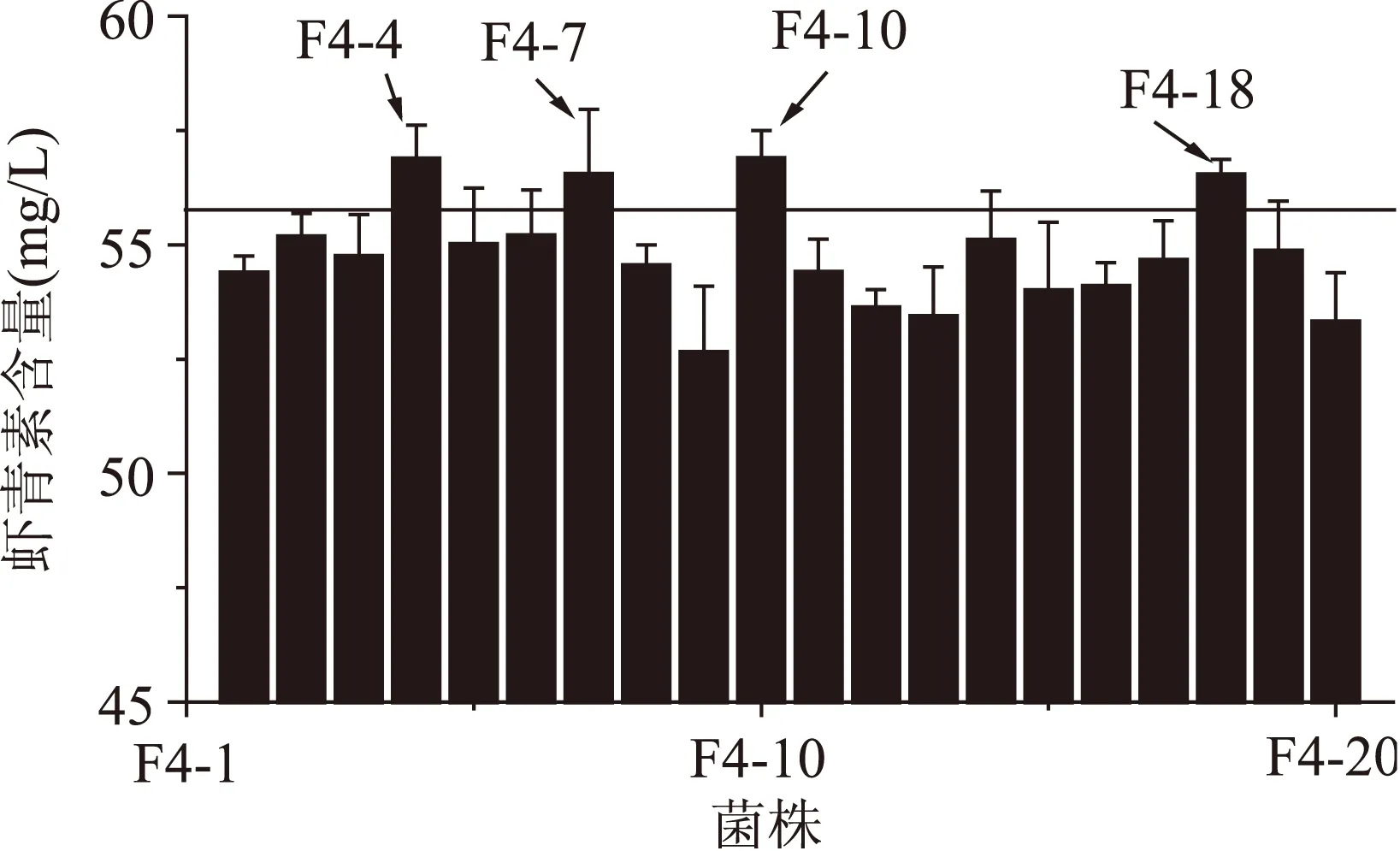
图4 第四轮融合子摇瓶发酵复筛Fig.4 The screening of the fourth round generation fusants of shake-flask fermentation
2.2.5第五轮原生质体融合结果将第四轮得到的虾青素产量较高的4株融合子作为第四轮融合的出发菌株,步骤同“2.2.2”,本轮抗性平板中二苯胺浓度为360 μmol/L,从筛选平板上挑选颜色深且生长较好的10个菌株进行摇瓶复筛。结果如图5所示,最终得到3株融合子F5-2、F5-5、F5-9虾青素产量较高,虾青素产量分别为(67.96±0.69)、(68.09±0.86)和(68.23±0.75) mg/L。
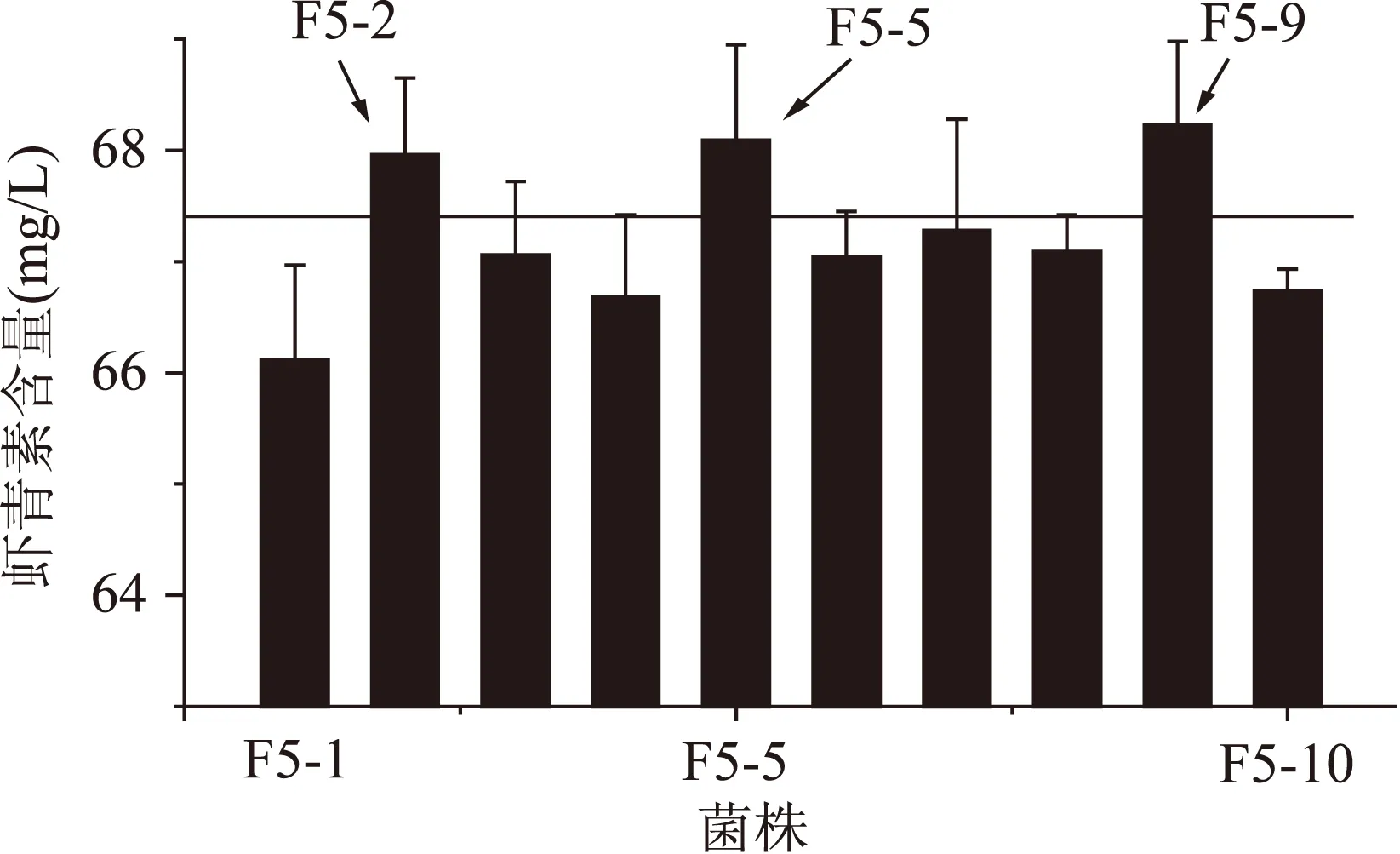
图5 第五轮融合子摇瓶发酵复筛Fig.5 The screening of the fifth round generation fusants of shake-flask fermentation
2.3原生质体融合子稳定性测试结果
通过5轮原生质体融合后得到的3株产量较高的菌株,进行摇瓶稳定性遗传实验,考察菌株稳定性,结果见表3。传代5次后,发现F5-9具有良好的稳定性,体积产量达到(68.10±0.56)mg/L,而F5-2、F5-5遗传稳定性较差,虾青素体积产量不稳定,所以最终得到一株稳产、高产虾青素的法夫酵母菌株F5-9。
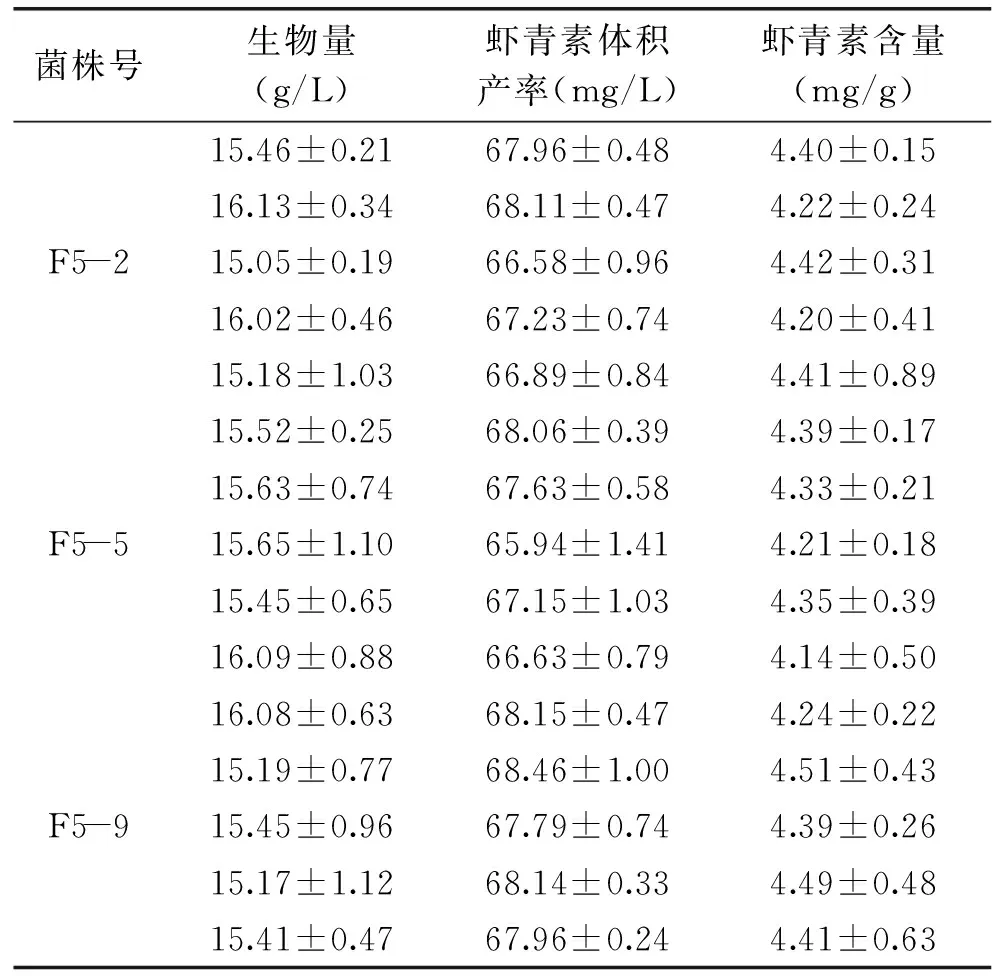
表3 红法夫酵母菌株遗传稳定性实验结果Table 3 Inheritance stability tests of P. rhodozyma mutants
2.4融合菌株F5-9发酵生产虾青素工艺条件的优化
2.4.1天然促进剂选择了橙汁、绿茶汁、胡萝卜汁、番茄汁作为天然促进剂添加到发酵培养基中,各浓度均为100 ml/L,发酵结果见表4。结果表明加入橙汁和胡萝卜汁,生物量和虾青素的体积产量提高较明显,加入番茄汁反而抑制了虾青素的产量,可能是由于菌体在利用番茄汁进行生长的同时合成了其他物质,从而使虾青素的合成受阻。从经济成本角度考虑,最终选择胡萝卜汁作为促进剂添加到发酵培养基中。

表4 天然促进剂对F5-9发酵虾青素产量的影响Table 4 Effect of natural promoter on astaxanthin yield of F5-9
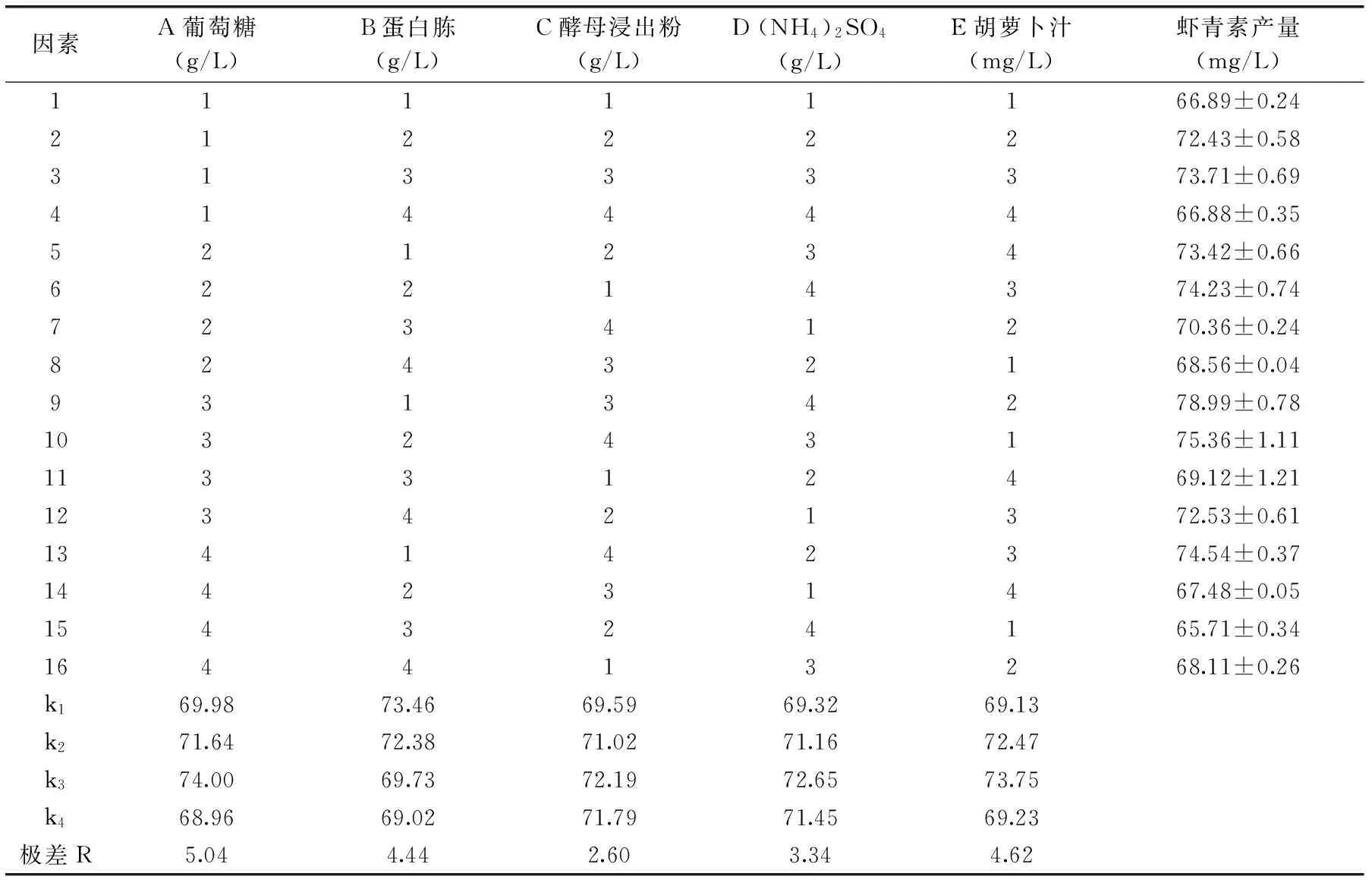
表5 融合菌株F5-9发酵工艺条件优化正交实验结果分析Table 5 Results and analysis of fermentation conditions optimization for the F5-9 fusion strains
2.4.2正交实验结果正交实验结果如表5。各因素的极差R值表明,各因素对融合菌株F5-9发酵生产虾青素产量的影响大小顺序为葡萄糖>胡萝卜汁>蛋白胨>(NH4)2SO4>酵母浸出粉。由表中k值可以确定最适培养基的配方为葡萄糖30.0 g/L,蛋白胨3.0 g/L,酵母浸出粉7.0 g/L,(NH4)2SO45.0 g/L,胡萝卜汁150 mL/L。
2.4.3最优条件下发酵生产虾青素在优化后的条件下发酵生产虾青素,发酵温度22±1 ℃,发酵转速150 r/min,pH5.4,虾青素产量达到最值的时间有所延长,从图6可以看出,虾青素体积产量达到最值的时间为60 h,产量最高达(83.39±1.03) mg/L。发酵时间由原来的48 h延长至60 h,其可能原因是培养基中初始碳源、氮源含量的提高,使菌体的生长时间延长,同时由于天然促进剂胡萝卜汁的添加,进一步促进了虾青素的合成。
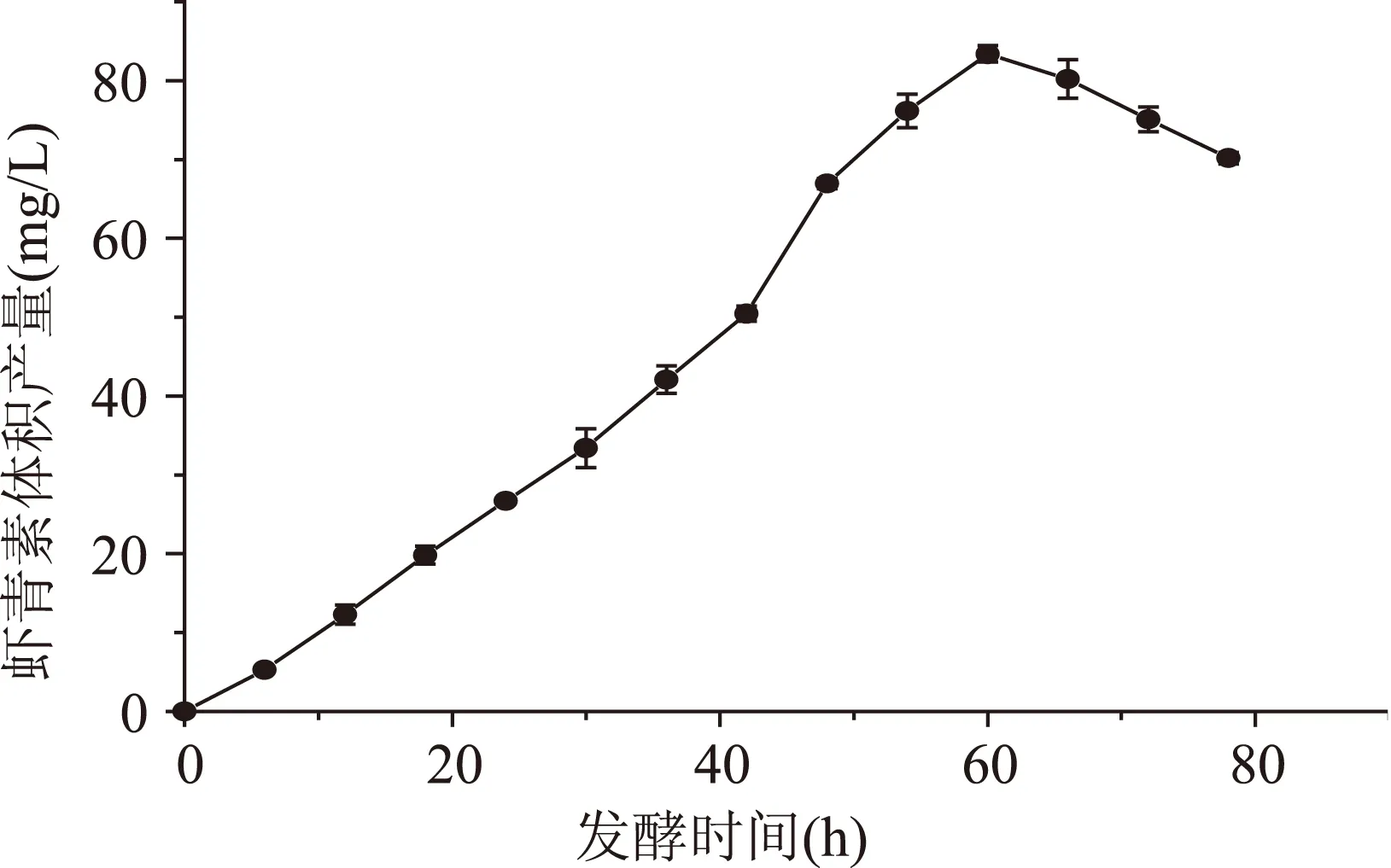
图6 发酵时间对F5-9发酵生产虾青素产量的影响Fig.6 Effect of fermentation time on astaxanthin yield of F5-9
3 结论
基因组重排育种技术作为一种新型、快速、有效的技术,其与经典的诱变育种、原生质体融合技术相比具有明显的优势。文献[6]中依次经过两轮物理复合诱变得到的菌株产量为25.36 mg/L,较原始出发菌株有一定的提高,但是单纯的物理诱变,会使菌株正突变率低,容易导致回复突变,出现“疲劳效应”[17]。本文经诱变和基因组重排最终选育出的一株高产、稳产虾青素的重组红法夫酵母菌株F5-9,虾青素产量达到(68.10±0.56) mg/L,是文献[6]选育出的菌株产量的2.69倍,这样做提高了同源重组的频率,产生各种各样的突变组合,从而达到快速进化菌株表型的目的,实现多亲本的基因水平转移、选育出的子代菌株稳定性与安全性高。
从虾青素生物合成途径可知,番茄红素、β-胡萝卜素等是虾青素合成的重要前体物质,自然界中许多植物中都含有较高的此类前体物质,将其添加到发酵虾青素的培养基中,能在一定程度上促进虾青素的合成,提高虾青素的产量。本文从降低发酵成本考虑,最终选择胡萝卜汁天然促进剂添加到发酵培养基中,并对发酵培养基进行参数优化,最终培养基成份为:葡萄糖30.0 g/L,蛋白胨3.0 g/L,酵母浸出粉7.0 g/L,(NH4)2SO45.0 g/L,MgSO4·7H2O 2.75 g/L,KH2PO41.5 g/L,CaCl2·2H2O 0.2 g/L,胡萝卜汁150 mL/L,得到发酵融合菌株F5-9,虾青素的产量高达(83.39±1.03)mg/L。
[1]Hu C,Han W,Chen Z,et al. Statistical optimization of microwave-assisted astaxanthin extraction from Phaffia rhodozym[C]. Yan Tai:2010 3rdInternational Conference on Biomedical Engineering and Informatics,2010,5:2104-2109.
[2]Mezquita P C,Huerta B B,Ramírez J P,et al. Milks pigmentation with astaxanthin and determination of colour stability during short period cold storage[J]. Journal of Food Science and Technology,2015,52(3):1634-1641.
[3]汪洪涛,徐学明,金征宇. 天然虾青素对金鱼体色变化的影响[J]. 现代食品科技,2013,29(4):749-751.
[4]Tominaga K,Hongo N,Karato M,et al. Cosmetic benefits of astaxanthin on humans subjects[J]. Acta Biochimica Polonica,2012,59(1):43-47.
[5]Yoshida H,Yanai H,Ito K,et al. Administration of natural astaxanthin increases serum HDL-cholesterol and adiponectin in subjects with mild hyperlipidemia[J]. Atherosclerosis,2010,209(2):520-523.
[6]胡向东,潘玲燕,章祺,等. 复合诱变选育高产虾青素的红法夫酵母菌株[J]. 食品与发酵工业,2014,40(10):58-68.
[7]龚玉姣,屈平华,曹理想,等. 协同诱变法选育虾青素高产优良酵母菌株[J]. 微生物学杂志,2010,30(1):16-20.
[8]Stemmer W P C. Rapid evolution of a proteininvitroby DNA shuffling[J]. Nature,1944,370(6488):389-391.
[9]Zhang Y X,Perry K,Vinci V A,et al. Genome shuffling leads to phenotypic improvement in bacteria[J]. Nature,2002,415(6872):644-646.
[10]Wang Y H,Li Y,Pei X L,et al. Genome shuffling improved acid tolerance and L-lactic acid volumetric productivity in Lactobacillus rhamnosus[J]. Journal of Biotechnologica,2007,129(3):510-515.
[11]Wang M Z,Liu S S,Li Y Y,et al. Protoplast mutation and genome shuffling induce the endophytic fungus Tubercularia sp. TF5 to produce new compounds[J]. Current Microbiology,2010,61(4):254-260.
[12]胡向东,朱静,梁新乐. 一株高产天然虾青素的红法夫酵母菌株及其选育方法和应用[P]. 中国专利,201210321949.2. 2013-01-09.
[13]郑宗宝. 基于基因组重排技术的红法夫酵母虾青素高产株选育[D]. 天津:天津大学,2009.
[14]曲秋皓,宁国赞. 红色酵母原生质体形成和再生条件的研究[J]. 工业微生物,1998,28(4):38-41.
[15]张丽敏,华艳艳,孙玉梅,等. 红发夫酵母生物合成虾青素天然促进剂的研究[J]. 河南工业大学学报2011,32(1):66-69.
[16]朱晓立,梁世中,邓毛程. 几种物质对红发夫酵母生长和虾青素合成的影响[J]. 食品科技,2008,33(12):20-23.
[17]魏希颖,王家稳,刘清梅,等. 基因组重排技术在微生物菌种选育中的应用[J]. 陕西师范大学学报,2013,41(5):68-72.
Screening and fermentation optimization of a high-yield-astaxanthin-producingPhaffiarhodozyma
HU Xiang-dong,PAN Ling-yan*,YE Mao,HU Wei-qing
(Zhejiang Crown Technology Co.Ltd,Hangzhou 310012,China)
Objective:To screen out a high-yield-astaxanthin-producingPhaffiarhodozymaand optimize the culture medium conditions. Method:Phaffiarhodozymastrain(P. rhodozyma 02)was used as original strain treated with UV-LiCl and60Co-γ mutagenesis respectively. Mutant strains with higher astaxanthin productivity were screened out and used as the starting strains for genome shuffling. After 5 rounds of protoplast fusion,obtained the best recombinant with further high yield of astaxanthin. The optimum culture medium conditions was obtained by adding natural promoter rich in synthetic precursor of astaxanthin to the medium and optimizing the parameter of culture medium. Result:a high-yield-astaxanthin-producing recombinant F5-9 was obtained and the optimum culture medium conditions were:glucose 30.0 g/L,peptone 3.0 g/L,yeast extract powder 7.0 g/L,(NH4)2SO45.0 g/L,MgSO4·7H2O 2.75 g/L,KH2PO4 1.5 g/L,CaCl2·2H2O 0.2 g/L,carrot juice 150 mg/L. Eventually the astaxanthin production reached at(83.39±1.03)mg/L,which was 17.56 times than the original strain. Conclusion:The traditional mutation and genome shuffling can significantly improve the yield of astaxanthin and there is room for further improvement in the yield of astaxanthin by adding natural promoter rich in synthetic precursor of astaxanthin carrot juice into culture medium.
Phaffiarhodozyma;astaxanthin;mutagenesis;genome shuffling;parameter optimization
2015-06-05
胡向东(1957-),男,硕士,主要从事微生物发酵及动物营养方面的研究,E-mail:hxd@zjcrown.cn。
潘玲燕(1987-),女,硕士,主要从事微生物发酵及提取方面的研究,E-mail:ply1987@126.com。
国家重点新产品计划项目资助(2010GRC20064);国家发改委绿色农用生物产品高技术产业化专项资助项目(发改高技【2011】1158号)。
TS202.3
B
1002-0306(2016)05-0142-06
10.13386/j.issn1002-0306.2016.05.019

