新型5-取代吲哚-3-甲酰胺化合物的合成
焦林如, 王新颖, 刘益州, 康从民
(青岛科技大学 化工学院,山东 青岛 266042)
·快递论文·
新型5-取代吲哚-3-甲酰胺化合物的合成
焦林如, 王新颖, 刘益州, 康从民*
(青岛科技大学 化工学院,山东 青岛266042)
以5-取代吲哚为原料,经维尔斯迈尔-哈克反应制得5-取代吲哚-3-甲醛(2a~2e); 2a~2e在DMF催化下,与盐酸羟胺反应制得5-取代吲哚-3-甲腈(3a~3e); 3a~3e在H2O2和NaOH溶液中水解合成了5-取代吲哚-3-甲酰胺(4a~4e, 4b~4e为新化合物),产率62.0%~75.0%,其结构经1H NMR,13C NMR和ESI-MS表征。
5-取代吲哚; 5-取代吲哚-3-甲酰胺; 中间体合成
吲哚衍生物是自然界中常见的杂环化合物之一,在医药领域应用十分广泛,很多药物中均含有吲哚环结构[1]。吲哚衍生物可作为神经保护剂[2],强效阿片受体激动剂[3],外周神经病变和神经退行性疾病药物[4],葡萄糖激酶激动剂[5-6],心血管疾病药物[7]等。此外,吲哚衍生物还可用于染料和植物生长调节[8]。
吲哚-3-甲酰胺(A)是合成含吲哚环药物的重要中间体。A主要通过吲哚与氯磺酰异氰酸酯反应制得[9]。该路线存在的主要问题是:氯磺酰异氰酸酯极易水解,腐蚀性和毒性较强。
本文以5-取代吲哚(1a~1e)为原料,经维尔斯迈尔-哈克反应制得5-取代吲哚-3-甲醛(2a~2e); 2a~2e与盐酸羟胺反应制得5-取代吲哚-3-甲腈(3a~3e); 3a~3e在H2O2和NaOH溶液中水解合成了5-取代吲哚-3-甲酰胺(4a~4e, 4b~4e为新化合物,Scheme 1),产率62.0%~75.0%,其结构经1H NMR,13C NMR和ESI-MS表征。
1 实验部分
1.1仪器与试剂
XT-4型显微熔点仪;Bruker NMR 500 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);XE-VO G2-XS型质谱仪。
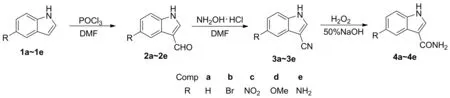
Scheme 1
所用试剂均为分析纯。
1.2合成
(1) 2a~2e的合成(以2a为例)[10-11]
搅拌下,在三口烧瓶中加入DMF 2.5 mL,冰浴冷却下(温度<10 ℃)缓慢滴加POCl31 mL(0.01 mol),滴毕,反应10 min;缓慢滴加1a 10 mmol的DMF(2 mL)溶液(温度<15 ℃),滴毕,于40 ℃反应至终点(TLC检测)。加入适量冰水,用30%NaOH溶液调至pH≈8,析出大量沉淀,抽滤,滤饼真空干燥后用乙醇重结晶得2a。
用类似的方法合成2b~2e。
吲哚-3-甲醛(2a): 橙色晶体,产率96.1%, m.p.195~197 ℃(192~194 ℃[10]);1H NMRδ: 7.20~7.27(m, 2H, ArH), 7.50(d,J=8.0 Hz, 1H, ArH), 8.09(d,J=7.65 Hz, 1H, ArH), 8.28(s, 1H, ArH), 9.93(s, 1H, CHO), 12.13(s, 1H, NH)。
5-溴-吲哚-3-甲醛(2b): 白色晶体,产率92.0%, m.p.201~203 ℃(204~207 ℃[12]);1H NMRδ: 7.40(d,J=8.5 Hz, 1H, ArH), 7.50(d,J=9.0 Hz, 1H, ArH), 8.21(s, 1H, ArH), 8.33(s, 1H, ArH), 9.91(s, 1H, CHO), 12.31(s, 1H, NH)。
5-硝基-吲哚-3-甲醛(2c): 黄绿色固体,产率96.4%, m.p.303~305 ℃(301~302 ℃[12]);1H NMRδ: 7.72(d,J=9.0 Hz, 1H, ArH), 8.15(d,J=9.0 Hz, 1H, ArH), 8.57(s, 1H, ArH), 8.93(s, 1H, ArH), 10.02(s, 1H, CHO), 12.70(s, 1H, NH)。
5-甲氧基-吲哚-3-甲醛(2d): 白色晶体,产率98.7%, m.p.177~179 ℃(182~183 ℃[13]);1H NMRδ: 3.79(s, 3H, OCH3), 6.88(d,J=8.5 Hz, 1H, ArH), 7.40(d,J=9.0 Hz, 1H, ArH), 7.58(s, 1H, ArH), 8.22(s, 1H, ArH), 9.90(s, 1H, CHO), 12.02(s, 1H, NH)。
5-氨基-吲哚-3-甲醛(2e): 棕色固体,产率93.6%, m.p.249~251 ℃;1H NMRδ: 4.78(s, 2H, NH2), 6.91(d,J=8.5 Hz, 1H, ArH), 7.41(s, 1H, ArH), 7.83(d,J=8.5 Hz, 1H, ArH), 8.33(s, 1H, ArH), 9.92(s, 1H, CHO), 11.96(s, 1H, NH)。
(2) 3a~3e的合成(以3a为例)
搅拌下,在三口烧瓶中加入2a 30 mmol,盐酸羟胺36 mmol和DMF 13 mL,于110 ℃反应至终点(TLC检测)。冷却至室温,加入适量冰水,析出大量沉淀,抽滤,滤饼干燥得3a。
用类似的方法合成3b~3e。
吲哚-3-甲腈(3a): 紫红色晶体,产率93.0%, m.p.176~178 ℃(177~178 ℃[14]);1H NMRδ: 7.22~7.30(m, 2H, ArH), 7.55(d,J=8.0 Hz, 1H, ArH), 7.63(d,J=7.5 Hz, 1H, ArH), 8.25(s, 1H, ArH), 12.19(s, 1H, NH)。
5-溴-吲哚-3-甲腈(3b): 淡紫色固体,产率90.1%, m.p.206~208 ℃;1H NMRδ: 7.42(d,J=9.0 Hz, 1H, ArH), 7.52(d,J=8.5 Hz, 1H, ArH), 7.80(s, 1H, ArH), 8.31(s, 1H, ArH), 12.40(s, 1H, NH)。
由于该步反应所得产物单一,原料反应完全,故仅对有代表性的两个化合物进行了结构确认,其余化合物直接投入下一步反应。
(3) 4a~4e的合成(以4a为例)[15]
在三口烧瓶中加入3a 4 mmol和乙醇3 mL,搅拌使其溶解;加入50%NaOH溶液2 mL和30%H2O228 mmol,于室温反应至终点(TLC检测)。抽滤,滤饼用水洗涤,真空干燥后用乙醇重结晶得4a。
用类似的方法合成4b~4e。
吲哚-3-甲酰胺(4a): 白色固体,产率75.0%, m.p.195~197 ℃(197~199 ℃[11]);1H NMRδ: 6.84(s, 1H, NH), 7.13~7.21(m, 2H, ArH), 7.47(d,J=8.0 Hz, 2H, ArH), 8.08(s, 1H, NH), 8.20(d,J=7.5 Hz, 1H, ArH), 11.60(s, 1H, NH);13C NMRδ: 110.09, 112.03, 118.91, 121.62, 122.21, 128.45, 131.69, 138.55, 166.87; EI-MSm/z: 160.2。
5-溴-吲哚-3-甲酰胺(4b): 白色固体,产率66.5%, m.p.238~240 ℃;1H NMRδ: 6.88(s, 1H, NH), 7.26(d,J=8.5 Hz, 1H, ArH), 7.40(d,J=8.5 Hz, 1H, ArH), 7.49(s, 1H, NH), 8.07(s, 1H, ArH), 8.30(s, 1H, ArH), 11.72(s, 1H, NH);13C NMRδ: 112.21, 113.37, 113.70, 121.55, 125.08, 129.11, 131.70, 135.95, 166.83; EI-MSm/z: 239.1。
5-硝基-吲哚-3-甲酰胺(4c): 绿色固体,产率62.5%, m.p.299~300 ℃;1H NMRδ: 7.07(s, 1H, NH), 7.62(d,J=9.0 Hz, 1H, ArH), 7.67(s, 1H, NH), 8.03(d,J=9.5 Hz, 1H, ArH), 8.27(s, 1H, ArH), 9.08(s, 1H, ArH);13C NMRδ: 112.19, 112.85, 114.16, 126.77, 127.20, 130.91, 132.65, 144.23, 166.96; EI-MSm/z: 205.2。
5-甲氧基-吲哚-3-甲酰胺(4d): 淡黄色固体,产率62.0%, m.p.228~230 ℃;1H NMRδ: 3.75(s, 3H, OCH3), 6.75(d,J=8.8 Hz, 1H, ArH), 6.78(s, 1H, NH), 7.29(d,J=8.8 Hz, 1H, NH), 7.37(s, 1H, NH), 7.64(s, 1H, ArH), 7.97(s, 1H, ArH), 11.41(s, 1H, ArH);13C NMRδ: 55.69, 103.02, 110.61, 112.52, 112.95, 127.42, 129.31, 131.70, 154.81, 167.21; EI-MSm/z: 190.2。
5-氨基-吲哚-3-甲酰胺(4e): 黄色固体, 产率64.2%, m.p.217~219 ℃;1H NMRδ: 4.64(s, 2H, NH2), 7.01(d,J=8.0 Hz, 1H, ArH), 7.53(s, 1H, ArH), 7.87(d,J=8.0 Hz, 1H, ArH), 8.25(s, 1H, ArH), 8.44(s, 2H, NH2), 12.08(s, 1H, NH);13C NMRδ: 103.38, 107.29, 112.57, 113.06, 127.14, 128.33, 131.07, 145.26, 167.71; EI-MSm/z: 175.2。
2 结果与讨论
2.1合成
(1) 3的合成
合成3的传统方法是以甲酸为溶剂,吲哚-3-甲醛在甲酸钠作用下脱水生成[16-17]。该方法所需温度较高,原料反应不完全,产物复杂,纯化困难。实验中用DMF催化2与盐酸羟胺的反应合成3,操作简单,产物单一,产率较高(93.0%)。
为进一步优化3的合成条件,以3a的合成为例,研究了投料比r[n(2) ∶n(NH4OH·HCl)]和反应温度对3a产率的影响。
2a 30 mmol,其余反应条件同1.2(2),考察r对3a产率的影响,结果见表1。

表1 r对3a产率的影响*
*2a 30 mmol,其余反应条件同1.2(2)。
由表1可见,随着盐酸羟胺用量逐渐增大,3a产率逐渐升高,当r=1.0 ∶1.2时,产率最高(93.0%)。因此,最佳r=1.0 ∶1.2。
2a 30 mmol,r=1.0 ∶1.2,其余反应条件同1.2(2),考察反应温度对3a产率的影响,结果见表2。

表2 反应温度对3a产率的影响*
*2a 30 mmol,r=1.0 ∶1.2,其余反应条件同表1。
由表2可见,温度升高,3a产率提高,当反应温度超过110 ℃,产率反而降低。因此,最佳反应温度为110 ℃。
综上可见,合成3a的最优条件为:2a 30 mmol,r=1.0 ∶1.2,于110 ℃反应至终点,3a产率93.0%。
(2) 4的合成
为优化4的合成条件,以4a的合成为例,3a 4 mmol,其余反应条件同1.2(3),研究了NaOH溶液浓度和物料比η[n(3a) ∶n(H2O2)]对4a产率的影响,结果见表3和表4。
由表3可见,NaOH溶液浓度增大,4a产率提高,当NaOH溶液浓度为50%时,产率最高(75.0%)。因此,最佳NaOH溶液浓度为50%。
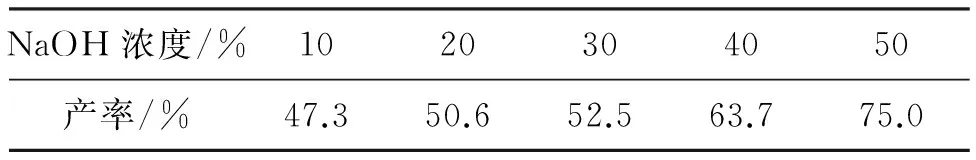
表3 NaOH溶液浓度对4a产率的影响*
*3a 4 mmol,其余反应条件同1.2(3)。
3a 4 mmol, 50%NaOH溶液2 mL,其余反应条件同1.2(3),考察η对4a产率的影响,结果见表4。

表4 η对4a产率的影响*
*3a 4 mmol, 50%NaOH溶液2 mL,其余反应条件同1.2(3)。
由表4可见,4a产率随H2O2用量增加而提高,当η=1 ∶7时,产率最高(75.0%)。因此,最佳η=1 ∶7。
[1]Takayama H, Tsutsumi S, Kitajima M,etal. Gluco-indole alkaloids from nauclea cadamba in Thailand and transformation of 3.α-Dihydrocadambine into the indolopyridine alkaloid,16-carbomethoxynaufoline[J].Chemical and Pharmaceutical Bulletin,2003,51(2):232-233.
[2]Humphrey G R, Kuethe J T. Practical methodologies for the synthesis of indoles[J].Chemical Reviews,2006,106(7):2875-2911.
[3]Takayama H, Misawa K, Okada N,etal. New procedure to mask the 2,3-πbond of the indole nucleus and its application to the preparation of potent opioid receptor agonists with a corynanthe skeleton[J].Organic Letters,2006,8(25):5705-5708.
[4]Bratulescu G. A new and efficient one-pot synthesis of indoles[J].Tetrahedron Letters,2008,49(6):984-986.
[5]Yasuma T, Ujikawa O, Itoh M,etal. Indole compound:US 8 410 087[P].2013.
[6]Heinrich T, Blaukat A, Staehle W,etal. Azaheterocyclic compounds as kinase inhibitors:US 8 859 581[P].2014.
[7]Bischoff H, Dittrich W E, Wuttke M,etal. Indolin phenylsulfonamide derivatives:US 10/519 125[P].2003.
[8]刘璐,朱美霞,辛春伟. 5-取代吲哚化合物的合成研究[J].天津理工大学学报,2014,30(3):54-56.
[9]Carbone A, Parrino B, Vita G D,etal. Synthesis and antiproliferative activity of thiazolyl-bis-pyrrolo [2,3-b] pyridines and indolyl-thiazolyl-pyrrolo [2,3-c] pyridines,nortopsentin analogues[J].Marine Drugs,2015,13(1):460-492.
[10]葛裕华,吴亚明,薛忠俊. 取代吲哚-3-甲醛类化合物的合成[J].有机化学,2006,26(4):563-567.
[11]Guo X, Yang Q, Xu J,etal. Design and bio-evaluation of indole derivatives as potent Kv1.5 inhibitors[J].Bioorganic & Medicinal Chemistry,2013,21(21):6466-6476.
[12]Dubey P K, Babu B, Narayana M V. Synthesis ofN-alkyl/aralkyl derivatives of indole-3-aldehydes using TEBAC as phase transfer catalyst[J].Indian Journal of Heterocyclic Chemistry,2006,15(3):205-208.
[13]Coowar D, Bouissac J, Hanbali M,etal. Effects of indole fatty alcohols on the differentiation of neural stem cell derived neurospheres[J].Journal of Medicinal Chemistry,2004,47(25):6270-6282.
[14]Lee K Y, Lee H S, Kim J N. Synthesis of indoles and benzisoxazolines from Baylis-Hillman adducts of 2-nitrobenzaldehydes[J].Bulletin-korean Chemical Society,2007,28(2):333.
[15]Ferro S, De Grazia S, De Luca L,etal. Structural modification of diketo acid portion in 1H-benzylindole derivatives HIV-1 integrase inhibitors[J].Heterocycles,2009,78(4):947-959.
[16]Kumar D, Narayanam M K, Chang K H,etal. Synthesis of novel indolyl-1,2,4-triazoles as potent and selective anticancer agents[J].Chemical Biology & Drug Design,2011,77(3):182-188.
[17]Kumar D, Kumar N M, Chang K H,etal. Synthesis andin-vitroanticancer activity of 3,5-bis (indolyl)-1,2,4-thiadiazoles[J].Bioorganic & Medicinal Chemistry Letters,2011,21(19):5897-5900.
Synthesis of Novel 5-Substituted-1H-indole-3-carboxamides
JIAO Lin-ru,WANG Xin-ying,LIU Yi-zhou,KANG Cong-min*
(College of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, China)
5-Substitued-indole-3-formaldehydes(2a~2e) were prepared by Vilsmeier-Haack reaction from 5-substituted indoles. 5-Substituted indole-3-methyl cyanides(3a~3e) were obtained by the reaction of 2a~2e with hydroxylamine hydrochloride, using DMF as catalyst. 5-Substituted indole-3-carboxamides(4a~4e, 4b~4e were novel compounds) with yield of 62.0%~75.0% were synthesized by hydrolyzation of 3a~3e in H2O2-NaOH solution. The structures were characterized by1H NMR,13C NMR and ESI-MS.
5-substitued indole; 5-substituted indole-3-carboxamide; intermediate synthesis
2016-01-19;
2016-06-23
国家自然科学基金资助项目(21072111, 21272131)
焦林如(1988-),女,汉族,山东菏泽人,硕士研究生,主要从事药物合成的研究。
通信联系人: 康从民,博士,教授, E-mail: lvyingtao@qust.edu.cn
O625.6; O626.1
A
10.15952/j.cnki.cjsc.1005-1511.2016.08.16025

