改良组织块法培养C57BL/6小鼠胰腺星状细胞
赵朕华 王录美 刘牧云 朱曙光 于金 赵安静 胡良皞 满晓华 金晶 吴洪玉 高军 刘善荣 李兆申 廖专
·论著·
改良组织块法培养C57BL/6小鼠胰腺星状细胞
赵朕华王录美刘牧云朱曙光于金赵安静胡良皞满晓华金晶吴洪玉 高军刘善荣李兆申廖专
目的通过改良传统组织块法培养C57BL/6小鼠胰腺星状细胞(PSCs),建立一种简便易行、快速获得大量小鼠PSCs的培养方法。方法分离C57BL/6小鼠胰腺组织,经胎牛血清清洗后剪切成0.5~1 mm3组织块,经贴壁培养4 d取原代PSCs,并传代。采用油红O染色观察细胞内脂滴变化,采用细胞免疫法及蛋白质印迹法检测细胞α-SMA、Desmin表达。结果贴壁4 d的原代PSCs多呈椭圆形或星形,胞质内大量脂滴,表达α-SMA及Desmin蛋白的细胞少;传代后细胞变大、伪足丰富,脂滴减少或消失,原代、传代PSCs的α-SMA蛋白相对表达量分别为0.653±0.071、2.290±0.055,传代细胞的表达显著高于原代细胞(P<0.05),表达Desmin蛋白的细胞数量显著增加。结论改良组织块法可高产和高纯度地获得小鼠静息态和激活态两种状态的PSCs,可以满足体外研究的需要。
组织培养技术;胰腺星形细胞;细胞分离;体外研究
胰腺的进行性纤维化是慢性胰腺炎(CP)的典型病理特征,胰腺星状细胞(pancreatic stellate cell,PSCs)是胰腺纤维化的主要效应细胞,在CP的发病机制中至关重要,成功分离和培养PSCs是体外研究CP的重要前提。目前,分离和培养PSCs的经典方法是酶消化联合梯度离心法,但该操作繁琐、不易掌握、耗时耗力、细胞得率低,影响实验进程。1998年Bachem等[1]首次提出采用组织块法分选PSCs,但仅成功分离人源性和鼠源性CP组织中的PSCs,且以活化细胞为主,而正常大鼠PSCs分离失败。近年来国内外学者报道了组织块法培养静息态PSCs的研究,但需借助外源性胰酶抑制剂、梯度离心分选或酶消化法[2-4]。本研究改进了已报道的组织块法,建立一种简单易行、利用率高、能分离正常小鼠静止态和活化态两种PSCs的培养方法,现报道如下。
材料和方法
一、实验动物及试剂
清洁级雄性C57BL/6小鼠,体重20 g左右,购自第二军医大学实验动物中心。胰酶购自美国Sigma公司,油红O染料购自上海普飞生物技术有限公司,兔抗小鼠α-平滑肌肌动蛋白(α-SMA)、兔抗小鼠结蛋白(Desmin)、兔抗小鼠CK19均购自美国Abcam公司,HRP标记的羊抗兔IgG购自台湾Arigo公司,FITC标记的羊抗兔IgG及DNA Marker购自上海威奥生物科技有限公司,BCA Protein Assay Kit购自美国Pierce公司, PVDF膜购自上海赛戈生物科技有限公司,超敏ECL化学发光液购自上海赛戈生物科技有限公司。
二、方法
1.PSCs分离:用乙醚麻醉小鼠后,75%乙醇浸泡小鼠腹部消毒5 min,剖腹取出胰腺,在含有青、链霉素的胎牛血清中清洁后,反复剪切组织至0.5~1 mm3,然后将组织块均匀铺在培养皿中,每个组织块间距为0.2~0.5 cm,倒置于孵育箱15~30 min。待组织块贴壁后,沿培养皿边缘缓慢加入适量含15%胎牛血清和青、链霉素的DMEM,置37℃、5% CO2的孵育箱培养,3 d换液一次。
2.PSCs传代培养:组织块培养4 d后,贴壁生长的细胞密度达40%~60%,此为原代PSCs。用一次性巴氏滴管轻柔吹打组织块,待组织块离壁后,和培养液一起转移至15 ml离心管,1 500 r/min离心5 min,弃培养液,加入适量胎牛血清,1 500 r/min离心5 min,弃血清,将组织块置新培养皿重新贴壁培养。已有原代PSCs贴壁的原培养皿加入新鲜培养液继续培养至第7~8天,待细胞密度达80%~90%时弃培养液,PBS洗涤细胞2次,将500 μl PBS和500 μl胰酶混合均匀后加入培养皿,轻轻摇动15~20 s后吸除胰酶溶液,置入37℃、5% CO2的饱和湿度培养箱内消化2 min,显微镜下观察到星形贴壁细胞变圆后立即加适量培养液终止消化,用1 ml移液枪轻柔吹打,使细胞脱壁并分散成单个细胞,按2∶3比例传代,传代第2天换液,之后每2~3 d换液。
3.PSCs鉴定:倒置显微镜观察PSCs的形态结构,主要包括细胞形状、胞内脂滴、细胞核等。
脂滴观察采用油红O染色。应用4%多聚甲醛固定原代或传代PSCs 30 min,PBS漂洗3遍后加入油红O染液常温染色20 min,PBS漂洗3遍,60%乙醇分化,显微镜下观察背景清晰后,PBS漂洗3遍,封片,镜下观察并摄片。
α-SMA检测采用细胞免疫化学法。应用4%多聚甲醛固定原代或传代PSCs 30 min,PBS漂洗3遍后加入0.5% Triton X-100 37℃孵育30 min,5% BSA室温封闭30 min,加α-SMA一抗4℃孵育过夜,PBS漂洗后加HRP标记IgG室温孵育80 min,DAB显色,梯度乙醇脱水后封片,镜下观察并摄片。同时采用蛋白质印迹法常规检测原代或传代PSCs的α-SMA蛋白表达,以GAPDH为内参。应用Amersham imager 600软件获取条带的灰度值,以目的条带与内参条带灰度值比表示蛋白相对表达量。
Desmin检测采用细胞免疫荧光法。方法基本同上,二抗为FITC标记IgG,最后加DAPI避光孵育5 min,核复染,抗荧光淬灭剂封片,荧光显微镜下避光摄片。
三、统计学处理
结 果
一、PSCs形态学观察
组织块贴壁第4天,原代PSCs细胞呈放射状爬出,在组织块周围形成“生长晕”,组织块近侧细胞多呈圆形、椭圆形,远侧细胞呈三角、四角、五角等多种星形,细胞胞质内可见高亮环形脂滴,越靠近胞核处脂滴越多;传代后的细胞体积增大,扁平,立体感消失,伪足丰富,呈“星芒状”,脂滴减少或消失,胞核较大,核仁明显,呈“鱼眼样”(图1)。油红O染色见贴壁第4天原代细胞内脂肪滴呈红染颗粒状,簇集成团,环绕于胞核周围;传代细胞未见明显着色(图1)。
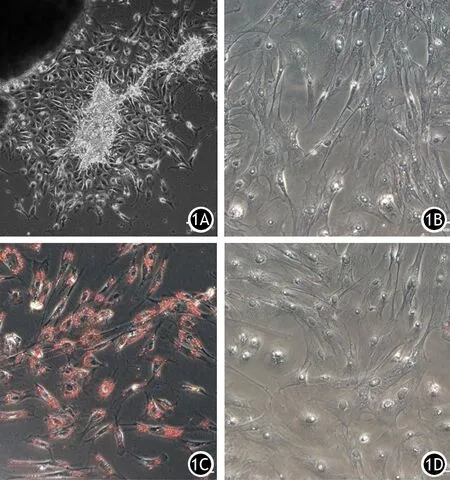
图1 组织块法分离的原代、传代PSCs(1A、1B)及其脂滴变化(1C、1D,油红O染色;1A、1C 100 μm,1B、1D 50 μm)
二、PSCs的α-SMA、Desmin蛋白表达
细胞免疫化学染色法见少数原代细胞α-SMA蛋白表达阳性,传代细胞中绝大多数胞质染成棕褐色,α-SMA蛋白表达阳性,高倍镜下见排列整齐的棕褐色肌丝(图2)。蛋白质印迹法显示原代、传代PSCs的α-SMA蛋白相对表达量分别为0.653±0.071、2.290±0.055,传代细胞的表达量显著高于原代细胞,差异有统计学意义(t=31.498,P<0.05,图3)。
细胞免疫荧光染色法见贴壁第4天的原代细胞和传代细胞均有部分细胞胞质内呈现红色荧光,传代细胞核外红色荧光面积大于原代细胞,并可见清晰的红色肌丝(图4)。

图2 传代PSCs α-SMA表达(细胞免疫化学染色,50 μm) 图3 原代(1)及传代PSCs(2)α-SMA蛋白表达(蛋白质印迹法)

图4 原代(4A)、传代(4B)PSCs Desmin表达(细胞免疫荧光染色 50 μm)
PSCs在CP、胰腺癌以及CP癌变等疾病的发病机制中起着至关重要的作用[5-9]。最初PSCs是在小鼠胰腺中被发现,以富含维生素A为特点[10],后相继在大鼠和人胰腺中分离获得[11-12],为胰腺相关疾病的机制研究奠定了基础。
目前,静息态PSCs分选主要采用酶消化联合梯度离心法[1,12-16],而组织块法提取的PSCs多为激活状态[12,17]。组织块法分离静息态PSCs仍需借助外源性胰酶抑制剂、梯度离心分选纯化或酶消化法等,不仅成本高,而且操作繁琐[2-4]。本研究采用改良的组织块法分离正常小鼠PSCs,与已报道的研究相比,改用了胎牛血清清洗新鲜分离的胰腺组织,抑制胰酶消化,并及时补给组织、细胞离体后所需的营养,提高了细胞的存活率。此外,在组织块贴壁后第2天就换液也是为了减少胰酶对组织细胞的损伤。
PSCs对胰酶的作用十分敏感,故传代时应严格控制细胞与胰酶的接触量和接触时间。本研究在细胞传代时将胰酶按1∶1稀释,降低胰酶的作用浓度,并缩短细胞和胰酶的接触时间为15~20 s,置入37℃孵育箱2 min,凭借培养皿中残留的胰酶继续消化细胞,成功地分离了活性好、传代成活率高的PSCs。本方法简便易行、细胞得率高且组织块重复使用率高。
静息状态的PSCs胞质内富含脂肪滴,在活化过程中细胞形态发生改变,呈成纤维细胞样,脂肪滴逐渐减少、消失,α-SMA表达增加[18],而Desmin在静息和活化状态下均有表达,因此,脂肪滴、α-SMA和Desmin可作为鉴定PSCs的指标。脂肪滴主要用于静息态细胞的鉴定,α-SMA用于活化细胞的鉴定[1,12,15,17-18]。本研究结果显示,组织块贴壁第4天在高倍显微镜下观察到贴壁生长的细胞,其胞核周围可见大量环状高亮脂滴,油红O染色呈现为红染颗粒,而α-SMA低表达;细胞传代后,脂滴消失,油红O染色阴性,α-SMA高表达。表明组织块法从胰腺组织中分离获得的是静息态PSCs,经过传代后几乎全部激活。
从组织块“爬出”的早期细胞表达Desmin,传代后同时表达Desmin和α-SMA两种骨架蛋白,证明了改良的组织块法可一次性分离获得PSCs,无需梯度离心纯化细胞。贴壁第4天的原代细胞有些已表达α-SMA,但传代后表达量明显增多,推测组织块法培养的原代细胞中可能有小部分细胞受到胰酶消化刺激已经活化。
总之,改良的组织块法成功分离获得正常小鼠静息状态PSCs,并经传代后活化,获得的静息态和激活态PSCs符合进一步实验要求,可以满足体外研究的需要。相比酶消化法和已报道的组织块法,本法分选PSCs操作简单、流程少,污染概率低,无需细胞纯化及外源胰酶抑制剂干扰,且组织块可反复贴壁分离PSC,组织利用率高。
[1]Bachem MG, Schneider E, Gross H, et al. Identification, culture, and characterization of pancreatic stellate cells in rats and humans[J]. Gastroenterology, 1998, 115(2): 421-432.
[2]范昕, 王莹, 侯雯跻, 等. 小鼠胰腺星状细胞的分离培养与鉴定[J]. 江苏大学学报(医学版), 2012, 22(6): 468-471.
[3]唐元瑜, 苏式兵. 小鼠胰星状细胞的分离培养及鉴定[J]. 世界华人消化杂志, 2010, 18(1): 28-32.DOI:10.3969/j.issn.1009-3079.2010.01.005.
[4]Strobel O, Dadabaeva N, Felix K, et al. Isolation and culture of primary human pancreatic stellate cells that reflect the context of their tissue of origin[J]. Langenbecks Arch Surg, 2015 Dec 29.
[5]Ene-Obong A, Clear AJ, Watt J, et al. Activated pancreatic stellate cells sequester CD8+ T cells to reduce their infiltration of the juxtatumoral compartment of pancreatic ductal adenocarcinoma[J]. Gastroenterology, 2013, 145(5): 1121-1132.
[6]Sendler M, Beyer G, Mahajan UM, et al. Complement Component 5 Mediates Development of Fibrosis, via Activation of Stellate Cells, in 2 Mouse Models of Chronic Pancreatitis[J]. Gastroenterology, 2015, 149(3): 765-776.
[7]Bachem MG, Schünemann M, Ramadani M, et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells[J]. Gastroenterology, 2005, 128(4): 907-921.
[8]Wells RG, Crawford JM. Pancreatic stellate cells: the new stars of chronic pancreatitis?[J]. Gastroenterology, 1998, 115(2): 491-493.
[9]Ikenaga N, Ohuchida K, Mizumoto K, et al. CD10+pancreatic stellate cells enhance the progression of pancreatic cancer[J]. Gastroenterology, 2010, 139(3): 1041-1051.
[10]Watari N, Hotta Y, Mabuchi Y. Morphological studies on a vitamin A-storing cell and its complex with macrophage observed in mouse pancreatic tissues following excess vitamin A administration[J]. Okajimas Folia Anat Jpn, 1982, 58(4-6): 837-858.
[11]Ikejiri N. The vitamin A-storing cells in the human and rat pancreas[J]. Kurume Med J, 1990, 37(2): 67-81.
[12]Apte MV, Haber PS, Applegate TL, et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture[J]. Gut, 1998, 43(1): 128-133.
[13]Sparmann G, Hohenadl C, Tornoe J, et al. Generation and characterization of immortalized rat pancreatic stellate cells[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 287(1): G211-G219.
[14]Jaster R, Sparmann G, Emmrich J, et al. Extracellular signal regulated kinases are key mediators of mitogenic signals in rat pancreatic stellate cells[J]. Gut, 2002, 51(4): 579-584.
[15]Vonlaufen A, Phillips PA, Yang L, et al. Isolation of quiescent human pancreatic stellate cells: a promising in vitro tool for studies of human pancreatic stellate cell biology[J]. Pancreatology, 2010, 10(4): 434-443.
[16]贾一韬, 李兆申. 大鼠胰星状细胞的分离与培养[J]. 胰腺病学, 2003, 3(3): 158-161.DOI:10.3760/cma.j.issn.1674-1935.2003.03.010
[17]Kruse ML, Hildebrand PB, Timke C, et al. Isolation, long-term culture, and characterization of rat pancreatic fibroblastoid/stellate cells[J]. Pancreas, 2001, 23(1): 49-54.
[18]Kubota H, Yao HL, Reid LM. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis[J]. Stem Cells, 2007, 25(9): 2339-2349.
(本文编辑:吕芳萍)
Modified tissue culture for C57BL/6 mouse pancreatic stellate cells
ZhaoZhenhua,WangLumei,LiuMuyun,ZhuShuguang,YuJin,ZhaoAnjing,HuLianghao,ManXiaohua,JinJing,WuHongyu,GaoJun,LiuShanrong,LiZhaoshen,LiaoZhuan.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:LiaoZhuan,Email:liaozhuan@smmu.edu.cn
ObjectiveTo culture C57BL/6 mouse pancreatic stellate cells (PSCs) with a modified method, and to establish a simple cultivation method with a high yield of PSCs. MethodsPancreatic tissues in C57BL/6 mice were collected, washed by fetal bovine serum, minced into 0.5~1 mm3, and cultured in sterile culture flasks. After 4days, primary PSCs were collected and passed on. The changes in intracellular lipid droplets were identified by oil red O staining; α-SMA,desmin expression was detected by immunocytochemical or immunocytofluorescent staining, and Western blot. ResultsOutgrowth cells in the fourth day were oval or star with abundant lipid droplets and fewer cells expressed α-SMA and desmin protein. PSCs turned into bigger, more pseudopodial ones with decreasing lipid droplets and significantly increasing expression of α-SMA and desmin protein after the passage. Protein expression of α-SMA in primary and passage PSCs were 0.653±0.071, 2.290±0.055, respectively; and the expression in passage PSCs was significantly higher than that in primary PSCs (P<0.05), and the number of cells expressing desmin protein was significantly increased. ConclusionsModified tissue culture is a high yield and high purity method for both quiescent and activated PSCs, which can meet the need of in-vitro studies.
Tissue cutture techniques;Pancreatic stellate cells;Cell separation;In vitro Fund program: National Natural Science Foundation of China(81270541)
10.3760/cma.j.issn.1674-1935.2016.01.010
200433上海,第二军医大学长海医院消化内科(赵朕华、刘牧云、朱曙光、于金、赵安静、胡良皞、满晓华、金晶、吴洪玉、高军、李兆申、廖专),中心实验室(王录美、刘善荣)
廖专,Email:liaozhuan@smmu.edu.cn
国家自然科学基金(81270541)
2015-09-20)

