ω-3鱼油脂肪乳注射液对重症急性胰腺炎患者肠道菌群及肠道微生物定植抗力的影响
牛高华 曹艳茹 赵然楚 王文峰 郭环宇 田敬英 武华
·短篇论著·
ω-3鱼油脂肪乳注射液对重症急性胰腺炎患者肠道菌群及肠道微生物定植抗力的影响
牛高华曹艳茹赵然楚王文峰郭环宇田敬英武华
正常人体肠道内寄居着数量庞大、种类繁多的微生物,以细菌为主,统称为肠道菌群,其细胞总数高达1 014,种类>1 000种,是人体细胞总和的10倍[1],肠道菌群与宿主相互依存、相互制约,共同维系动态的生态平衡,已成为人体不可或缺的一部分[2]。许多因素,例如手术、外伤、感染、肿瘤、疾病及不恰当应用抗生素均可影响肠道正常菌群的平衡,特别是危重症患者,有时可丧失整个益生菌群,引发肠道菌群失调[3],肠黏膜细胞间的紧密连接下降、通透性增高,破坏肠黏膜屏障功能,引发细菌及内毒素易位。重症急性胰腺炎(SAP)患者因机体代谢严重紊乱,需要一段时间肠外营养支持,故细菌及内毒素易位往往使SAP病情进一步加重。寻找能够稳定肠道微生物定植力,保护肠黏膜屏障功能的治疗方法成为临床医师面临的工作重点。本研究应用ω-3鱼油脂肪乳注射液治疗SAP患者,观察患者肠道菌株及肠道微生物的定植抗力,评价ω-3鱼油脂肪乳治疗SAP的作用。
一、材料和方法
1.研究对象:收集2012年8月至2014年6月间山西医科大学第一医院普外科及郸城县人民医院普外科收治的30例SAP患者,诊断均符合中华外科学分会胰腺学组制订的诊治指南标准[4]。纳入标准:(1)有24 h APACHEⅡ评分;(2)有48 h Ranson评分;(3)有72 h增强CT扫描资料;(4)不能进食需要肠外营养支持至少7 d以上。排除标准:(1)入院未满72 h;(2)资料不完整;(3)患者依从性差;(4)恶性肿瘤患者;(5)未控制的糖尿病、其他代谢性疾病患者;(6)严重出血性疾病;(7)某些急症及危及生命的状况;(8)严重肝肾功能异常和妊娠、哺乳期妇女。研究方案经本院伦理委员会批准(审核号:201178),所有患者或家属均知情同意。按照随机双盲原则,采用SAS(8.0)统计软件编程直接将患者分为ω-3鱼油脂肪乳治疗组和对照组,每组15例。
2.治疗方法:对照组给予传统治疗,包括禁食、胃肠减压、抑酸、抑制胰腺分泌、抗菌消炎、液体复苏及常规营养支持(20%结构脂肪乳制剂)等;ω-3鱼油脂肪乳组在传统治疗基础上应用ω-3鱼油脂肪乳注射液(尤文)替代20%结构脂肪乳制剂,根据患者所需热卡按25kCa·kg-1·d-1,糖脂比例1∶1,非蛋白热卡(NPC)与氮之比例100~150 kCa∶1 g,微量元素补充相同。将葡萄糖、脂肪乳、氨基酸等营养素混合并配制成“全合一”(TNA)营养液后进行输注。输注时间每天18~20 h。
3.细菌培养:收集入院时及治疗后3、7 d患者自然排出的新鲜大便10 g左右,置入厌氧瓶内,30 min内采用日本学者的光冈知足法[5-6]定量检测粪便中双歧杆菌、肠杆菌、肠球菌、乳酸杆菌含量。在无菌条件下取新鲜粪便0.5 g,连续10倍稀释后接种于4种菌株相应培养基平板上进行细菌培养,需氧菌置于37℃普通培养箱内培养48~72 h,厌氧菌置于37℃厌氧工作站培养48 h,光镜下计数每克湿粪的菌落形成单位(colony forming unit,CFU),计算肠道微生物定植抗力。肠道微生物定植抗力为双歧杆菌数与肠杆菌数的比值,即B/E值。同时将细菌鉴定到种属。
二、结果
1.患者一般资料:30例SAP患者中男性19例,女性11例,年龄21~70岁,平均50岁;BMI 16.5~27.6 kg/m2,平均22.5 kg/m2。对照组患者中男性10例,女性5例,平均年龄45岁,BMI(22.1±2.1)kg/m2,APACHEⅡ评分(15±2)分;ω-3鱼油脂肪乳组患者分别为9例、6例、50岁、(21.8±1.3)kg/m2、(16±3)分。两组差异均无统计学意义,具有可比性。两组患者均未见过敏、心悸、发热、静脉炎等不良反应。对照组中2例并发胰腺假性囊肿形成、1例并发出血等;ω-3鱼油脂肪乳组中2例并发胰腺假性囊肿。
2.肠道菌群数量及B/E值:入院时两组患者的肠道菌数量及B/E值的差异均无统计学意义;治疗后3 d两组患者肠道双歧杆菌、肠杆菌、肠球菌数量均较其入院时减少,乳酸杆菌数量较其入院时增加,B/E值增高;治疗后7 d两组患者肠道双歧杆菌、乳酸杆菌数量、B/E值均较其治疗后3 d进一步增加,肠球菌数量进一步减少,肠杆菌数量变化不大。治疗后3、7 d,ω-3鱼油脂肪乳组双歧杆菌、乳酸杆菌数量、B/E值均显著高于对照组,肠杆菌数量显著低于对照组,差异均有统计学意义,而肠球菌数量的差异无统计学意义(表1)。
讨论肠道是人体最大的微生物生存场所,栖息着种类
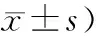
表1 两组肠道菌群数量和B/E值比较(log 10 CFU/g湿粪,
注:入院时两组比较,F值分别为0.413、0.000、0.400、0.048、2.211,P值均>0.05;治疗后3 d比较,F值分别为194.8、211.8、0.137、75.5、3.105,aP<0.05;7 d时比较,F值分别为216.6、14.5、0.708、93.2、348.0,aP<0.05
繁多和数量巨大的微生物,包括真菌、细菌和古细菌,这些微生物共同构成了肠道的微生态系统,对促进食物消化、产生维生素等营养物质、抵御外来致病菌入侵、促进肠黏膜屏障功能完整、刺激免疫系统等方面有着重要作用,可视作“人体第二基因组”即元基因组学(Metagenomics)[7]。肠道正常菌群与肠黏膜紧密结合构成肠道的生物屏障能通过占位效应、营养竞争及其所分泌的各种代谢产物和细菌素等抑制条件致病菌的过度生长以及外来致病菌的入侵,从而维持肠道的微生态平衡[8]。肠道微生态平衡得益于厌氧菌中的双歧杆菌及乳酸杆菌,其中双歧杆菌对维持肠黏膜微生态屏障的完整性、对抗外来细菌定植及抑制肠道需氧的潜在致病菌群起到重要作用。
1971年荷兰微生物学家Van der Waaij教授首次提出肠道微生物定植抗力(colonization resistance,CR)概念[9],是指肠道内源性专性厌氧菌抑制消化道中主要需氧菌属的潜在致病菌群数量的能力。吴仲文等[10]研究表明双歧杆菌与肠杆菌的数量比值(B/E值)可作为肠道微生物定植抗力指标应用于临床,B/E值>1表示肠道定植抗力正常,B/E值=1表示肠道定植抗力降低。肠道定植抗力降低时抵抗病原菌侵袭能力随之降低,肠道需氧革兰阴性菌过度生长,从而影响肠细胞摄取谷氨酰胺,导致肠黏膜屏障受损,更易于发生细菌及内毒素易位。
临床观察及研究表明肠道是急危重患者菌血症和(或)内毒素血症的源头。SAP患者的肠黏膜屏障遭到破坏,肠道菌群发生改变,肠道微生物定植抗力降低,为肠源性感染及内毒素易位提供了条件。如何有效改善、提高肠道微生物定植抗力,抑制肠道需氧菌过度生长及稳定肠黏膜屏障功能成为预防SAP并发症和改善SAP预后的关键环节。本研究结果显示,ω-3鱼油脂肪乳组及对照组在入院时肠道菌群差异无统计学意义,治疗后两组患者肠道双歧杆菌均下降,乳酸杆菌数量均增加,ω-3鱼油脂肪乳组的变化较对照组更显著,考虑ω-3鱼油脂肪乳注射液在抑制双歧杆菌数量减少中发挥一定作用,但其可能的机制有待进一步研究证实。治疗期间肠杆菌及肠球菌数量均下降,但两组患者肠球菌数量差异无统计学意义,而肠杆菌数量差异有统计学意义,可能原因是双歧杆菌及乳酸杆菌抑制了需氧菌的生长繁殖。治疗后3 d ω-3鱼油脂肪乳组患者B/E值接近1.0,而对照组明显小于1.0;治疗后7 d ω-3鱼油脂肪乳组B/E值明显大于1.0,而对照组基本上等于1.0,两组差异有统计学意义,说明ω-3鱼油脂肪乳组在稳定肠道定植抗力优于对照组,对控制肠源性感染及稳定肠黏膜屏障功能有重要作用。由于本研究纳入样本量较少,仍需大样本、多中心的临床研究,提供更全面、更完善的临床治疗循证依据。
[1]Tomasello G,Bellavia M,Palumbo VD,et al.From gut microflora imbalance to mycobacteria infection:is there a relationship with chronic intestinal diseases[J] ?Ann Ital Chir,2011,82(5):361-368.
[2]胡咏. 肠道菌群失调常见疾病的研究进展[J].医学综述,2011,17(2):239-241.DOI:10.3969/j.issn.1006-2084.2011.02.08.
[3]王春敏,李丽秋. 人体肠道正常菌群的研究进展[J].中国微生态学杂志,2010,22(8):760-762.
[4]中华医学会外科学分会胰腺外科学组.重症急性胰腺炎诊治指南[J].中华外科杂志,2007,45(11):727-729.DOI:10.3760/j.issn.0529-5815.2007.11.004.
[5]Ohkusa T,Ozaki Y,Sato C,et al.Long-term ingestion of lactosucrose increases Bifidobacterium sp.in human fecal flora[J].Digestion, 1995,56(5):415-420.
[6]李雪驼,邱华. 光冈式肠内细菌群分析方法及肠内代谢产物的测定方法讲座(一)[J].中国微生态学杂志,1998,10(1):64-66.
[7]Rondon MR,August PR,Bettermann AD,et al.Cloning the soil metagenome:a strategy for accessing the genetic and functional diversity of uncultured microorganisms[J].Appl Environ Microbiol,2000,66(6):2541-2547.
[8]王友湘, 陈庆森. 益生菌和肠道黏膜免疫关系的研究进展[J]. 食品科学, 2007, 28(8): 537-542.
[9]Van der Waaij D,Berghuis-de Vries JM,Lekkerkerk Lekkerkerk-v.Colonization resistance of the digestive tract in conventional and antibiotic treated mice[J].J Hyg(lond),1971,69(3):405-411.
[10]吴仲文,李兰娟,马伟杭,等. 肠道微生物定植抗力的新指标-B/E值[J]浙江预防医学杂志,2000,12(7):4-6.DOI:10.3969/j.issn.1007-0931.2000.07.002.
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2016.01.016
黎介寿院士肠道屏障专项基金(LJS-201217)
570102海口,海南医学院附属医院普外科(牛高华、赵然楚);河南郸城县人民医院中医科(曹艳茹),心内科(王文峰、郭环宇),检验科(田敬英);山西医科大学第一医院普外科(武华)
武华,Email: taiyuanwuhua@aliyun.com
2015-08-20)

