一个水稻富亮氨酸重复类受体蛋白激酶的RNAi及表达分析
宋 婷,熊 炜,李莹莹,曹振华,刘晨曦,刘薇茵,栾维江(天津师范大学 a.生命科学学院,b.天津市动植物抗性重点实验室,天津 300387)
一个水稻富亮氨酸重复类受体蛋白激酶的RNAi及表达分析
宋婷,熊炜,李莹莹,曹振华,刘晨曦,刘薇茵,栾维江
(天津师范大学 a.生命科学学院,b.天津市动植物抗性重点实验室,天津 300387)
摘要:为了揭示富亮氨酸重复类受体蛋白激酶(LRR-RLKs)家族成员OsLPR1在水稻生长发育与抗逆性中的功能,利用反向遗传学方法构建了OsLPR1的RNAi载体,将其导入野生型水稻中获得转基因植株,观察表型并且分析OsLPR1基因在野生型和转基因植株中的表达情况.在表型观察中发现RNAi转基因植株出现白化苗.进一步的RT-PCR分析发现,白化苗中目的基因OsLPR1的表达量明显偏低,野生型中的表达量则较高,这表明OsLPR1基因表达异常会导致水稻出现白化现象.另外,还分析了OsLPR1的组织特异性表达,结果表明,OsLPR1在不同的组织器官中均有表达,但在叶片及叶鞘中高表达,这说明该基因可能与水稻叶片的生长发育有关.
关键词:蛋白激酶;表达分析;RNAi分析;白化苗;OsLPR1
蛋白激酶是一类催化蛋白质磷酸化反应的酶,在植物生长发育过程中发挥着重要作用[1].对水稻的全基因组测序结果表明,水稻基因组中至少有1 500个蛋白激酶[2].类受体蛋白激酶(RLK)是蛋白激酶的一个亚家族,包含胞外结构域、跨膜区和胞内激酶区.胞内激酶区通过磷酸化或去磷酸化,开启或关闭下游靶蛋白,将胞外信号转化为胞质信号[3-4].富亮氨酸重复类受体蛋白激酶(LRR-RLKs)是已知的植物基因组中最大的一类跨膜类受体激酶,由胞外LRR结构域、单次跨膜区和胞内激酶结构域3部分组成[5],胞内激酶结构域相对保守,氨基酸同源性很高,通过序列比较分析,胞外受体蛋白序列都含有22~24个富含亮氨酸的重复序列[6-8].这一类蛋白的胞外富亮氨酸的结构域通过与多种特异信号分子结合,激活胞内激酶区的磷酸化活性,从而将胞外信号传递到胞内,调控植物生长发育和抗逆抗病等生理过程[9-10].如在生长发育方面,拟南芥中的CLV1参与茎顶端分生组织的形成[11]、ERECTA控制器官的伸长与营养生长[12];在抗病方面,拟南芥At1g09970的基因可能参与植物体的抗盐过程.水稻中的Xa21是一个典型的编码富含亮氨酸重复类受体激酶的基因,其胞外LRR区含有21个LRR基序[13],已有研究证明Xa21具有自我磷酸化活性,而且只有苏氨酸和丝氨酸可被磷酸化[14],它在细胞表面识别病原物,二者结合后形成一个稳定的二聚体,促使胞内丝氨酸/苏氨酸激酶区部分相互靠拢,并激发胞内激酶域发生磷酸化反应[15],在提高水稻白叶枯病抗性中起关键作用;另外还有抗白叶枯病的基因Xa26[16]、抗稻瘟病的基因Pi-d2[17]等.除了抗病方面的研究,LRR-RLKs类蛋白激酶在水稻中其他方面的功能尚不明确.
本研究以水稻LRR-RLKs类蛋白激酶家族成员OsLPR1为研究对象,利用反向遗传学方法,构建OsLPR1的RNAi载体,将其导入野生型水稻中获得转基因植株.通过观察转基因植株的表型和分析OsLPR1的表达量,揭示该基因在水稻生长发育与抗逆性中的作用.
1 材料与方法
1.1材料
野生型粳稻品种中花11(Oryza sativa L.ssp.Japonica zhonghua11)及其转基因植株.
1.2主要仪器与试剂
PCR仪,由美国Applied Biosystems 9902公司生产;凝胶成像分析仪,由美国BIO-RAD公司生产;琼脂糖水平电泳仪,由美国BAYGENE公司生产;超速离心机和分光光度计,由美国Eppendorf公司生产.
M-MLV反转录酶、DNA限制性内切酶、T4DNA连接酶、DNA Marker2000、DNA Marker15000等,由美国Takara公司生产;Trizol试剂,由美国Invitrogen公司生产;质粒小量提取试剂盒,由美国OMEGA Bio-Tek公司生产;普通PCR试剂,由北京鼎国生物有限公司生产;DNA凝胶回收试剂盒、PCR产物纯化试剂盒,由北京康为世纪生物有限公司生产.引物合成及DNA测序由金唯智生物科技有限公司完成.
1.3实验方法
1.3.1RNAi载体的构建
通过RT-PCR方法获得RNAi载体的2段特异干涉片段:用Trizol试剂从生长30 d的水稻幼苗中提取总RNA,用M-MLV逆转录酶将1 μg的总RNA逆转录合成cDNA,以其为模板进行PCR扩增.引物片段如下:
RNAi正向片段扩增引物:IF1(5′-TACGGATCCTTTGACCTTGAGATGCGAGG-3′);IR1(5′-TTGGGTACCGATGTCGACCAAGAGTCGAT-3′).
RNAi反向片段扩增引物:IF2(5′-TACGAGCTCTTTGACCTTGAGATGCGAGG-3′);IR2(5′-TTGACTAGTGATGTCGACCAAGAGTCGAT-3′).
PCR扩增条件:94℃下4 min;运行35次循环的94℃、30 s,60℃、30 s,72℃、30 s;之后72℃延伸5 min.2段干涉片段依次连入RNAi空载体pUBI1460中,酶切检测正确后导入农杆菌EHA105中,用介导遗传转化的方法[14]将载体导入中花11中获得转基因植株.
1.3.2转基因植株的分子检测
用CTAB法[15]提取水稻叶片基因组DNA,然后用载体中的潮霉素抗性基因进行分子检测.引物为HygF (5′-CTTCTGCGGGCGATTTGT-3′)和HygR(5′-CAGCGTCTCCGACCTGAT-3′).PCR扩增条件:94℃下4 min;运行32次循环的94℃、30 s,57℃、30 s,72℃、30 s;之后72℃延伸5 min.PCR结束后用琼脂糖凝胶电泳进行检测.
1.3.3目的基因的表达分析
检测RNAi转基因植株的表达情况时,从生长50 d的水稻叶片中提取总RNA;检测植株的组织特异性表达情况时,分别从根、茎、叶和各个时期的幼穗等不同材料中提取总RNA;分析植株不同生长部位叶片中的表达情况时,从生长70 d的水稻最上部叶片、倒2叶、倒3叶及倒4叶中提取总RNA.用去基因组的反转录试剂盒对500 ng的总RNA进行反转录获得cDNA,以其为模板进行RT-PCR反应.所用引物:LPR-F(5′-CACCATGAATGCGGAAGAAC-3′)和LPR-R (5′-CCCAGAAGTAGATGGATGAC-3′).
RT-PCR的扩增条件:94℃下4 min;运行32次循环的94℃、30 s,57℃、30 s,72℃、30 s;之后72℃延伸5 min.以水稻OsActin1为内参进行相对定量分析,内参基因所用引物为:ActinF(5′-GACTCTGGTGATGGTGTCAGC-3′)和ActinR(5′-GGCTGGAAGAGGACCTCAGG-3′).PCR反应程序为:95℃下1 min;运行24次循环的94℃、30 s,56℃、30 s,72℃、30 s;之后72℃延伸5 min.每个反应重复3次.
2 结果与分析
2.1OsLPR1的RNAi表达载体的构建
为了揭示水稻OsLPR1基因在干扰条件下的功能,本课题组构建了OsLPR1基因的RNAi表达载体,其结构如图1(a)所示.构建载体时,首先利用RT-PCR方法获得406 bp的干涉片段,如图1(b)所示;之后将正向干涉片段用BamHI和KpnI与RNAi空载体进行连接,获得中间载体,再将反向干涉片段用SacI和SpeI与中间载体连接,获得最终的RNAi表达载体.对重组载体进行酶切检测,按照预期的载体结构,用BamHI和SacI进行酶切,切出大小约为1 300 bp的预期目的片段,结果如图1(c)所示.这说明正向和反向干涉片段都已连接到空载体中,测序验证为连接正确.将重组载体质粒转化到农杆菌EHA105中,用于后续的转基因实验.

图1 RNAi载体的构建Fig.1 Construction of RNAi vector
2.2转基因植株的表型分析
通过农杆菌介导的遗传转化方法将构建的RNAi表达载体导入中花11中,共获得4个独立株系的T0代转基因植株65株.为了检测构建的RNAi载体是否转入水稻中,提取叶片DNA,利用载体上的潮霉素抗性基因进行PCR检测.结果表明,65株转基因植株中有52株为转基因阳性植株,阳性率为80%,转基因植株的部分分子检测结果如图2(a)所示.在获得的4个株系的转基因植株中,实验观察到有2个株系的11株出现白化苗,如图2(b)所示.这些白化苗不能正常生长,生长约20 d后逐渐枯萎死亡.为了验证白化苗的形成是否是由OsLPR1-RNAi干涉引起,本课题组提取了白化苗、正常绿苗和野生型植株的RNA,用RT-PCR方法检验OsLPR1的表达量,结果如图2(c)所示.OsLPR1的表达量在白化苗中明显较低,而在正常绿苗及野生型植株中表达较高,这表明白化苗是由目的基因RNAi干涉所致,由此认为干涉OsLPR1的表达会导致水稻出现白化现象.

图2 转基因植株的表型分析Fig.2 Analysis of phenotype in transgenic plants
2.3OsLPR1基因在水稻中的表达分析
为了明确OsLPR1在水稻不同组织器官中的表达情况,分别提取了野生型的茎顶端分生组织(SAM)、根、茎、叶、叶鞘和不同时期幼穗的总RNA,反转录合成cDNA,通过RT-PCR检测目的基因OsLPR1在水稻不同器官中的表达差异,结果如图3所示.由图3 (a)可以看出,OsLPR1在上述的SAM、根、茎、叶、叶鞘和不同时期幼穗中均有不同程度的表达,在水稻的叶和叶鞘中表达量较高,其他组织中表达量较低.分析OsLPR1在不同部位叶片中的表达,结果如图3(b)所示,OsLPR1在最上部叶片、倒二叶、倒三叶、倒四叶中的表达没有明显差异.
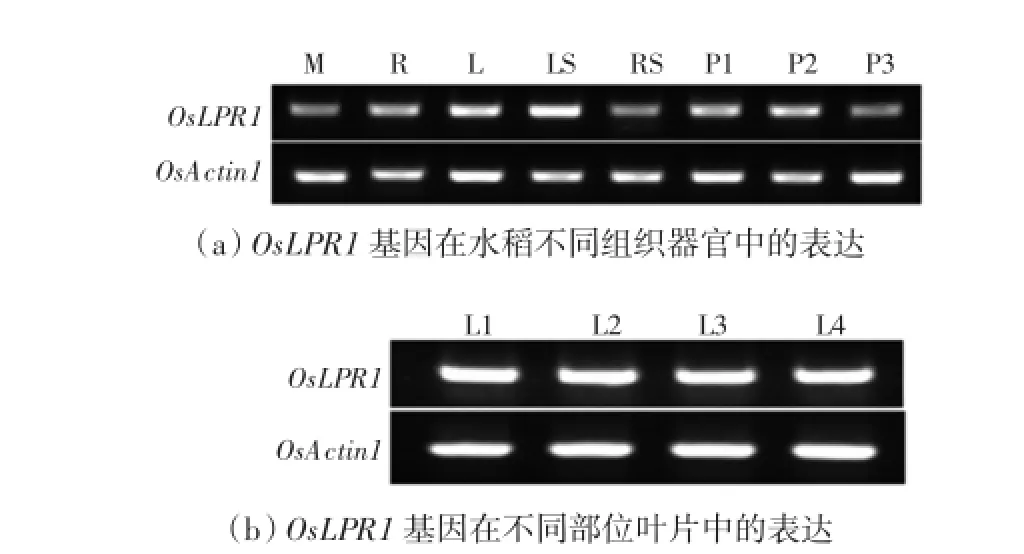
图3 OsLPR1基因的组织特异性表达Fig.3 Tissue-specific expression of OsLPR1
3 讨论
本研究构建了LRR-RLKs类家族成员OsLPR1的RNAi表达载体,利用反向遗传学方法探究其功能.结果表明,干涉OsLPR1的表达能够导致水稻出现白化苗,进一步分析发现目的基因的表达量在白化苗中明显下降.已有研究表明,白化突变体最典型的特征就是叶绿体不能正常发育,如在水稻白化突变体alb21中,叶绿体就因为叶绿素的合成途径受阻从而无法正常发育[18].本研究揭示的OsLPR1基因受到干扰后产生白化现象,这是否与水稻叶绿体的发育有关还需进一步论证.因此,今后本课题组还将构建OsLPR1基因的过量表达载体,研究该基因在过量表达情况下的功能;同时,研究该基因在叶绿体的发育及叶绿素合成途径中的表达调控,以此揭示OsLPR1基因与叶绿素合成基因之间的关系,最终阐明OsLPR1基因表达受到干扰与水稻白化病的关系.此外,OsLPR1基因的组织特异性分析表明,其在叶片和叶鞘中表达量极高,说明该基因可能在叶片发育过程中起重要作用.
参考文献:
[1]刘茜,孙健,李莉云,等.5个水稻蛋白激酶的克隆、表达及活性研究[J].中国农学通报,2007,23(6):83-88. LIU Q,SUN J,LI L Y,et al.Cloning,expression and autophosphorylation of 5 rice protein kinases[J].Chinese Agricultural Science Bulletin,2007,23(6):83-88(in Chinese).
[2]CHEN X H,TAO Y,LIU G Z,et al.A recombination based strategy for assembling open-reading frames[J].Plant Molecular Biology Reporter,2005,23(4):1-7.
[3]闫锋,祝传书,庞保平.植物类受体蛋白激酶的研究进展[J].西北植物学报,2009,29(4):851-858. YAN F,ZHU C S,PANG B P.Advance in research of plant receptorlike protein kinases[J].Acta Bot Boreal Occident Sin,2009,29(4):851-858(in Chinese).
[4]牛吉山.植物和小麦蛋白激酶的研究现状[J].西北植物学报,2003,23(1):143-150. NIU J S.Studies on plant and wheat protein kinases[J].Acta Bot Boreal Occident Sin,2003,23(1):143-150(in Chinese).
[5]冯蕾,张海文,黄荣峰.植物LRR类受体蛋白激酶的研究进展[J].中国农业科技导报,2012,14(6):43-48. FENG L,ZHANG H W,HUANG R F.Research progress on LRR receptor-like protein kinase in plant[J].Journal of Agricultural Science and Technology,2012,14(6):43-48(in Chinese).
[6]SONG D H,LI G J,SONG F M,et al.Molecular characterization and expression analysis of OsBISERK1,a gene encoding a leucine-rich repeat receptor-like kinase,during disease resistance responses in rice[J]. Mol Biol Rep,2008,35(2):275-283.
[7]KOBE B,KAJAVA A V.The leucine-rich repeat as a protein recognition motif[J].Curr Opin Struct Biol,2001,11(6):725-732.
[8]TORII K U.Leucine-rich repeat receptor kinases in plants:structure,function,and signal transduction pathways[J].Int Rev Cytol,2004,23 (4):1-46.
[9]查笑君,马伯军,潘建伟,等.植物富亮氨酸重复类受体蛋白激酶的研究进展[J].浙江师范大学学报:自然科学版,2010,33(1):7-12. ZHA X J,MA B J,PAN J W,et al.Research advances in leucine-rich repeat receptor-like protein kinases in plants[J].Journal of Zhejiang Normal University:Natural Sciences,2010,33(1):7-12(in Chinese).
[10]郭立琳,邓沛怡,陈奇辉,等.拟南芥LRR-RLK亚家族基因At1g09970突变体鉴定及表型观察[J].湖南师范大学自然科学学报,2006,29(2):80-83. GUO L L,DENG P Y,CHEN Q H,et al.Identification of LRR-RLK gene At1g 09970 homozygous mutants and their phenotypic observation in Arabidopsis[J].Journal of Natural Science of Hunan Normal University,2006,29(2):80-83(in Chinese).
[11]CLARK S E,RUNNING M P,MEYEROWITZ E M.A regulator of meristem and flower development in Arabidopsis[J].Development,1993,119(2):397-418.
[12]TORIL K U,MISTSUKAWA N,OOSUMI T.The Arabidopsis ERECTA gene encodes a putarive receptor protein kinase with extracelluar leucine-rich repeats[J].The Plant Cell,1996,8(4):735-746.
[13]SONG W Y,WANG G L,CHEN L L,et al.A receptor-like protein kinase encoded by the rice disease resistance gene,Xa21[J].Science,1995,270(5243):1804-1806.
[14]LIU G Z,PI L Y,WALKER J C,et al.Biochemical characterization of the kinase domain of the rice disease resistance receptor-like kinase XA21[J].J Biol Chem,2002,277(23):20264-20269.
[15]SONG W Y,PI L Y,WANG G L,et al.Evolution of the rice Xa21 disease resistance gene family[J].Plant Cell,1997,9(8):1279-1287.
[16]SUN X L,CAO Y L,YANG Z F,et al.Xa26,a gene conferring resistance to Xanthomonas oryzae in rice,encodes an LRR receptor kinaselike protein[J].Plant J,2004,37(4):517-527.
[17]CHEN X W,SHANGJ J,CHEN D X,et al.A B-lectin receptor kinase gene conferring rice blast resistance[J].The Plant Journal,2006,46 (5):794-804.
[18]余庆波,江华,米华玲,等.水稻白化突变体alb21生理特性和基因定位[J].上海师范大学学报:自然科学版,2005,34(1):70-75. YU Q B,JIANG H,MI H L,et al.The physiological character and molecular mapping in rice albino21 mutant[J].Journal of Shanghai NormalUniversity:NaturalSciences,2005,34(1):70-75(inChinese).
(责任编校纪翠荣)
第一作者:宋婷(1990—),女,硕士研究生.
文章编号:1671-1114(2016)01-0048-04
中图分类号:Q943
文献标志码:A
收稿日期:2015-09-18
基金项目:国家自然科学基金资助项目(31171515);天津市高校中青年骨干创新人才培养计划资助项目(ZX110gg017).
通信作者:栾维江(1971—),男,教授,主要从事水稻功能基因组学方面的研究.
RNAi and expression analysis of a leucine-rich repeat receptor-like protein kinase in rice
SONG Ting,XIONG Wei,LI Yingying,CAO Zhenhua,LIU Chenxi,LIU Weiyin,LUAN Weijiang
(a.College of Life Sciences,b.Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin Normal University,Tianjin 300387,China)
Abstract:To reveal the function of OsLPR1,a member of leucine-rich repeat receptor protein-like kinase family(LRRRLKs),in growth and development of rice,the RNAi vector of OsLPR1 were constructed to produce transgenic plants by reverse genetics method.It was found that knockdown of OsLPR1 produced the albino seedlings by phenotypic observation. RT-PCR expression analysis showed that the expression of OsLPR1 was obviously lower in the albino seedlings compared with that in wild type,which suggested that OsLPR1 RNAi lead to the rice albino.In addition,the tissue-specific expression of OsLPR1 was analyzed,and the results showed that OsLPR1 was expressed in different organs,but was higher in the leaf and leaf sheath.Overall,the result indicated that OsLPR1 may be relative to the leaf development in rice.
Keywords:protein kinase;expression analysis;RNAi analysis;albino;OsLPR1

