水稻OsCATA基因相互作用蛋白的筛选和表达分析
汪义龙+夏莹萍+梁建生


摘要: 根据水稻数据库中过氧化氢酶基因编码序列设计引物,克隆水稻OsCATA基因全长序列,构建无自激活活性的pGBKT7-OsCATA诱导重组质粒,采用酵母双杂交系统筛选水稻2周龄叶片 cDNA文库。结果表明,对84个阳性克隆测序,比对分析得到13种可能与OsCATA基因存在相互作用的蛋白质,这些蛋白与叶绿素合成前体、胁迫相应蛋白、核糖体蛋白、外膜蛋白、分泌蛋白、ATP酶和G蛋白β亚基等相关。不同时期过氧化氢酶基因表达分析显示,OsCATA基因在幼苗期和抽穗期表达较高,OsCATB基因在乳熟期和完熟期中表达较高,OsCATC基因在幼苗期和扬花期表达较高。
关键词: 水稻;OsCATA基因;过氧化氢酶;酵母双杂交;表达分析
中图分类号:Q786;S511.01 文献标志码: A
文章编号:1002-1302(2015)08-0020-04
植物体内的H2O2有双重作用,低浓度的H2O2在干旱 [1]、盐 [2]和重金属 [3-4]等胁迫中,可以作为氧化还原信号分子,调控基因表达,产生一系列的防御机制来保护细胞。当H2O2含量超过一定限度时,则导致氧化性损伤,甚至引起程序性死亡 [5-6]。
过氧化氢酶(catalase,EC 1.11.1.6,简称CAT)是植物体内主要的抗氧化酶之一,催化H2O2生成H2O,同时释放O2的反应。该酶是由4个亚基组成的四聚体血红蛋白,按照催化中心结构差异分为2类:铁卟啉酶和锰过氧化氢酶 [7]。过氧化氢酶主要分布在过氧化物酶体中,在乙醛酸循环体、细胞质和线粒体中也有分布 [8-10]。已有研究者报道,从拟南芥 [11]、水稻 [12]、大麦 [13]、小麦 [14]、玉米 [15]、烟草 [16]、油菜 [17]和马铃薯 [18]中克隆到过氧化氢酶基因。对过氧化氢酶基因定位的研究中,Kamigaki等认为C-末端氨基酸区域作为一个内部定位信号在过氧化氢酶进入过氧化物酶体过程中起着重要作用 [19]。
叶绿体和线粒体中产生的活性氧主要由ASC-GSH系统来清除,而过氧化物酶体中的活性氧主要由过氧化氢酶清除 [20]。在大麦 [21]、烟草 [22]和拟南芥 [23]CAT基因突变体的研究中,发现由于CAT基因的缺失,在强光或过氧化氢酶抑制剂的处理下,突变体表现出致死的表型。Foyer等认为这种致死的表型是由于光呼吸产生的H2O2没有被及时清除,在过氧化物酶体中积累,从而产生一系列氧化还原信号诱导的细胞程序性死亡 [24]。Lin等对水稻OsCATC突变体的研究发现,在不同条件处理下,其诱导的程序性死亡与细胞内NO信号相关 [25]。Queval等利用拟南芥[WTBX][STBX]CAT2[WTBZ][STBZ]突变体在不同CO2浓度和不同光周期处理下,发现诱导[WTBX][STBX]CAT2[WTBZ][STBZ]突变体程序性死亡的氧化还原信号与光周期的关系更大 [26]。
水稻数据库(http://rice.plantbiology.msu.edu/)中显示水稻基因组中含有3个过氧化氢酶基因:OsCATA基因、OsCATB 基因和OsCATC基因。生物信息学分析表明水稻OsCATA基因与拟南芥[WTBX][STBX]CAT2[WTBZ][STBZ]基因cDNA同源性达到71%(与[WTBX][STBX]CAT1[WTBZ][STBZ]基因同源性为70%)。目前对筛选与水稻OsCATA基因相互作用蛋白的研究较少,鉴于OsCATA基因在细胞内氧化还原信号传递过程中的重要作用,对其功能研究具有重要意义,本研究利用酵母双杂交技术筛选与OsCATA基因相互作用的蛋白,分析过氧化氢酶基因在不同时期的表达,以期为了解OsCATA基因在氧化还原信号传递过程中的作用提供参考。
1 材料与方法
1.1 植物材料
供试水稻为日本晴(Oryza sativa L. spp. japonica cv. Nipponbare),种植于扬州大学试验田中,以四周的叶片为材料,提取总RNA,用于pGBKT7-OsCATA诱导重组质粒的构建。以不同时期的叶片为材料,提取总RNA,用于过氧化氢酶基因的表达分析。
1.2 试剂
总RNA提取试剂盒:RNAprep pure Plant Kit(TIANGEN);反转录试剂盒:RevertAid First Strand cDNA Synthesis Kit(Thermo scientific);荧光定量PCR试剂盒:SYBR Green SuperMix(BIO-RAD);琼脂糖电泳DNA回收试剂盒:AxyPrep DNA Gel Extraction Kit(杭州爱思进生物公司);质粒抽提试剂盒:质粒小量制备试剂盒(上海捷瑞生物工程有限公司);TA试剂盒:pMD19-T Simple Vector(TaKaRa);大肠杆菌DH5α感受态制备为CaCl2法;酵母细胞感受态通过 LiAc 法制备;Taq DNA聚合酶:Thermo Scientific DreamTaq Green DNA聚合酶;引物由上海捷瑞生物工程有限公司合成。日本晴水稻2周龄叶片cDNA文库已连接在pGADT7-Rec载体上,并转化酵母Y187菌株,由赵淑玲博士惠赠 [27];酵母AH109菌株购自北京拜尔迪公司;双杂交质粒:pGBKT7,pGADT7 购自C lontech公司;酵母 YPDA 培养基、缺陷型培养基购自北京泛基诺公司;X-α-gal 购自Inalco公司。
1.3 水稻总RNA的提取和反转录
根据植物总RNA提取试剂盒说明书,提取4周龄的日本晴叶片的总RNA,并参照反转录试剂盒的说明书,以5 μL的总RNA为模板,反转录为cDNA,用于pGBKT7-OsCATA诱导重组质粒的构建。提取不同时期日本晴叶片的总RNA,反转录成cDNA用于过氧化氢酶基因的表达分析。
1.4 诱导重组质粒的构建
在水稻数据库中搜索OsCATA基因(LOC_Os02g02400)的编码序列,用Primer premier 5软件设计引物(表1)。以逆转录获得的水稻叶片cDNA为模板,PCR扩增OsCATA基因的编码序列。反应体系20 μL,其中引物OsCATA_F和OsCATA_R各0.5 μL,10×buffer 2 μL,2.5 mmol/L dNTP 1 μL,模板cDNA 1 μL,Taq DNA聚合酶0.5 μL,补ddH2O至20 μL。反应条件为:95 ℃预变性3 min;94 ℃变性30 s,60 ℃退火 30 s,72 ℃延伸100 s,35个循环;72 ℃延伸10 min。PCR产物经 1.0%琼脂糖凝胶电泳、回收、克隆入pMD19-T质粒载体,即pMD19T-OsCATA重组质粒,转化大肠杆菌DH5α感受态后,PCR鉴定为阳性的菌落送公司测序。将pMD19T-OsCATA 和pGBKT7质粒分别用NdeⅠ和BamHⅠ双酶切后,经20%琼脂糖凝胶电泳、回收目的片段、连接构建成完整的 pGBKT7-OsCATA 重组质粒。
1.5 诱导重组质粒自激活及毒性检测
将诱导重组质粒pGBKT7-OsCATA和猎物空质粒pGADT7-EV共转化酵母菌株AH109,涂布SD/-Trp/-Leu平板,30 ℃培养4~5 d,挑取SD/-Trp/-Leu平板上生长较好的单菌落,用50 μL、0.9% NaCl溶液重悬。取10 μL重悬菌液分别滴加在SD/-Trp/-Leu/-His/X-α-gal和SD/-Trp/-Leu/-His/-Ade/X-α-gal缺陷型培养基上,30 ℃ 培养3~4 d,观察生长情况,确定诱导蛋白是否具有自激活。
1.6 cDNA文库筛选及阳性克隆鉴定
将诱饵重组质粒pGBKT7-OsCATA转化酵母菌株AH109,筛选转化到酵母菌株Y187的水稻2周龄cDNA文库,涂布50个平板,按Clontech公司酵母双杂交操作手册检测杂交效率,在SD/-Trp/-Leu/-His/+X-α-gal缺陷型培养基上筛选与OsCATA基因存在相互作用的蛋白质,初筛的阳性克隆需要重新划线进一步确认。挑取已验证为阳性的酵母菌落,使用pGADT7基因引物AD/T7进行PCR扩增,琼脂糖凝胶电泳检测、切胶回收并测序,对测序结果进行整理分析。
1.7 水稻不同时期叶片过氧化氢酶基因的表达分析
以水稻数据库中的过氧化氢酶基因编码序列为参照,用Primer premier 5软件设计OsCATA、OsCATB和OsCATC基因定量PCR引物(表1)。以幼苗期、分蘖期、拔节期、孕穗期、抽穗期、扬花期、乳熟期和完熟期等8个时期的水稻叶片cDNA为模板,荧光定量PCR扩增水稻过氧化氢酶基因,进行表达量分析。反应体系20 μL,其中上下游引物各0.5 μL,定量PCR混合液10 μL,模板cDNA 1 μL,补ddH2O至20 μL。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火延伸1 min,40个循环;加溶解曲线程序,导出数据使用ABI 7300仪器分析软件进行定量分析。
2 结果与分析
2.1 构建诱导重组质粒
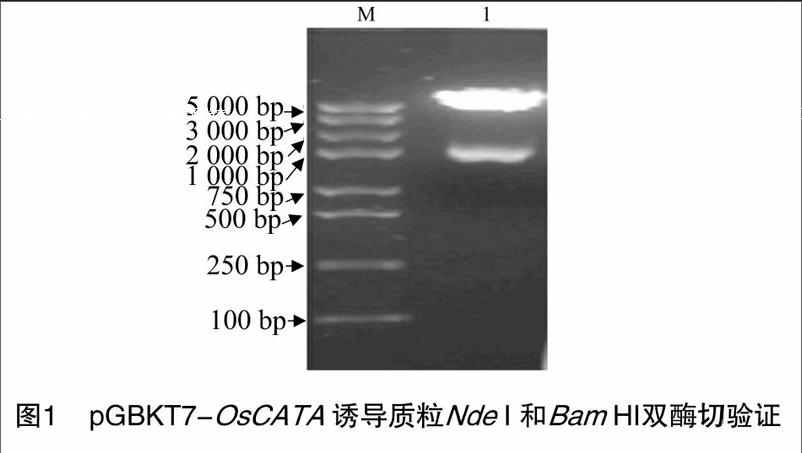
以引物OsCATA_F和OsCATA_R(表1)PCR扩增水稻OsCATA 基因全长序列,电泳、回收并克隆到pMD19-T载体中,将测序正确的pMD19T-OsCATA和pGBKT7质粒经 NdeⅠ 和BamHⅠ双酶切后,回收目的片段,连接构建成完整的诱导重组质粒pGBKT7-OsCATA,重组质粒经NdeⅠ和BamHⅠ双酶切验证,结果如图1所示。
2.2 诱导重组质粒的自激活及毒性检测
2.3 水稻cDNA文库的筛选结果
以pGBKT7-OsCATA质粒为诱导蛋白,筛选水稻2周龄叶片cDNA文库,将转化子经SD/-Trp/-Leu/-His/+X-α-gal培养板初步筛选并重新划线确认后,共获得84个阳性克隆,挑取阳性酵母菌落进行菌落PCR,电泳、回收目的条带送公司测序。将测序结果在水稻数据库中比对搜索,表2列出了阳性克隆测序后比对出的可能存在相互作用的蛋白的基因号和注释。
2.4 不同时期水稻过氧化氢酶基因的表达分析
从图3可见,OsCATA基因在幼苗期和抽穗期表达略高,在扬花期时表达最低,是幼苗期的18%。OsCATB基因在乳熟期和完熟期中表达较高,是幼苗期的1.5倍左右。OsCATC基因的表达在幼苗期和扬花期表达较高,在乳熟期时表达最低,是幼苗期的61%。
3 讨论
本研究应用Clontech公司的酵母双杂交系统,构建 pGBKT7-OsCATA 诱饵重组质粒,筛选水稻2周龄叶片cDNA文库,通过对84个阳性克隆的测序和序列比对分析,得到13种可能存在相互作用的蛋白。烟草 [22]和拟南芥 [23]CAT基因缺失材料,表现出显著的表型,即叶片出现白斑,Lin等在筛选[CM(25]水稻NO信号相关突变体时,发现了OsCATC突变体,该突变体叶片也出现显著的白斑,认为其与NO信号介导的细胞程序性死亡相关 [25]。本研究在筛选OsCATA基因互做蛋白时,筛选出2个与叶绿素合成前体相关的蛋白,PSⅡ反应中心W蛋白和磷酸-2-脱氢-3-脱氧庚糖酸醛缩酶,为进一步研究过氧化氢酶与叶绿素合成、叶片细胞程序性死亡之间的关系奠定了基础。H2O2是植物细胞信号传导过程中的重要组成部分,与植物细胞衰老与程序性死亡 [28]、气孔关闭 [29]、根的生长 [30]、细胞壁的发育 [31]、柱头与花粉的发育 [32]以及系统获得抗性 [33]等密切相关。转基因研究发现,过氧化氢酶基因缺失的烟草植株,对病原菌应答的敏感性显著提高 [34],本研究中筛选出2个与胁迫响应相关的蛋白——含有应激蛋白结构域的蛋白和胁迫响应蛋白,有助于分析H2O2和过氧化氢酶在胁迫应答信号网络中的作用。另外还筛选出与 OsCATA 可能存在相互作用的蛋白包括外膜蛋白OMP85家族,分泌载体相关膜蛋白,40S核糖体蛋白、含有1,3-β-葡聚糖合成酶结构域的蛋白、液泡ATP合酶亚基、赖氨酸酮戊二酸还原酶反式剪接相关因子、G蛋白β亚基WD结构域和含TPR结构域的蛋白等。
不同时期过氧化氢酶基因的表达分析说明,不同时期过氧化氢酶基因表达差异较大,OsCATA基因在幼苗期和抽穗期表达略高,OsCATB基因在乳熟期和完熟期中表达较高,OsCATC 基因的表达在幼苗期和扬花期表达较高,即不同时期通过表达不同过氧化氢酶基因来清除体内过多的H2O2。
参考文献:
[1] Luna C M,Pastori G M,Driscoll S,et al. Drought controls on H2O2 accumulation,catalase (CAT) activity and CAT gene expression in wheat[J]. Journal of Experimental Botany,2005,56(411):417-423.
[2]Hernández J A,Ferrer M A,Jiménez A,et al. Antioxidant systems and O-2[KG-*2]· /H2O2 production in the apoplast of pea leaves:Its relation with salt-induced necrotic lesions in minor veins[J]. Plant Physiology,2001,127(3):817-831.
[3]Cho U H,Seo N H. Oxidative stress in Arabidopsis thaliana exposed to cadmium is due to hydrogen peroxide accumulation[J]. Plant Science,2005,168(1):113-120.
[4]Maksymiec W. Signaling responses in plants to heavy metal stress[J]. Acta Physiologiae Plantarum,2007,29(3):177-187.
[5]任丽梅,张 洁,陈 琰,等. 过氧化氢诱导小麦悬浮细胞程序性死亡[J]. 河北农业大学学报,2009,32(1):26-29.
[6]沈 嵘,刘晓宇,张红晓,等. Zn 2+对高盐和紫外线胁迫条件下水稻根尖细胞程序性死亡的影响[J]. 南京农业大学学报,2010,33(2):13-18.
[7]Kono Y,Fridovich I. Superoxide radical inhibits catalase[J]. The Journal of Biological Chemistry,1982,257(10):5751-5754.
[8]Frederick S E,Newcomb E H. Cytochemical localization of catalase in leaf microbodies(peroxisomes)[J]. Journal of Cell Biology,1969,43(2):343-353.
[9]Debellis L,Picciarelli P,Pistelli L,et al. Localization of glyoxylate-cycle marker enzymes in peroxisomes of senescent leaves and green cotyledons[J]. Planta,1990,180(3):435-439.
[10] Pistelli L,De Bellis L,Alpi A. Peroxisomal enzyme activities in attached senescing leaves[J]. Planta,1991,184(1):151-153.
[11]Newman T,De Bruijn F J,Green P,et al. Genes galore:a summary of methods for accessing results from large-scale partial sequencing of anonymous Arabidopsis cDNA clones[J]. Plant Physiology,1994,106(4):1241-1255.
[12]Morita S,Tasaka M,Fujisawa H,et al. A cDNA clone encoding a rice catalase isozyme[J]. Plant Physiology,1994,105(3):1015-1016.
[13]Skadsen R W,Schulze-Lefert P,Herbst J M. Molecular cloning,characterization and expression analysis of two catalase isozyme genes in barley[J]. Plant Molecular Biology,1995,29(5):1005-1014.
[14]Saruyama H,Matsumura T. Cloning and characterization of a cDNA encoding catalase in wheat[J]. DNA sequence:the journal of DNA sequencing and mapping,1999,10(1):31-35.
[15]Redinbaugh M G,Wadsworth G J,Scandalios J G. Characterization of catalase transcripts and their differential expression in maize[J]. Biochimica et Biophysica Acta,1988,951(1):104-116.
[16]Yi S Y,Yu S H,Choi D. Molecular cloning of a catalase cDNA from Nicotiana glutinosa L. and its repression by tobacco Mosaic virus infection[J]. Molecules and Cells,1999,9(3):320-325.
[17]Lin K H,Huang H C,Lin C Y. Cloning,expression and physiological analysis of broccoli catalase gene and Chinese cabbage ascorbate peroxidase gene under heat stress[J]. Plant Cell Reports,2010,29(6):575-593.
[18]Sakajo S,Nakamura K,Asahi T. Molecular cloning and nucleotide sequence of full-length cDNA for sweet potato catalase mRNA[J]. European Journal of Biochemistry,1987,165(2):437-442.
[19]Kamigaki A,Mano S,Terauchi K,et al. Identification of peroxisomal targeting signal of pumpkin catalase and the binding analysis with PTS1 receptor[J]. The Plant Journal,2003,33(1):161-175.
[20]Munné-Bosch S,Queval G,Foyer C H. The impact of global change factors on redox signaling underpinning stress tolerance[J]. Plant Physiology,2013,161(1):5-19.
[21]Smith I K,Kendall A C,Keys A J,et al. Increased levels of glutathione in a catalase-deficient mutant of barley (Hordeum vulgare L.)[J]. Plant Science Letters,1984,37(1/2):29-33.
[22]Willekens H,Chamnongpol S,Davey M,et al. Catalase is a sink for H2O2 and is indispensable for stress defence in C3 plants[J]. The EMBO Journal,1997,16(16):4806-4816.
[23]Vandenabeele S,Vanderauwera S,Vuylsteke M,et al. Catalase deficiency drastically affects gene expression induced by high light in Arabidopsis thaliana[J]. The Plant Journal,2004,39(1):45-58.
[24]Foyer C H,Bloom A J,Queval G,et al. Photorespiratory metabolism:genes,mutants,energetics,and redox signaling[J]. Annual Review of Plant Biology,2009,60:455-484.
[25]Lin A,Wang Y,Tang J,et al. Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice[J]. Plant Physiology,2012,158(1):451-464.
[26]Queval G,Issakidis-Bourguet E,Hoeberichts F A,et al. Conditional oxidative stress responses in the Arabidopsis photorespiratory mutant cat2 demonstrate that redox state is a key modulator of daylength-dependent gene expression,and define photoperiod as a crucial factor in the regulation of H2O2-induced cell death[J]. The Plant Journal,2007,52(4):640-657.
[27]赵淑玲. 水稻条纹病毒Pc2蛋白的定位及功能研究[D]. 扬州:扬州大学,2011:54-67.[HJ1.72mm]
[28]Delledonne M,Zeier J,Marocco A,et al. Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(23):13454-13459.
[29]Bright J,Desikan R,Hancock J T,et al. ABA-induced NO generation and stomatal closure in Arabidopsis are dependent on H2O2 synthesis[J]. The Plant Journal,2006,45(1):113-122.
[30]Dunand C,Cr V M,Penell C. Distribution of superoxide and hydrogen peroxide in Arabidopsis root and their influence on root development:possible interaction with peroxidases[J]. New Phytologist,2007,174(2):332-341.
[31]Potikha T S,Collins C C,Johnson D I,et al. The involvement of hydrogen peroxide in the differentiation of secondary walls in cotton fibers[J]. Plant Physiology,1999,119(3):849-858.
[32]Potock y[DD(-1*2][HT7]'[DD)] M,Jones M A,Bezvoda R,et al. Reactive oxygen species produced by NADPH oxidase are involved in pollen tube growth[J]. The New Phytologist,2007,174(4):742-751.
[33]Melillo M T,Leonettil P,Bongiovanni M,et al. Modulation of reactive oxygen species activities and H2O2 accumulation during compatible and incompatible tomato-root-knot nematode interactions[J]. New Phytologist,2006,170(3):501-512.
[34]Mittler R,Herr E H,Orvar B L,et al. Transgenic tobacco plants with reduced capability to detoxify reactive oxygen intermediates are hyperresponsive to pathogen infection[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(24):14165-14170.

