低分子壳聚糖对缺氧复氧大鼠心肌细胞的保护作用
林玲辉,卫茹,胡亚平,王卓,李迎娟
(邢台医学高等专科学校,河北邢台054300)
低分子壳聚糖对缺氧复氧大鼠心肌细胞的保护作用
林玲辉,卫茹,胡亚平,王卓,李迎娟
(邢台医学高等专科学校,河北邢台054300)
目的 探讨低分子壳聚糖(LMCTS)对缺氧复氧大鼠心肌细胞的保护作用,并探讨其作用机制。方法原代培养大鼠心肌细胞,将其分为空白对照组、模型组及低、中、高LMCTS组。空白对照组正常培养,不予任何处理;模型组用真空缺氧处理1 h后复氧24 h;低、中、高LMCTS组分别加入含200、400、600 μg/mL LMCTS的培养液,培养24 h后再用真空缺氧处理1 h后复氧24 h。ELISA法测定各组细胞上清液中炎症因子TNF-α、IL-6,Western blot法检测心肌细胞解偶联蛋白-2(UCP-2)表达。结果 低、中、高LMCTS组心肌细胞存活率均较模型组升高(P均<0.01)。模型组心肌细胞上清液中TNF-α、IL-6水平高于空白对照组(P均<0.01),低、中、高LMCTS组均低于模型组,以高LMCTS组最低(P均<0.01)。模型组心肌细胞UCP-2表达较空白对照组升高,低、中、高LMCTS组较模型组降低,以高LMCTS组最低(P均<0.01)。结论LMCTS对缺氧复氧心肌细胞具有保护作用,其机制与抑制炎症反应、降低UCP-2表达有关。
壳聚糖;缺氧复氧;解偶联蛋白-2;心肌细胞;大鼠
低分子壳聚糖(LMCTS)是一种天然的带正电荷的生物高分子线形多糖,是壳聚糖降解后的产物,有较高的溶解度,易被吸收和利用。研究表明,壳聚糖具有降血脂、降血压、降血糖、抗肿瘤、抗脂质过氧化、调节免疫等多种特性,广泛用于医学各领域[1~3]。缺氧复氧损伤指心肌细胞在缺氧复氧过程中产生各种氧自由基,对细胞膜及生物大分子造成过氧化损伤,破坏细胞膜的正常结构,对心肌细胞造成严重损伤[4]。2014~2015年,我们观察了LMCTS对缺氧复氧大鼠心肌细胞的保护作用,及其对解偶联蛋白-2(UCP-2)表达的影响,探讨LMCTS保护大鼠心肌细胞的机制。
1 材料与方法
1.1材料出生72 h内的清洁级Wistar大鼠,雌雄不限,由邢台医学高等专科学校实验动物中心提供。LMCTS购于济南海得贝海洋生物工程有限公司;UCP-2大鼠单克隆抗体购自Abcam公司;羊抗鼠IgG购于天津三箭生物技术有限公司;Alexa Fluor 488标记的羊抗鼠IgG抗体购自沃特司生物系统有限公司;UCP-2引物购自上海生工公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;第1链cDNA合成试剂盒购于北京全式金生物技术有限公司;RIPA裂解液、TRIzol、胰蛋白酶、青链霉素混合溶液均购于北京鼎国昌盛生物技术有限公司;胎牛血清为GIBICO公司产品;高糖DMEM培养基购于赛默飞世尔生物化学制品(北京)有限公司。
1.2大鼠原代心肌细胞培养取大鼠心脏,剪成1 mm3大小的组织块,加入胰蛋白酶消化,加入PBS,离心弃上清。加入DMEM培养基制成细胞悬液,再加入10%胎牛血清和1%青-链霉素溶液。差速贴壁90 min后,小心吸出未壁贴细胞悬液至新的培养皿中培养。
1.3大鼠缺氧复氧模型的建立取培养72 h的大鼠心肌细胞,饥饿处理24 h后,随机分成空白对照组、模型组和低、中、高LMCTS组预处理组,每组设6个复孔,空白对照组正常培养,不予任何处理;模型组用真空缺氧处理1 h后复氧24 h;低、中、高LMCTS组分别加入含200、400、600 μg/mL LMCTS的培养液,培养24 h后,再用真空缺氧处理1 h后复氧24 h。
1.4心肌细胞活力测定采用MTT比色法。细胞计数后在96孔板上以1×104/孔接种细胞。每孔加入20 μL MTT溶液,继续培养4 h,吸出培养液。每孔加入二甲基亚砜(DMSO)100 μL,室温低速震荡30 min充分溶解。酶标仪测定各孔在570 nm波长的吸收值。细胞存活率=(实验组光吸收值/对照组光吸收值)×100%。
1.5细胞上清中TNF-α、IL-6水平检测采用ELISA法。收集各组细胞上清液,按照ELISA试剂盒说明书操作,最后使用酶标仪检测TNF-α、IL-6。
1.6心肌细胞UCP-2蛋白表达检测采用Western blot法。将各组细胞用200 μL RIPA裂解液裂解,用干净的细胞刮将细胞迅速刮下,转移至1.5 mL的EP管中,冰上裂解30 min,离心取上清,用BCA蛋白浓度测定试剂盒测定蛋白质浓度。SDS-PAGE电泳,浓缩胶80 V恒压,分离胶160 V恒压,将蛋白转移至醋酸纤维素膜上。TBST溶液洗膜,5%脱脂奶粉封闭2 h,洗膜3次,再用UCP-2抗体(1∶1 000)室温摇床上孵育2 h,加入羊抗鼠IgG抗体(1∶1 000)室温孵育2 h,加入ECL显色液,多功能成像系统显影。以各组UCP-2蛋白的灰度值与内参GAPDH的灰度值之比作为UCP-2蛋白的相对表达量。
2 结果
2.1各组心肌细胞存活率比较空白对照组、模型组及低、中、高LMCTS组细胞存活率分别为100%±1%、67%±39%、70%±29%、78%±7%、89%±2%。模型组细胞存活率较空白对照组降低,低、中、高LMCTS组均较模型组升高(P均<0.01)。
2.2各组心肌细胞上清液中TNF-α、IL-6水平比较模型组心肌细胞上清液中TNF-α、IL-6水平高于空白对照组(P均<0.01),低、中、高LMCTS组均低于模型组,以高LMCTS组最低(P<0.01)。见表1。
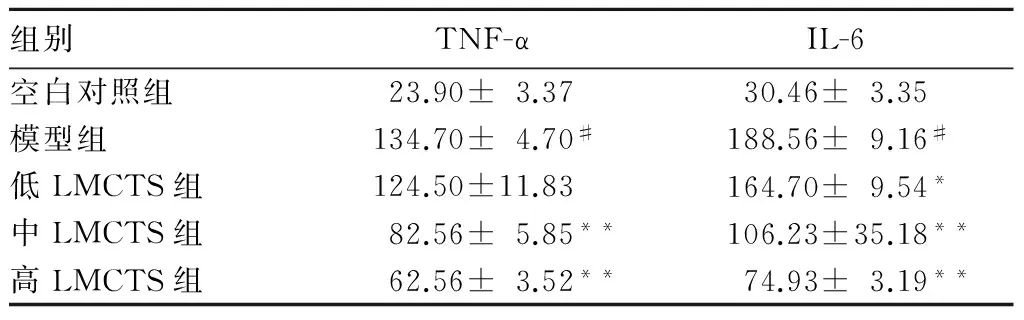
表1 各组心肌细胞上清液中TNF-α、IL-6水平比较(n=6,pg/mL)
注:与模型组比较,*P<0.05,**P<0.01;与空白对照组比较,#P<0.05。
2.3各组心肌细胞UCP-2蛋白表达比较空白对照组、模型组及低、中、高LMCTS组心肌细胞UCP-2蛋白的相对表达量分别为1.00±0.01、1.50±0.10、1.49±0.12、1.30±0.03、1.06±0.04。模型组心肌细胞UCP-2表达较空白对照组显著升高;中、高LMCTS组均较模型组降低,且以高LMCTS组最低(P均<0.01)。
3 讨论
缺氧复氧损伤可引起心律失常、急性心力衰竭及心源性休克等,白细胞和许多炎症因子直接参与或间接调动更多炎症介质导致心肌损伤。研究证实,壳聚糖能通过提高SOD活性,降低MDA含量,提高体内抗氧化酶的活性,降低脂质氧化含量,增强机体抗氧化应激能力;抑制腹主动脉再狭窄,在一定范围内具有调节血管平滑肌细胞和血管成纤维细胞增殖的能力[5]。赵英政等[6]报道,壳聚糖可显著提高镉中毒大鼠肾组织中SOD活性并降低MDA含量。瞿春莹等[7]报道,壳聚糖能增强抗氧化酶活性,减轻胃溃疡局部炎症介导的氧自由基损伤,进而促进溃疡愈合。袁菊萍等[8]报道,壳聚糖能降低MDA水平,升高SOD活性,提高其对体内氧化自由基的清除能力,减少脂质过氧化物生成。高颖晖等[9]测定负荷训练结束后大鼠肝脏的抗氧化酶系活性时,发现补充壳聚糖能显著增强大鼠肝脏抗氧化酶活性,促进SOD编码基因表达。
UCP-2是一种哺乳动物独有的、位于线粒体内膜上的质子载体蛋白,其将H+从线粒体内膜渗漏到基质中,使氧化磷酸化解偶联,导致ATP合成减少。UCP-2广泛分布于骨骼肌、脂肪、心、肺、肾、肝、脑,与机体能量代谢、心脏功能等有密切联系[10]。研究表明,UCP-2在调控ROS、抑制炎症反应和细胞凋亡等方面均可发挥重要作用。Koziel等[11]发现,UCP-2能减少大鼠心肌ROS产生,降低细胞内Ca2+浓度,对细胞起到保护作用。Derdak等[12]发现,UCP-2能通过抑制NF-κB的产生,减少炎症介质的释放和ROS的生成而保护心肌。还有研究表明,UCP-2能抑制平滑肌细胞的增殖和迁移,并防止内皮细胞和心肌细胞凋亡[13,14]。壳聚糖对大鼠心肌细胞的保护作用是否与UCP2表达有关,目前未见文献报道。
本研究显示,与空白对照组相比,模型组心肌细胞培养上清液中TNF-α、IL-6水平显著增高,表明心肌细胞缺氧复氧损伤可引起明显的炎症反应。不同浓度LMCTS处理后可显著降低缺氧复氧心肌细胞培养上清液中TNF-α、IL-6水平,表明LMCTS能够抑制炎症反应,且浓度越高,其抑制炎症反应的作用越明显。在正常心肌细胞中,UCP-2呈低水平表达;在缺氧复氧诱导的无LMCTS预处理的心肌细胞损伤模型中,UCP-2表达明显升高;而LMCTS对缺氧复氧损伤心肌细胞UCP-2表达均具有抑制作用,其中以600 μg/mL LMCTS作用最明显。表明LMCTS对缺氧复氧心肌细胞具有保护作用,该作用与其抑制炎症反应、降低UCP-2表达有关。
[1] 刘静娜,张家骊,夏文水.壳聚糖降低脂质过氧化的作用[J].食品与生物技术学报,2010,29(6):836-841.
[2] 韩宝芹,王剑,蔡文娣,等.水溶性低分子壳聚糖对糖尿病大鼠血糖的影响[J].中国海洋大学学报,2011,41(1/2):87-92.
[3] 康小平,叶永杰.壳聚糖关节腔注射对骨关节炎膝关节功能及关节液炎性因子的影响[J].中国临床康复,2009,9(15):42-43.
[4] 张金艳,李澎,李贻奎,等.丹皮酚、芍药苷及二者配伍对体外培养心肌细胞缺氧/复氧损伤的影响[J].中国中西医结合杂志,2012,32(4):510-514.
[5] 任彦锋,张帆,王莉,等.球囊损伤腹主动脉大鼠血浆NO水平的变化及WSC对其影响[J].中国实验诊断学,2013,17(8):1369-1371.
[6] 赵英政,张利利,徐光翠,等.壳聚糖对镉染毒大鼠肾脏中超氧化物歧化酶活性和丙二醛含量的影响[J].新乡医学院学报,2012,29(4):268-270.
[7] 瞿春莹,李定国,汪余勤,等.壳聚糖对胃溃疡大鼠血清中MDA、SOD及GSH-PX的影响[J].上海医药,2008,29(5):219-222.
[8] 袁菊萍,黄金华,陆媛.壳聚糖抗动脉粥样硬化的实验研究[J].医药导报,2009,28(6):698-699.
[9] 高颖晖,周万红,曹军,等.昆虫壳聚糖对运动训练大鼠肝脏抗氧化酶系与SOD基因表达的影响[J].体育科学,2011,31(5):75-78.
[10] Mattiasson G, Sullivan PG. The emerging functions of UCP2 in health, disease, and therapeutics[J]. Antioxid Redox Signal, 2006,8(1-2):1-38.
[11] Koziel A, Sobierai I, Jarmuszkiewicz WP, et al. Increased activity of mitochondrial uncoupling protein 2 improves stress resistance in cultured endothelial cells exposed in vitro to high glucose levels[J]. Am J Physiol Heart Circ Physiol, 2014,3(1):192-200.
[12] Derdak Z, Fulop P, Sabo E, et al. Enhanced colon tumor induction in uncoupling protein-2 deficient mice is associated with NF-kappaB activation and oxidative stress[J]. Carcinogenesis, 2006,27(5):956-961.
[13] Park JY, Park KG, Kim HJ, et al. The effects of the overexpression of recombinant uncoupling protein 2 on proliferation, migration and plasminogen activator inhibitor 1 expression in human vascular smooth muscle cells[J]. Diabetologia, 2005,48(5):1022-1028.
[14] 高艳辉,郑方方,孔一慧,等.解偶联蛋白2与心力衰竭的关系[J].国际心血管病杂志,2013,40(2):101-102.
河北省高等学校科学研究项目(QN2014303)。
10.3969/j.issn.1002-266X.2016.22.011
R541.2
A
1002-266X(2016)22-0033-03
2015-11-25)

