阿托伐他汀对小鼠肾毒血清性肾炎保护作用的研究
屠海燕(浙江大学医学院附属第二医院肾脏内科,浙江杭州321000)
阿托伐他汀对小鼠肾毒血清性肾炎保护作用的研究
屠海燕(浙江大学医学院附属第二医院肾脏内科,浙江杭州321000)
目的探讨他汀类药物对小鼠肾毒血清性肾炎的干预治疗作用。方法建立小鼠肾毒血清性肾炎模型,治疗组小鼠于注射肾毒血清(NTS)造模成功24 h内腹腔注射剂量分别为1、10、25 mg/kg阿托伐他汀。联合注射NTS+阿托伐他汀治疗7 d后处死所有小鼠,取血并收集24 h尿液,测定血清尿素氮(BUN)水平,尿蛋白含量,检查肾脏病理组织学变化。结果阿托伐他汀治疗组与模型组比较,实验小鼠体质量增加不明显,尿蛋白含量降低(P<0.01),血清BUN含量减少(P<0.01),肾炎病理改变程度轻。阿托伐他汀的保护作用呈剂量依赖性,10 mg/kg治疗组的保护作用最强。结论阿托伐他汀可有效地减轻实验动物尿蛋白,改善肾小球滤过功能,对小鼠免疫性肾炎具有保护作用。
肾小球肾炎/血液;血尿素氮;免疫活性;炎症;吡咯类
肾毒血清性肾小球肾炎,又称抗基底膜肾炎,是异体抗基底膜(glomerular basement membrane,GBM)抗体直接与肾小球上的GBM抗原相结合而诱导形成的一种免疫介导的炎症性疾病[1]。目前,免疫调节治疗是有效治疗免疫介导性肾小球疾病的重要手段之一。阿托伐他汀是目前国内最新一代他汀类药物(3-羟基-3-甲基辅酶A还原酶抑制剂)。研究证实,他汀类药物除降低血清胆固醇和三酰甘油,防治动脉粥样硬化的形成,预防和减少冠心病不良事件的发生外,同时还具有抗炎,免疫调节等独立于降脂的作用,有证据支持其对肾脏疾病具有保护作用[2-4]。由肾毒血清(NTS)诱导的肾毒血清性肾炎是发病机制、病理改变唯一类似于人抗GBM病的肾小球性肾炎实验动物模型。本研究通过注射含抗GBM抗体的兔血清制备小鼠肾毒血清性肾炎模型,探讨新型他汀类药物阿托伐他汀对肾毒血清性肾炎的治疗效果,并且寻求最佳注射剂量,从而为汀类药物治疗免疫性肾炎提供实验依据。
1 材料与方法
1.1动物与试剂雌性C57BL/6小鼠购于浙江大学动物实验中心,均为8~12周龄,体质量17~22 g阿托伐他汀购自辉瑞公司,兔抗鼠肾小球基底NTS由本实验室制。
1.2方法
1.2.1检测指标24 h尿蛋白,血清尿素氮(BUN)含量由全自动生化分析仪测定。病理学检查:取小块肾皮质用多聚甲醛固定后,石蜡包埋,制成切片后行苏木精-伊红(HE)染色。观察肾小球体积大小,肾小球内细胞数,新月体形成及肾小管内蛋白管型等变化情况。
1.2.2肾炎模型制造参照文献[5-6]介绍的方法,结合本实验室实际情况制备兔抗鼠肾小球基底膜NTS。所有的实验动物应用正常兔IgG(每只5 mg)加完全弗氏佐剂皮下注射进行预免疫,5 d后应用兔抗鼠肾小球基底膜的肾毒性血清10 mL/kg体质量经尾静脉注射。
1.2.3实验分组设计雌性小鼠40只,随机分为四组:模型组(n=10):尾静脉注射兔抗鼠肾小球基底膜NTS10 mL/kg,不给予任何治疗;低剂量阿托伐他汀干预组(n=10):注射NTS后24 h内给予阿托伐他汀1 mg/kg每天腹腔注射,连续注射7 d;中剂量阿托伐他汀干预组(n=10):注射NTS后24 h内给予阿托伐他汀10 mg/kg每天腹腔注射,连续注射7 d;高剂量阿托伐他汀干预组(n=10):注射NTS后24 h内给予阿托伐他汀25 mg/kg每天腹腔注射,连续注射7 d;所有小鼠于第7天断头处死,留取24 h尿检测尿蛋白,取血测BUN,处死后取肾组织病理检查。
1.3统计学处理应用SPSS18.0统计软件进行数据分析,所有数据均以表示,组间差异显著性采用t检验判定。P<0.05为差异有统计学意义。
2 结 果
2.1阿托伐他汀治疗有效抑制了小鼠肾毒血清性肾炎C57BL/6小鼠注射NTS后出现了严重的肾炎表现:严重蛋白尿,少尿型急性肾功能衰竭,同时组织学证据证实为急性肾小球肾炎。相比之下,给予阿托伐他汀治疗后肾炎症状明显改善。同时因液体滞留导致的体质量增加得到改善,尿蛋白,BUN水平下降,但各组小鼠血清总胆固醇及三酰甘油水平差异均无统计学意义。此外,阿托伐他汀对肾脏保护呈剂量依赖性,阿托伐他汀剂量为25、10 mg/kg,有效地防止肾炎发展,而1 mg/kg的剂量不具有保护作用(图1~4)。
2.2体质量改变如图1所示,模型组小鼠在注射NTS后造模成功,小鼠出现严重的少尿型急性肾功能衰竭,水分潴留,体质量增加明显。对于3个治疗组,1 mg/kg阿托伐他汀治疗组小鼠水分潴留明显,而10、25 mg/kg治疗小鼠,体质量未显著增加。由此推断分析,1 mg/kg治疗剂量可能未达到治疗效果,需加大剂量,且此结论与病理结果显示相一致。
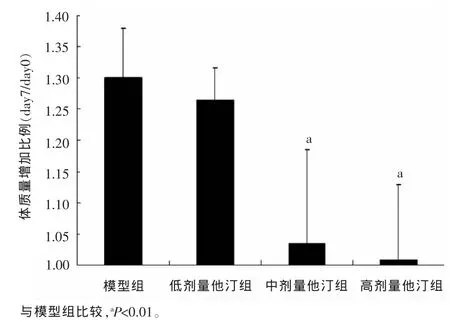
图1 各组小鼠实验前后体质量变化情况
2.3尿蛋白测定尿蛋白的测定是在肾炎时反映肾小球滤过功能的常用指标。蛋白尿的出现主要是因为免疫损伤所致的肾小球基底膜的分子结构改变,滤过孔孔径变大及基底膜阴离子屏障的破坏,使带阴电荷的清蛋白自由通过,所以蛋白尿的轻重反映了肾小球基底膜的病变程度。实验证实,阿托伐他汀能有效地减轻NTS所致尿毒血清性肾炎的蛋白尿,改善肾功能,见图2。

图2 各组小鼠实验前后24 h尿蛋白变化情况
2.4BUN水平测定实验证明了,阿托伐他汀可有效地降低BUN含量,尤其是高剂量(25 mg/kg),中剂量(10 mg/kg)干预组,其对BUN含量抑制作用更加明显,见图3。
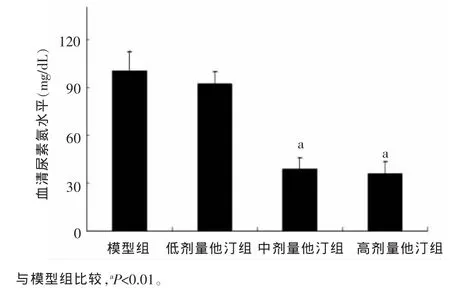
图3 各组小鼠实验前后BUN变化
2.5病理学改变A图为模型组肾脏病理,表现为肾小球体积较正常对照组增大,细胞数明显增多,肾小球间质中可见炎性细胞浸润。B图为联合阿托伐他汀治疗后肾脏病理,肾炎表现明显改善。

图4 两组小鼠肾脏病理表现比较(HE,×40)
3 讨 论
在本研究中,注射含抗小鼠GBM抗体的兔血清后尿蛋白含量逐渐升高,BUN也明显增加,表明肾功能出现明显损害,作者成功地复制了小鼠肾毒血清性肾小球肾炎动物模型。
阿托伐他汀是3-羟基-3-甲基辅酶A还原酶抑制剂类降脂药。近年的研究证明他汀类药物除了降脂作用外,还发挥其他许多降脂外功能:可以有效预防心血管疾病、癌症、肾脏病变、骨骼疾病、抗炎及器官排斥等的预防和辅助治疗[7]。
本研究通过比较小鼠肾炎模型组和联合阿托伐他汀干预组在临床生化指标及肾组织病理学方面的变化,证实了阿托伐他汀对肾毒血清性肾炎治疗作用,而实验中各组小鼠血清总胆固醇及三酰甘油水平并无显著性差异,这也进一步提示了阿托伐他汀通过非降脂途径来发挥该保护肾脏功能。
多项研究证实,他汀类药物具有免疫调节或者免疫抑制作用,Palinski[8]指出,免疫调节作用是他汀药物除降脂以外的新药理作用。他汀药物通过对炎症途径的影响,表现良好的免疫调节活性。他汀药物主要通过抑制羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶活性,使其下游代谢产物甲羟戊酸(MVA)和异戊烯焦酸酯(GGPP)直接受抑制,从而影响蛋白的异戊烯化。异戊烯化蛋白包括GTP结合蛋白Ras和Ras样蛋白如Rho,Rab,Rac,Ra1和Rap,这些蛋白可影响细胞内运转,膜交换,RNA稳定性和基因转录等。除上述甲羟戊酸途径,他汀药物可直接与淋巴细胞功能性抗原1(LFA-1)结合,抑制LFA-1介导的淋巴细胞黏附和共刺激作用[9],而后者在炎症和自身免疫性疾病中发挥重要致病作用。Bagnato等[10]研究发现,在系统性硬化症小鼠动物模型实验中,辛伐他汀通过激活VEGF-ERK-Ras and Rho途径,有效发挥抗炎及免疫调节作用从而抑制肺动脉纤维化进展。Graaf等[11]研究表明,他汀类药物抑制急性炎症反应中ICAM-1表达,阻断细胞间信号转导,同种异型应答的T细胞繁殖明显被抑制,从而移植物存活时间明显延长。
不少研究证实,他汀药物的免疫调节作用使其在自身免疫性疾病中也存在应用前景。Leung等[12]通过动物模型研究表明:低于降脂剂量的辛伐他汀有明显的预防和治疗关节炎作用,在关节炎发病前应用辛伐他汀,关节炎发病率和关节炎指数均下降,发病后应用,关节肿胀数和关节炎指数亦较对照组显著降低。组织学发现,受累关节滑膜增生、炎性细胞浸润和骨糜烂程度亦较对照组轻。对类风湿关节炎患者外周血和滑膜液刺激试验发现,辛伐他汀呈剂量依赖性对干扰素(IFN-γ)的分泌产生抑制。2012年发表在Circulation杂志上的一项囊括24 278例患者的meta分析结果提示:阿托伐他汀能有效降低蛋白尿同时提高肾小球率过滤,恢复患者肾功能[13]。本研究结果基本与其相一致。Abud-Mendoza等[14]应用他汀药物尝试治疗某些难治性自身免疫疾病,结果3例SLE患者经辛伐他汀80 mg/d,连续8 d后,其蛋白尿水平明显下降,外周血淋巴细胞的自发性凋亡也显著下调。这些提示,他汀药物有可能成为治疗自身免疫性疾病的一种重要用药。
本研究观察到阿托伐他汀对肾毒血清性肾炎具有明显的保护作用。阿托伐他汀治疗有效降低了尿蛋白水平,抑制血清尿素氮升高,保护肾脏功能[13]。为了探索阿托伐他汀肾脏保护作用的最佳剂量,本研究设置了1、10、25 mg/kg三个剂量组,实验证实10、25 mg/kg剂量组保护肾脏功能,且在治疗效果上无明显差异,而1 mg/kg治疗组未能发挥作用,因此,10 mg/kg剂量是治疗小鼠肾毒血清性肾炎的最佳剂量。关于他汀类药物免疫调节作用,以及他汀类药物对肾毒血清性肾炎保护作用的具体机制,本研究未提供直接证据,需要后续实验进一步研究阐明。
[1]Hoedemaeker PJ,Weening JJ.Weening,Relevance of experimental models for human nephropathology[J].Kidney Int,1989,35(4):1015-1025.
[2]Chow SC.Immunomodulation by statins:mechanisms and potential impact on autoimmune diseases[J].Arch Immunol Ther Exp(Warsz),2009,57(4):243-251.
[3]Ota T,Takamura T,Ando H,et al.Preventive effect of cerivastatin on diabetic nephropathy through suppression of glomerular macrophage recruitment in a rat model[J].Diabetologia,2003,46(6):843-851.
[4]Steffens S,Mach F.Drug insight:Immunomodulatory effects of statinspotential benefits for renal patients?[J].Nat Clin Pract Nephrol,2006,2(7):378-387.
[5]Baxter JH,Goodman HC.Nephrotoxic serum nephritis in rats.I.Distribution and specificity of the antigen responsible for the production of nephrotoxic antibodies[J].J Exp Med,1956,104(4):467-485.
[6]Schreiner GF,Cotran RS,Pardo V,et al.A mononuclear cell component in experimental immunological glomerulonephritis[J].J Exp Med,1978,147(2):369-384.
[7]LiaoJK,LaufsU.Pleiotropiceffectsof statins.Annu Rev Pharmacol Toxicol,2005,45:89-118.
[8]Palinski W.Immunomodulation:a new role for statins?[J]Nat Med,2000,6(12):1311-1312.
[9]Weitz-Schmidt G,Welzenbach K,Brinkmann V,et al.Statins selectively inhibit leukocyte function antigen-1 by binding to a novel regulatory integrin site[J].Nat Med,2001,7(6):687-692.
[10]Bagnato G,Bitto A,Pizzino G,et al.Simvastatin attenuates the development of pulmonary and cutaneous fibrosis in a murine model of systemic sclerosis[J].Rheumatology(Oxford),2013,52(8):1377-1386.
[11]Graaf MR,Beiderbeck AB,Egberts AC,et al.The risk of cancer in users of statins[J].J Clin Oncol,2004,22(12):2388-2394.
[12]Leung BP,Sattar N,Crilly A,et al.A novel anti-inflammatory role for simvastatin in inflammatory arthritis[J].J Immunol,2003,170(3):1524-1530.
[13]Wu Y,Wang Y,An C,et al.Effects of rosuvastatin and atorvastatin on renal function:meta-analysis[J].Circ J,2012,76(5):1259-1266.
[14]Abud-Mendoza C,de la Fuente H,Cuevas-Orta E,et al.Therapy with statins in patients with refractory rheumatic diseases:a preliminary study[J]. Lupus,2003,12(8):607-611.
Study on protective effect of atorvastatin in mouse nephrotoxic serum nephritis
Tu Haiyan(Department of Nephrology,
Second Affiliated Hospital,Medical College of Zhejiang University,Hangzhou,Zhejiang 321000,China)
ObjectiveTo investigate the interventional treatment effect of statins in mouse nephrotoxic serum nephritis. MethodsThe mouse nephrotoxic serum nephritis model was established by nephrotoxic serum (NTS)injection.Then mice in the treatment group were intraperitoneally injected by 1,10,25 mg/kg atorvastatin at 24 h after the model construction.After NTS plus atorvastatin treatment for 7 d,all mice were killed,the blood and 24 h urine were collected for detecting serum urea nitrogen (BUN)and urinary protein level.Furthermore the renal histopathologic changes were detected.ResultsCompared with the model group,the body weight increase in the atorvastatin treatment group was not obvious,the urinary protein level was decreased (P<0.01),serum BUN level was reduced(P<0.01),and the degree of nephritis pathologica change was alleviated.The protective effect of atorvastatin showed the dose dependent manner,the protective effect tin the 10 mg/kg treatment group was strongest. ConclusionAtorvastatin can effectively alleviate urinary protein in the experimental animal,improves the glomerular filtration function,and has the protective effect for mouse immune nephritis.
Glomerulonephritis/blood;Blood urea nitrogen;Immunocompetence;Inflammation;Pyrroles
10.3969/j.issn.1009-5519.2016.03.011
A
1009-5519(2016)03-0352-03
屠海燕(1985-),硕士学历,医师,主要从事肾脏病相关疾病诊治工作。
(2015-07-14)

