可溶性CD40配体对K562细胞增殖及生存素mRNA 和IL-8表达的影响*
封忠昕,吴燕梅,陈 琦,肖建辉,冯 进(.遵义医学院附属医院检验科,贵州 遵义563003;.荷泽市立医院老年科,山东703;3.遵义医学院附属医院血液内科,贵州遵义563003;.贵州省细胞工程重点实验室,遵义563003)
·论著·
可溶性CD40配体对K562细胞增殖及生存素mRNA 和IL-8表达的影响*
封忠昕1,吴燕梅2,陈琦3△,肖建辉4,冯进1
(1.遵义医学院附属医院检验科,贵州 遵义563003;2.荷泽市立医院老年科,山东274031;3.遵义医学院附属医院血液内科,贵州遵义563003;4.贵州省细胞工程重点实验室,遵义563003)
目的探究可溶性CD40配体(sCD40L)对人白血病K562细胞增殖、生存素(survivin)mRNA表达和白介素8(IL-8)表达水平的影响。方法采用噻唑蓝(MTT)法检测sCD40L对K562细胞增殖的影响,通过RT-PCR检测survivin mRNA表达水平,采用酶联免疫吸附试验(ELISA)测定IL-8表达情况。结果不同浓度的sCD40L(0.5、1.0、1.5、2.0、2.5 μg/mL)对K562细胞增殖均有抑制作用,且可降低survivin mRNA及IL-8的表达水平;sCD40L细胞组细胞增殖抑制率高于K562细胞组,survivin mRNA及IL-8表达水平均低于K562细胞组,差异均有统计学意义(P<0.05),且呈剂量-时间依赖性。结论sCD40L在体外能够明显抑制K562细胞增殖,具有剂量-时间依赖性,sCD40L抑制K562细胞增殖可能与survivin mRNA及IL-8表达水平下调相关。
K562细胞;细胞增殖;survivin基因;白细胞介素8;可溶性CD40配体
慢性粒细胞白血病(chronicmyelocyticleukemia,CML)是一种常见的骨髓异常增殖性血液恶性肿瘤,临床主要表现为脾大,易见Ph染色体和BCR-ABL融合基因,可分为慢性期、加速期和急变期。伊马替尼是第一个治疗CML的靶向药物,但其越来越严重的耐药性成为临床和科研需要面对的极大挑战[1-3],因此,对CML的生物学研究是较为热门的课题。
可溶性CD40配体(sCD40L)属于肿瘤坏死因子(TNF)基因超家族成员之一,其在肿瘤细胞抗原递呈等方面发挥着重要作用。sCD40L可显著抑制B淋巴细胞白血病及多发性骨髓瘤细胞增殖,使肿瘤细胞呈现G1期阻滞,从而诱导肿瘤细胞的凋亡[4-5]。作者前期研究发现,不同浓度的sCD40L干预HL-60细胞时,CD95表达水平上调,Bcl-2表达水平下调,其原因可能是通过死亡受体途径和线粒体途径促进凋亡[6]。本研究通过测定生存素(survivin)mRNA及细胞培养液上清液中白介素 8(IL-8)的表达水平,探讨不同浓度sCD40L对人白血病K562细胞的影响,从而探讨其可能的作用机制,为人重组sCD40L能否应用于白血病的治疗提供理论依据。
1 材料与方法
1.1材料人白血病K562细胞株(中国科学院上海生命研究院细胞资源中心),胎牛血清和RPMI1640(美国Gibico公司),sCD40L(以色列ProSpec公司),RNA提取试剂盒、RT-PCR试剂盒及survivin引物(TaKaRa生物工程公司),酶联免疫吸附试验(ELISA)试剂盒(上海西唐生物科技有限公司)。
1.2方法
1.2.1细胞培养将K562细胞培养于含10%胎牛血清(FBS)的RPMI1640培养基中,置37℃、5%CO2培养箱中培养,取对数生长期细胞进行实验。
1.2.2实验分组(1)K562细胞组:不加任何药物干预组;(2)sCD40L细胞组:sCD40L浓度分别为 0.5、1.0、1.5、2.0、2.5 μg/mL;(3)空白调零组:仅加入 RPMI1640完全培养基(含10%FBS)。
1.2.3噻唑蓝(MTT)法检测细胞增殖取对数生长期的K562细胞(细胞活力大于90%)加入96孔培养板中,每孔细胞1×105(100 μL),总体积为200 μL。每组设5个复孔,用完全培养液(RPMI1640培养液加10%FBS)调整培养体积200 μL,在37℃、5%CO2的培养箱中培养24h,在终止培养前4h每孔加入MTT(5mg/mL)20μL,培养终止后弃上清液,每孔用150μL二甲基亚砜(DMSO)溶解甲臢颗粒,轻轻振摇10 min,测定光密度(OD)值,检测波长570 nm。计算公式:抑制率=(1-sCD40L细胞组OD值)/K562细胞组OD值×100%。
1.2.4survivin mRNA表达水平测定按照说明书提取各浓度、各时间段的细胞RNA,并进行逆转录反应。反应体系:5×Prime ScriptTMBuffer(for Real Time)6.0 μL,Prime Script TMRT Enzyme MixⅠ1.5 μL,Random 6 mers (100 μmol/L)1.5 μL,Oligo Dt Primer(50 μmol/L)1.5 μL,TotalRNA 19.5 μL,总体积30 μL。逆转录反应条件37℃15min,85℃5 s灭活逆转录酶。将逆转录产物cDNA放置-20℃冰箱保存。按照说明书进行RT-PCR,取1 μL逆转录产物cDNA进行PCR扩增。反应体系:SYBR® Premix Ex TaqTM10 μL,引物混合液(上、下游引物)1 μL,0.1%焦碳酸二乙酯(DEPC)8 μL,总体积20 μL。预变性95℃30 s 1个循环;PCR反应95℃5 s,60℃30 s,40个循环。survivin(NM_00101 2271.1):上游引物5′-GTCTGGCGTAAGATGATGGATTTG-3′,下游引物3′-CACAGCAGTGTTTGAAATGACAGG-5′;β-actin(NM_ 001101.3):上游引物5′-TGGCACCCAGCACAATGATGAA-3′,下游引物3′-CTAAGTCATAGTCCGCCTAGAAGCA-5′。实验结果以2-△△Ct相对值计算mRNA表达情况。
1.2.5IL-8水平测定严格按照IL-8 ELISA试剂盒说明书的操作步骤进行操作。酶标包被板上分别设置空白孔、标准孔、待测样品孔,分别加入细胞培养液、稀释后的标准品、待测样品上清液各100 μL,每孔均设置5个复孔。在37℃反应120min,加入一抗,37℃反应60min,洗涤后加入酶标抗体工作液,37℃反应30 min,洗涤后加入底物工作液,37℃反应15 min,最后加入终止液,用酶标仪在450 nm波长处检测吸光度。
1.3统计学处理应用SPSS17.0统计软件进行数据分析,计量资料以±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1sCD40L对K562细胞增殖的影响不同浓度的sCD40L(0.5、1.0、1.5、2.0、2.5 μg/mL)作用K562细胞24、48、72 h后,随着sCD40L浓度的增加及作用时间的延长,K562细胞增殖抑制率随之升高,且与K562细胞组比较,差异均有统计学意义(P<0.05),见表1。
表1 sCD40L不同作用时间对K562细胞增殖的抑制情况(±s,%,n=5)
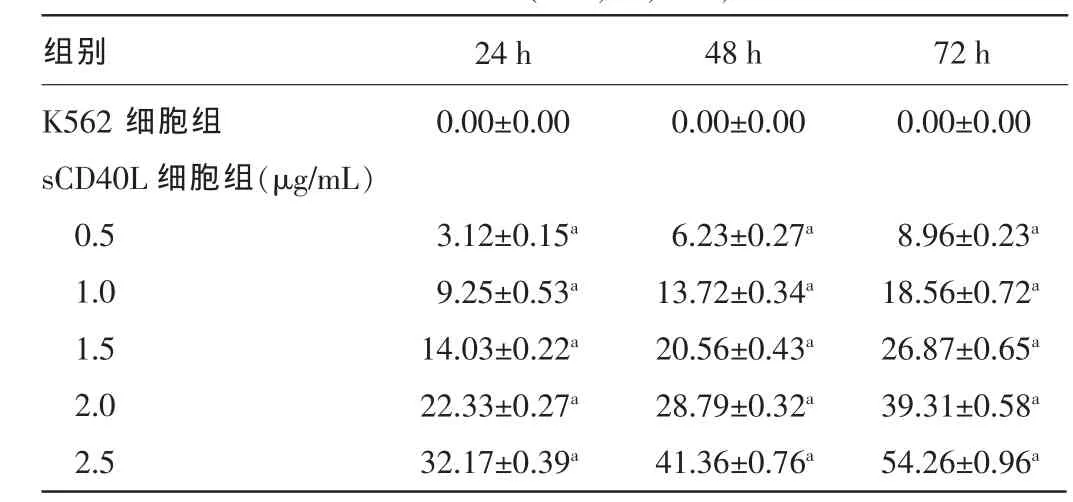
表1 sCD40L不同作用时间对K562细胞增殖的抑制情况(±s,%,n=5)
注:与K562细胞组比较,aP<0.05。
组别2 4 h 4 8 h 7 2 h K 5 6 2细胞组s C D 4 0 L细胞组(μ g / m L )0 . 5 1 . 0 1 . 5 2 . 0 2 . 5 0 . 0 0 ± 0 . 0 0 0 . 0 0 ± 0 . 0 0 0 . 0 0 ± 0 . 0 0 8 . 9 6 ± 0 . 2 3a1 8 . 5 6 ± 0 . 7 2a2 6 . 8 7 ± 0 . 6 5a3 9 . 3 1 ± 0 . 5 8a5 4 . 2 6 ± 0 . 9 6a3 . 1 2 ± 0 . 1 5a9 . 2 5 ± 0 . 5 3a1 4 . 0 3 ± 0 . 2 2a2 2 . 3 3 ± 0 . 2 7a3 2 . 1 7 ± 0 . 3 9a6 . 2 3 ± 0 . 2 7a1 3 . 7 2 ± 0 . 3 4a2 0 . 5 6 ± 0 . 4 3a2 8 . 7 9 ± 0 . 3 2a4 1 . 3 6 ± 0 . 7 6a
2.2sCD40L对K562细胞survivin mRNA表达水平的影响不同浓度的sCD40L(0.5、1.0、1.5、2.0、2.5 μg/mL)作用K562细胞24、48、72 h后,随着sCD40L浓度的增加及作用时间的延长,survivin mRNA表达水平随之降低,与K562细胞组比较,差异均有统计学意义(P<0.05)。见表2。
表2 sCD40L不同作用时间对K562细胞survivinmRNA表达水平的影响(±s,n=5)
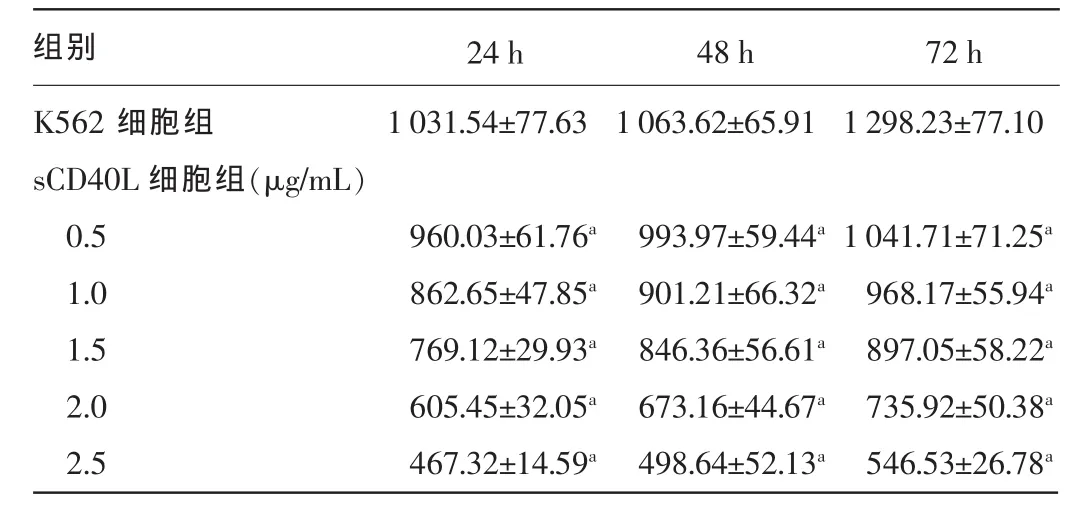
表2 sCD40L不同作用时间对K562细胞survivinmRNA表达水平的影响(±s,n=5)
注:与K562细胞组比较,aP<0.05。
组别2 4 h 4 8 h 7 2 h K 5 6 2细胞组s C D 4 0 L细胞组(μ g / m L )0 . 5 1 . 0 1 . 5 2 . 0 2 . 5 1 0 3 1 . 5 4 ± 7 7 . 6 3 1 0 6 3 . 6 2 ± 6 5 . 9 1 1 2 9 8 . 2 3 ± 7 7 . 1 0 1 0 4 1 . 7 1 ± 7 1 . 2 5a9 6 8 . 1 7 ± 5 5 . 9 4a8 9 7 . 0 5 ± 5 8 . 2 2a7 3 5 . 9 2 ± 5 0 . 3 8a5 4 6 . 5 3 ± 2 6 . 7 8a9 6 0 . 0 3 ± 6 1 . 7 6a8 6 2 . 6 5 ± 4 7 . 8 5a7 6 9 . 1 2 ± 2 9 . 9 3a6 0 5 . 4 5 ± 3 2 . 0 5a4 6 7 . 3 2 ± 1 4 . 5 9a9 9 3 . 9 7 ± 5 9 . 4 4a9 0 1 . 2 1 ± 6 6 . 3 2a8 4 6 . 3 6 ± 5 6 . 6 1a6 7 3 . 1 6 ± 4 4 . 6 7a4 9 8 . 6 4 ± 5 2 . 1 3a
2.3sCD40L对K562细胞培养上清液中IL-8表达水平的影响不同浓度的sCD40L(0.5、1.0、1.5、2.0、2.5μg/mL)作用K562细胞24、48、72 h后,随着sCD40L浓度的增加及作用时间的延长,IL-8表达水平随之降低,与K562细胞组比较,差异均有统计学意义(P<0.05)。见表3。
表3 sCD40L对K562细胞IL-8表达水平的影响(±s,n=5)
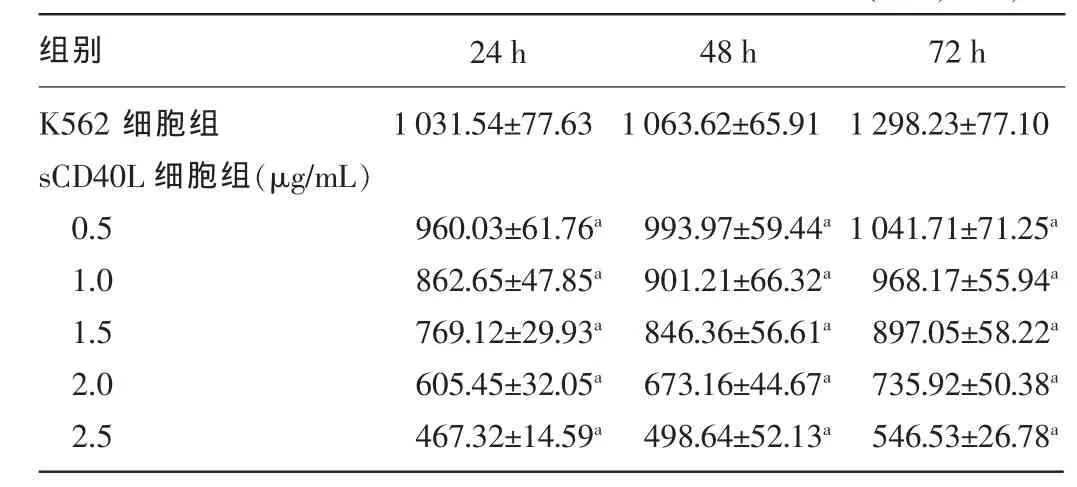
表3 sCD40L对K562细胞IL-8表达水平的影响(±s,n=5)
注:与K562细胞组比较,aP<0.05。
组别2 4 h 4 8 h 7 2 h K 5 6 2细胞组s C D 4 0 L细胞组(μ g / m L )0 . 5 1 . 0 1 . 5 2 . 0 2 . 5 1 0 3 1 . 5 4 ± 7 7 . 6 3 1 0 6 3 . 6 2 ± 6 5 . 9 1 1 2 9 8 . 2 3 ± 7 7 . 1 0 1 0 4 1 . 7 1 ± 7 1 . 2 5a9 6 8 . 1 7 ± 5 5 . 9 4a8 9 7 . 0 5 ± 5 8 . 2 2a7 3 5 . 9 2 ± 5 0 . 3 8a5 4 6 . 5 3 ± 2 6 . 7 8a9 6 0 . 0 3 ± 6 1 . 7 6a8 6 2 . 6 5 ± 4 7 . 8 5a7 6 9 . 1 2 ± 2 9 . 9 3a6 0 5 . 4 5 ± 3 2 . 0 5a4 6 7 . 3 2 ± 1 4 . 5 9a9 9 3 . 9 7 ± 5 9 . 4 4a9 0 1 . 2 1 ± 6 6 . 3 2a8 4 6 . 3 6 ± 5 6 . 6 1a6 7 3 . 1 6 ± 4 4 . 6 7a4 9 8 . 6 4 ± 5 2 . 1 3a
3 讨 论
CML是起源于造血干细胞的恶性克隆性疾病,也是临床上常见的血液恶性肿瘤,病情进展缓慢,临床表现主要为脾大、低热、乏力、盗汗、体质量减轻等。CML在各年龄段均可发病,以中年居多,且男性多于女性,一般中位生存期为3~4年,对于CML的治疗及其分子生物学研究是较为热门的方向。
CD40L主要来源于血小板、B细胞、T细胞等,可分为sCD40L和膜结合型CD40配体2种[7]。sCD40L主要来源于血小板和T淋巴细胞。sCD40L是由膜结合型CD40配体裂解而成的,相对分子质量为18×103,主要以活化三聚体的形式存在,通常认为该配体存在2个功能区:一个是赖氨酸-精氨酸-谷氨酸(KGD)序列,其与血小板糖蛋白Ⅱb/Ⅲa受体相结合;另一个是TNF同源结构域,其与CD40相结合[8]。对于sCD40L的研究多集中于肺癌、胃癌等实体瘤。刘珊等[9]将sCD40L联合长春瑞滨作用于肺腺癌A549细胞,结果发现sCD40L可抑制A549细胞的体外增殖,但不显著增加长春瑞滨诱导的细胞凋亡率,且对周期时相影响不大,推测其可能是通过凋亡及周期抑制以外的其他机制影响长春瑞滨对A549细胞的作用。但也有学者持不同观点,王天立等[10]将sCD40L作用于肺腺癌A549细胞发现,sCD40L可引起A549细胞的生长抑制、细胞周期和表型改变,并可引起部分凋亡基因表达的改变。Li等[4]将sCD40L作用于胃癌细胞株AGS和BGC-823,发现诱导细胞凋亡和细胞周期调控可能成为治疗胃癌的新手段。Aldinucci等[12]认为,sCD40L为B细胞恶性肿瘤提供了一种新的靶向治疗可能。本研究表明,各浓度的sCD40L作用24、48、72 h后,细胞增殖抑制率均较K562细胞组明显提高,差异均有统计学意义(P<0.05),以2.5 μg/mL sCD40L作用72 h抑制率最显著,提示sCD40L能够抑制K562细胞增殖,且呈剂量-时间依赖性,因此可能具有抗白血病效应。有研究表明,CD40抗原与其配体CD40L配基化作用,可促进慢性B淋巴白血病细胞的抗凋亡基因survivin mRNA表达,也有研究发现白血病细胞在CD40刺激下可分泌趋化因子IL-8、IL-12等[5,11]。
survivin是凋亡抑制蛋白家族(inhibitor of apoptosis protein,IAP)中相对分子质量最小的新成员,在正常的成熟组织中不表达或低表达。在病理状态下,survivin广泛表达于人类各种恶性肿瘤组织中,如胃癌、大肠癌、白血病和淋巴瘤等[12-13]。
本研究表明,不同浓度sCD40L作用于K562细胞24、48、72 h后,survivin mRNA表达水平较K562细胞组均降低,差异均有统计学意义(P<0.05),且以2.5 μg/mL sCD40L作用72 h时survivin mRNA表达水平最低,具有剂量-时间依赖性,说明sCD40L在体外能够抑制K562细胞增殖可能与survivin mRNA表达下调有关,这一结果与小檗碱(黄连素)和甘珀酸能减少K562细胞中survivin mRNA的表达一致[14-15]。
IL-8最初被命名为粒细胞激活因子,后被证实其性质为IL,属于CXC类趋化因子。有研究发现,IL-8在多种恶性肿瘤组织中高表达,且与肿瘤的血管形成、生长,肿瘤转移、复发等密切相关[16-17]。而本研究结果显示,sCD40L作用于K562细胞24、48、72 h后,IL-8的表达水平较K562细胞组均有所降低,差异均有统计学意义(P<0.05),以2.5 μg/mL sCD40L作用72 h时IL-8表达水平降低,且具有剂量-时间依赖性,推测sCD40L在体外能够抑制K562细胞增殖,可能与IL-8表达下调有关。
总之,不同浓度的sCD40L作用于K562细胞24、48、72 h后细胞增殖抑制率均有所上升,survivin mRNA和IL-8表达水平均有所下调,均具有剂量-时间依赖性,提示sCD40L对K562细胞增殖抑制可能与survivin mRNA及IL-8的表达下调有关,推测sCD40L有可能成为CML治疗的新思路。然而,本研究仅对体外培养的K562细胞进行研究,且实验重复次数和细胞种类有限,具有一定局限性。因此,sCD40L在体内抗CML效果如何,是否产生耐药性等诸多问题需得进一步探讨。
[1]Asiem B,Kiran R,Shweta D,et al.Current perspectives on the therapeutic aspects of chronic myelogenous leukemia[J].Expert Opin Ther Patents,2014,24(10):1117-1127.
[2]Aparna Khandelwal,Mallika Kawatra,Virendra Bhandari,et al.Imatinib resistance in chronic myelogenous leukemia:an emerging challenge[J]. Int J Basic Clin Pharmacol,2014,3(5):908-911.
[3]Fava C,Rege-Cambrin G,Saglio G.The choice of first-line chronic myelogenous leukemia treatment[J].Ann Hematol,2015,94 Suppl 2:123-131.
[4]Li R,Chen WC,Pang XQ,et al.Influence of sCD40L on gastric cancer cell lines[J].Mol Biol Rep,2011,38(8):5459-5464.
[5]Kedar R,Sabag O,Licthenstein M,et al.Soluble CD40 ligand(sCD40L)provides a new delivery system for targeted treatment:sCD40L-caspase 3 chimeric protein for treating B-cell malignancies[J].Cancer,2012,118(24):6089-6104.
[6]李杰,陈琦,任明强.sCD40L对急性髓系白血病K562细胞生物学行为的影响及机制[J].中华血液学杂志,2012,33(4):324-326.
[7]Loskog AS,Eliopoulos AG.The Janus faces of CD40 in cancer[J].Semin Immunol,2009,21(5):301-307.
[8]Law CL,Grewal IS.Therapeutic interventions targeting CD40L(CD154)and CD40:the opportunities and challenges[J].Adv Exp Med Biol,2009,647:8-36.
[9]刘珊,陈波,李燕,等.sCD40L联合长春瑞滨对肺腺癌A549细胞的作用[J].中国肺癌杂志,2010,13(7):686-689.
[10]王天立,黄建安,於葛华,等.可溶性CD40配体对肺癌A549细胞的生物学作用及其机制研究[J].中国肝癌杂志,2004,23(11):1278-1282.
[11]Kedar R,Sabag O,Licthenstein M,et al.Soluble CD40 ligand(sCD40L)provides a new deliverysystem for targeted treatment:sCD40L-caspase 3 chimeric protein for treating B-0cell malignancies[J].Cancer,2012,118 (24):6089-6104.
[12]张伟兴,潘耀东,汪美华.大肠癌组织survivin和APRIL表达临床意义探讨[J].中华肿瘤防治杂志,2014,21(19):1521-1524.
[13]Kanwar JR,Kamalapuram SK,Kanwar RK.Targeting survivin in cancer:patent review[J].Expert Opin Ther Pat,2010,20(12):1723-1737.
[14]Pazhang Y,Ahmadian S,Mahmoudian M,et al.Berberineinduced apoptosis via decreasing the survivin protein in K562 cell line[J].Med Oncol,2011,28(4):1577-1583.
[15]Moosavi MA,Moasses Ghafary S,Asvadi-Kermani I,et al.Carbenoxolone induces apoptosis and inhibits survivin and survivin-ΔEx3 genes expression in human leuke-mia K562 cells[J].Daru,2011,19(6):455-461.
[16]Matsuo Y,Ochi N,Sawai H,et al.Cxcl8/IL-8 and CXCL12/SDF-1alpha cooperatively promote invasiveness and angiogenesis in pancreatic cancer[J]. Int J Cancer,2009,124(4):853-861.
[17]李瑶,吕德官,陈德溪.IL-8及其受体药物与疾病的研究进展[J].中国药理学通报,2014,30(3):14-18.
Effect of soluble CD40 ligand on proliferation of K562 cells and expression level of survivin mRNA*
Feng Zhongxin1,WuYanmei2,Chen Qi3△,Xiao Jianhui4,Feng Jin1(1.Department of Clinical Laboratory,Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563003,China;2.Department of Geriatrics,Heze Municipal Hospital,Heze,Shandong 274031,China;3.Department of Hematology,Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563003,China;4.Guizhou Provincial Key Laboratory of Cellular Engineering,Zunyi,Guizhou 563003,China)
ObjectiveTo investigate the effect of soluble CD40 ligand(sCD40L)on the proliferation of human leukemia K562 cells and expression levels of surviving mRNA and IL-8.MethodsThe MTT assay was used to examine the effect of different concentrations of sCD40L on the cellular proliferation,RT-PCR was used to determine the expression level of survivin mRNA;ELISA was used to detect the IL-8 expression.ResultsDifferent concentrations of sCD40L(0.5,1.0,1.5,2.0,2.5 μg/mL)all had the inhibiting effect on K562 cell proliferation,moreover could decrease the expression levels of survivin and IL-8;the cellular proliferation inhibiting rate of the sCD40L cell group was higher than that of the K562 cell group,while the expression levels of surviving mRNA and IL-8 were lower than those in the K562 cell group,the difference was statistically significant(P<0.05),moreover which showed the dose and time dependent manner.ConclusionsCD40L can significantly inhibit the proliferation of K562 cells in vitro with the dose and time dependent manner,sCD40L inhibiting the K562 cell proliferation is correlated with the down-regulation of surviving mRNA and IL-8 expression.
K562 cells;Cell proliferation;Survivin gene;Interleukin-8;Soluble CD40 ligand
10.3969/j.issn.1009-5519.2016.04.001
A
1009-5519(2016)04-0481-03
贵州省社会发展攻关项目(黔科合SY字[2014]3025号)。
封忠昕(1978-),硕士研究生,主要从事恶性血液病的诊治工作。
△,E-mail:zyfychenqi@163.com。
(2015-04-21
2015-09-01)

