石墨烯及其衍生物的生物医学应用
俞淼,武洋,苏昊然,程路峰
·综述·
石墨烯及其衍生物的生物医学应用
俞淼,武洋,苏昊然,程路峰
自2004年发现石墨烯至今[1],石墨烯的相关性质开始被人们慢慢挖掘。石墨烯是由 sp2杂化连接形成的单原子层蜂窝状二维原子晶体,是世界上最薄的新型二维纳米材料,其厚度仅为 0.35 nm[2],并拥有非常高的机械性能、表面积及电传导速率,这成为石墨烯在力学、电学及光学的应用基础[3]。石墨烯应用于生物医学的主要形式是功能化石墨烯,功能化石墨烯表面含有大量的活性基团,比如羰基、羧基、羟基及环氧基等,这些基团使石墨烯具有良好的水溶性及生物相容性[4]。
近年来,人们开始关注石墨烯在分子水平的作用。本文主要从药物传递、抗菌、临床检测、生物工程这四个方面进行综述,同时对石墨烯的生物安全做了简单介绍。虽然石墨烯的毒性较低,但是当剂量较大时仍然有一定的毒性,如何解决石墨烯潜在的毒性及发挥好在分子水平的潜力是石墨烯未来发展的方向。
1 生物医学应用
1.1传递载体
1.1.1抗癌药物传递目前癌症的治疗手段主要为化疗和放疗,但是这两种治疗效果不佳且存在许多的副作用,比如恶心、呕吐、脱发等,所以寻找新型高效、低毒的治疗方法成为目前癌症治疗的焦点。石墨烯较大的比表面积和其衍生物表面丰富的官能团(环氧基、羟基、羧基)与抗癌药物结合形成的复合物通过修饰、控制颗粒的大小以及利用可透过血脑屏障等特点实现癌症药物的靶向治疗,是一个很有前景的材料[5-7]。Li 等[8]利用氧化石墨烯的高近红外吸收特点及高比表面积的特性,经过修饰获得 PEG-NGO-Pt 复合物,经老鼠尾静脉注射处理后,使用近红外光在 785 nm 处照射癌症部位 3 min 使药物在靶点释放出来,同时近红外光照射还起到了光疗的作用(图 1)。近年来,利用石墨烯结合光疗治疗癌症的研究进展如表 1 所示,这种双重治疗不仅加强了药物的治疗效果,也减小了药物的副作用。Xu 等[18]为了改善抗癌药紫杉醇的低水溶性、生物利用度差及耐药性等缺点,合成了 GO-PEG-PTX 复合物,在 MCF-7 细胞中经紫杉醇孵育 36 h 后细胞活性为 20.3%,而经GO-PEG-PTX 复合物孵育 72 h 后细胞活性降至 10.9%。修饰后的紫杉醇抗癌效果显著增强。Tang 等[19]也利用了光敏的特性,将 Cy5.5-AS1411 配体连接到氧化石墨烯上并将制备好的纳米抗癌药物包裹其中,形成 MSN-Dox@GO-Apt复合物,通过近红外光照射放热使氧化石墨烯的纳米层扩张,从而实现门控特性,防止药物在非靶点释放。Zhou等[20]应用配体与氧化石墨烯的特性同样实现了多重靶向。将 Fe3O4纳米颗粒分散在氧化石墨烯的表面和边缘,再利用 π-π 键叠加将血卟啉键合在纳米颗粒的表面,并结合光动力学治疗生成了具有细胞毒性的单线态氧,进而杀死癌细胞,这种纳米复合材料针对光动力学治疗是一个很有前景的药物传送系统。石墨烯及其衍生物用于抗癌药物的传递近年来研究的越来越多,这与石墨烯表面所赋予的各种性能是分不开的。从以上抗癌效果来看,相对于传统的化疗和放疗效果已显著提高。随着石墨烯结合光疗治疗不断被挖掘,更加完善的光疗方法用于临床已不再是梦想,但是如何进一步提高光热转换效率,及纳米材料在体内的降解是探索者们所面临的又一项挑战。
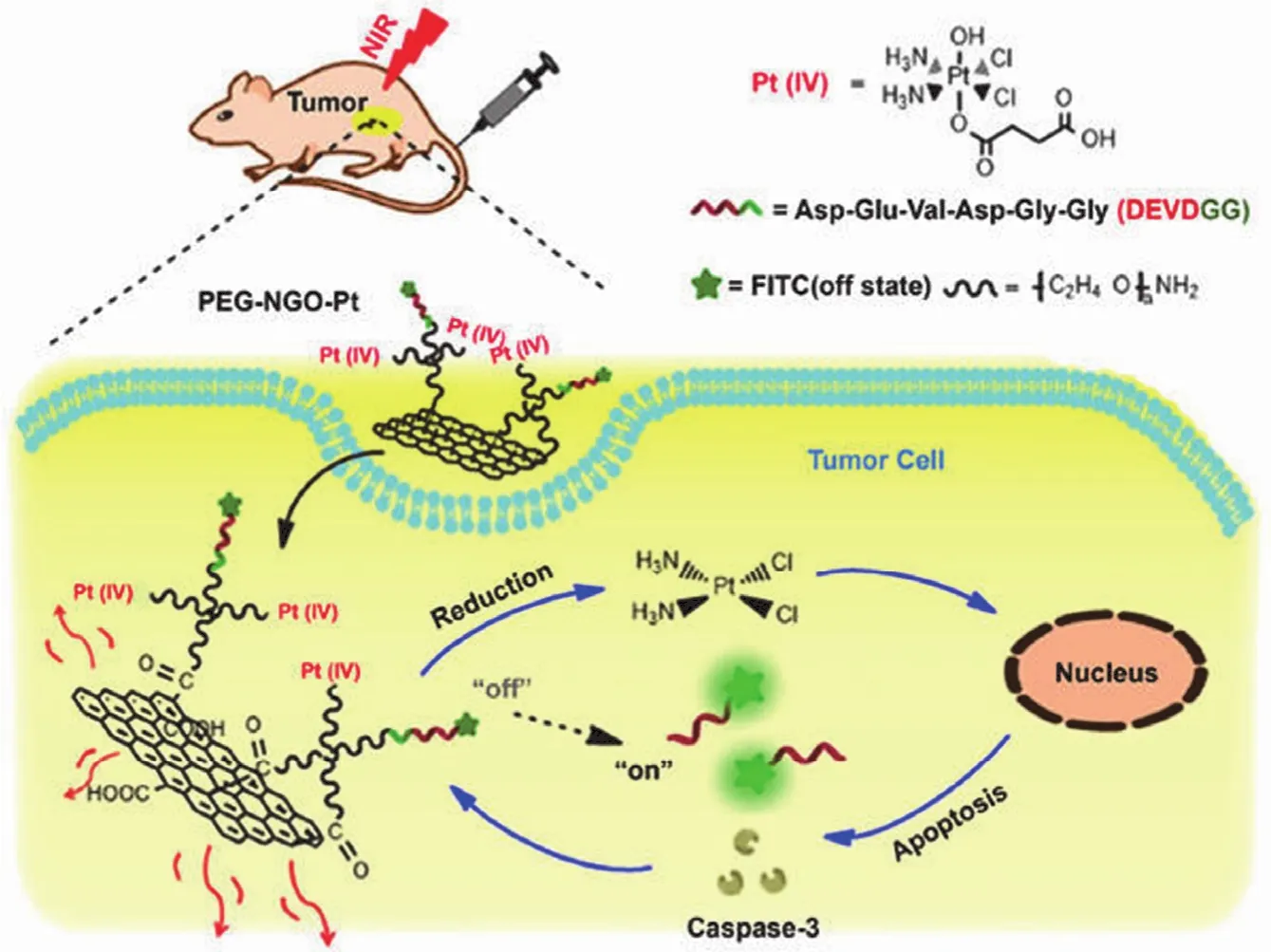
图1 PEG-NGO-Pt 复合物结合光疗治疗癌症示意图

表1 石墨烯结合光疗治疗癌症进展
1.1.2基因传递基因工程在生物医学治疗方面具有很大的前景,比如核糖核酸技术、反义技术等。但由于在治疗过程中易受各种酶的影响使其药效大大降低,为了解决此类问题,人们利用纳米材料如碳纳米管、纳米颗粒以及聚合物材料(PEI)作为基因传递的载体。由于它们可以和核酸连接,其中 PEI 更是基因传递载体的标志,Ren 等[21]利用核酸信号肽 PKKKRKV(PV7)修饰 GO-PEI,并绑定到核酸转运蛋白上形成了 GO-PEI/DNA 复合物,结果与对照组相比转运效果明显提高,并且发现 PV7 促进基因进入细胞核。但是人们逐渐发现 PEI 具有较高的细胞毒性及较低的生物相容性,所以开始探索新的基因传递载体。
近年来研究显示,石墨烯及其衍生物具有基因传递的功能。Imani 等[22]利用 octaarginine-GO(R8-GO)作为一种新型纳米基因传递载体,以 DNA 质粒表达增强绿色荧光蛋白为基因模型,研究了 R8-GO 进入细胞的能力,结果表明,R8-GO 促进了基因的分散性和生物相容性。石墨烯及其衍生物除了可以作为基因传递的载体外,Li 等[23]使用纳米氧化石墨烯薄膜绘制成条纹,经 PEI/pDNA 复合物吸附与解吸之后接种细胞,研究结果显示基因能够选择性地富集于石墨烯条纹表面,同时氧化石墨烯基底展现出了良好的生物相容性并实现了基因的缓释(图 2),这种用氧化石墨烯基底图案来调节基因的传递用于组织工程及基因治疗方向是非常重要的。利用石墨烯绘制图案的方法除了应用在基因传递,在电学、光学等方面也有报道,如用石墨烯来制作电极实现对 RNA 的传递[24-26]。石墨烯作为基因传递的载体比起传统的脂质体、聚合物凝胶、有机分散体等不仅保存了基因的完整结构,而且避免了聚合、酶降解等反应[27]。目前用于基因传递时氧化石墨烯用的较多,将来可以考虑开辟石墨烯其他衍生物方向,可为基因研究领域提供新的思路。
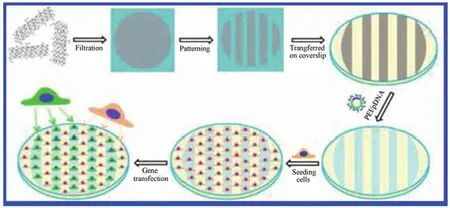
图2 石墨烯条纹基底对基因的选择性吸附
1.2抗菌
自从英国细菌学家亚历山大·弗莱明发现青霉素至今,抗菌药物的发展已基本完善,但是抗菌药也给人类带来了众多的挑战,人类滥用抗生素导致耐药性、超级细菌的产生,所以人类不得不从新的角度去发展抗菌类药物,不仅要提高抗菌效果,还要减小对人类及环境的危害。近年来,人们发现石墨烯及其衍生物与动物细胞具有很好的生物相容性,可以与细菌相互作用起到抗菌作用。Kurantowicz 等[28]在细胞壁结构不同的李斯特菌和沙门菌上试验了石墨烯及其衍生物的抗菌性能,选用石墨烯、氧化石墨烯、还原性氧化石墨烯孵育 24 h 后,测定对细菌生长的抑制能力。结果表明在高浓度(250 µg/ml)时,细菌生长都受到了抑制,而在低浓度(25 µg/ml)时只有氧化石墨烯表现出抑菌能力,经显微成像后观察到细菌黏附于材料的部位是不同的,细菌黏附于氧化石墨烯的表面,而黏附于石墨烯及还原性氧化石墨烯的边缘。虽然黏附的方式不同,但是其机制是相同的。Mangadlao 等[29]报道,抗菌作用可能是由于石墨烯及其衍生物本身的化学、物理因素而导致,其可能的机制是石墨烯锋利的边缘使细菌的细胞膜受到破坏,致使细菌细胞内物质溢出而死。而另外一方面从化学因素着手,表明可能是由于生产过剩的活性氧(ROS)、氧化脂肪酸导致脂质过氧化的连锁反应使细胞膜裂解死亡。Dallavalle 等[30]进一步从分子机制的角度去分析,这与细菌细胞膜的结构以及石墨烯表面亲水、疏水基团的分布是密切相关的。石墨烯及其衍生物除了自身与细菌作用之外,石墨烯家族还可以充当抗菌药物的载体[31-32]。
1.3临床检测
目前利用石墨烯及其衍生物来制造电化学传感器和生物传感器以提高检测性能方面已经有了很大的进步。由于石墨烯内部电子运动速率可达光速的 1/300,所以很大程度上缩短了检测的反应时间,同时其稳定的物理化学特性也可延长电极的寿命,无疑石墨烯及其衍生物是制作传感器的绝佳材料。目前石墨烯以及电极修饰的石墨烯复合材料已被提倡用于临床、环境等方面的检测,其中血糖测量用的最广泛,比起传统方法提高了检测的灵敏度[33]。Lu 等[34]利用新型氧化镍空心球-还原性氧化石墨烯电解质薄膜修饰的玻璃电极NiOHSs-RGO-NF/GCE 可以灵敏、选择性地测定葡萄糖,不仅重现性好,而且保证了电极的长期稳定性。石墨烯除了高速的电子传递外,还可以在一个广泛的波长范围内发出荧光,有效淬灭其他荧光染料的荧光,可以用于制作荧光敏感传感器,Shi 等[33]利用荧光共振能量转移联合肽修饰的石墨烯来超敏检测肉毒素 A 轻链蛋白酶活性(BoNT-LcA),BoNT-LcA 在 1 fg/ml ~ 1 pg/ml 的线性范围内可以很灵敏的检测到,其检测线为 1 fg/ml。Shi 等[35]也用相似的方法检测了金黄色葡萄球菌的 MecA 基因序列。然而值得注意的是,由于石墨烯表面的范德华力以及较强的 π-π 键作用使石墨烯发生聚集,使其表面积减小而改变电学性质[36],所以如何应用好石墨烯的优越性质仍然具有很大的挑战。
由于石墨烯在可见光以及近红外光范围内的独特光学性质,使其在生物成像方面受到了很大的关注,尤其是在活细胞内的生物成像。目前已经有许多关于利用石墨烯衍生物作为荧光探针在体内和体外生物成像的尝试。为了保护DNA 不被脱氧核糖核酸酶(DNase I)分解,Tang 等[37]将SSDNA 修饰于氧化石墨烯的表面而免于被 DNase I 水解破坏,这主要是因为空间位阻效应阻碍了 DNase I 与SSDNA 的接触,这种保护效应使 DNA 与其配体探针在活细胞内分子成像方向带来了新的希望。近年来,对于石墨烯在生物成像方面的研究逐渐偏向于石墨烯量子点,其稳定的光致发光使其成为优良的有机染料及无机量子点,另一方面由于自发荧光以及在短波长内对生物样品的光散射,可以通过选择荧光材料在长波长范围内给生物样品提供一个更深层的光透,出现更好的成像对比[38-39]。
1.4生物工程
鉴于石墨烯优越的机械性能,比如高弹性、灵活性等,人们开始探索其在生物工程领域的作用。近年来特别是在骨组织的再生和分化方面取得了重大进展,在骨组织工程中,石墨烯主要提供了一个三维的支架,给骨细胞提供了生长的微环境。Kumar 和 Chatterjee[40]通过还原氧化石墨烯和硝酸锶制备 RGO-Sr,经过进一步修饰成为 PCL/RGO-Sr 支架,与 MC3T3-E1 成骨细胞系共同培养,结果与对照组相比,成骨细胞的再生和分化都显著提高。Elkhenany 等[41]利用石墨烯作为支架促进成年山羊间充质干细胞增殖、分化为成骨细胞。随着技术的成熟,人们开始探索氧化石墨烯在其他生物工程的应用,Yang 等[42]利用基质细胞诱导老鼠的胚胎干细胞分化为多巴胺神经元,与氧化石墨烯共同培养,发现石墨烯促进老鼠胚胎干细胞的分化,因此结合其生物相容性、高稳定性,氧化石墨烯有望作为多巴胺细胞移植以及再生医学的生物材料。而石墨烯在基因工程上的应用主要是作为DNA、RNA 的传递载体。石墨烯应用于生物工程还处于初级阶段,如何利用先进的生物技术使石墨烯选择性地黏附以及定向生长、分化是未来值得探究的。
2 生物安全
自石墨烯发现至今,人们利用其优越的电学、力学、光学等性能广泛地用于药物传递、抗菌、临床检测以及生物工程,因此应用于生物体内的机会也越来越多,导致了无论是体内还是体外,人类长期暴露于纳米石墨烯及其衍生物的环境中,这不得不使人类开始关注其带来的危害。有人指出对于纳米材料,如果是静脉注射,主要积累在肝脏、肾脏、脾等部位,而暴露主要积累于肺部[43],但是无论哪种途径都不可避免给身体带来危害。Zhang 等[44]暴露 PC12 神经细胞于不同粒径的氧化石墨烯中,结果显示乳酸脱氢酶、ROS的含量都升高从而导致细胞坏死。Vallabani 等[45]在石墨烯中培养人肺脏细胞,最终细胞凋亡,凋亡程度与培养时间及石墨烯的浓度有关。近年来,人们还发现石墨烯可以损伤DNA 并且使染色体畸变[46],而石墨烯对细胞以及生物体的毒性依赖是由多方面决定的,比如尺寸大小、暴露时间、合成方法等。人类将如何控制石墨烯的毒性又是一大挑战,但是也有少数人表示石墨烯与其他纳米材料相比基本无毒,有人用 A549 细胞研究氧化石墨烯毒性时表示并没有发现石墨烯的毒性,因为石墨烯并没有进入细胞中,所以目前对石墨烯的毒性研究并没有达成一致的意见,而对于石墨烯毒性的机制研究更是众说纷纭,都是探究者们在将来需要攻克的问题。
3 总结与展望
石墨烯在生物医学应用方面虽然已经取得了一系列进展,但是目前还处于初级阶段,所面临的困难与挑战还有很多,比如如何控制功能化石墨烯由于范德华力与 π-π 键的作用在生理条件下聚集,如何控制好功能化石墨烯的纳米粒径、形貌,如何控制好纳米粒进入生物体内后与体内的生物分子的吸附以及如何控制其毒性等都需要做进一步研究。
[1] Novoselov KS, Geim AK, Morozov SV, et al. Electric field effect in atomically thin carbon films. Science, 2004, 306(5696):666-669.
[2] Lee C, Wei X, Kysar JW, et al. Measurement of the elastic properties and intrinsic strength of monolayer graphene. Science, 2008,321(5887):385-388.
[3] Pinto AM, Gonçalves IC, Magalhães FD. Graphene-based materials biocompatibility: a review. Colloids Surf B Biointerfaces, 2013,11:188-202.
[4] Barinov A, Malcioglu B, Fabris S, et al. Initial stages of oxidation on graphitic surfaces: photoemission study and density functional theory calculations. J Phys Chem C, 2009, 113(21):9009-9013.
[5] Liu J, Li Y, Li Y, et al. Noncovalent DNA decorations of graphene oxide and reduced graphene oxide toward water-soluble metal-carbon hybrid nanostructures via self-assembly. J Mater Chem, 2010, 20(5):900-906.
[6] Wang H, Gu W, Xiao N, et al. Chlorotoxin-conjugated graphene oxide for targeted delivery of an anticancer drug. Int J Nanomedicine, 2014,9:1433-1442.
[7] Liu G, Shen H, Mao J, et al. Transferrin modified graphene oxide for glioma-targeted drug delivery: in vitro and in vivo evaluations. ACS Appl Mater Interfaces, 2013, 5(15):6909-6914.
[8] Li J, Lyv Z, Li Y, et al. A theranostic prodrug delivery system based on Pt(IV) conjugated nano-graphene oxide with synergistic effect to enhance the therapeutic efficacy of Pt drug. Biomaterials, 2015,51:12-21.
[9] Yang L, Tseng YT, Suo G, et al. Photothermal therapeutic response of cancer cells to aptamer-gold nanoparticle-hybridized graphene oxide under NIR illumination. ACS Appl Mater Interfaces, 2015, 7(9):5097-5106.
[10] Nurunnabi M, Khatun Z, Reeck GR, et al. Photoluminescent graphene nanoparticles for cancer phototherapy and imaging. ACS Appl Mater Interfaces, 2014, 6(15):12413-12421.
[11] Taratula O, Patel M, Schumann C, et al. Phthalocyanine-loaded graphenenanoplatformforimaging-guidedcombinatorial phototherapy. Int J Nanomedicine, 2015, 10:2347-2362.
[12] Li Y, Liu J, Dong H, et al. Engineering of a Pluronic F127 functionalized magnetite/graphene nanohybrid for chemophototherapy. Nanotechnology, 2014, 25(6):065602.
[13] Xu C, Yang D, Mei L, et al. Targeting chemophotothermal therapy of hepatoma by gold nanorods/graphene oxide core/shell nanocomposites. ACS Appl Mater Interfaces, 2013, 5(24):12911-12920.
[14] Akhavan O, Ghaderi E. Graphene nanomesh promises extremely efficient in vivo photothermal therapy. Small, 2013, 9(21):3593-3601.
[15] Abdolahad M, Janmaleki M, Mohajerzadeh S, et al. Polyphenols attached graphene nanosheets for high efficiency NIR mediated photodestruction of cancer cells. Mater Sci Eng C Mater Biol Appl,2013, 33(3):1498-1505.
[16] Robinson JT, Tabakman SM, Liang Y, et al. Ultrasmall reduced graphene oxide with high near-infrared absorbance for photothermal therapy. J Am Chem Soc, 2011, 133(17):6825-6831.
[17] Hu Z, Li J, Huang Y, et al. Functionalized graphene/C60 nanohybrid for targeting photothermally enhanced photodynamic therapy. RSC Adv, 2015, 5(1):654-664.
[18] Xu Z, Zhu S, Wang M, et al. Delivery of paclitaxel using PEGylated graphene oxide as a nanocarrier. ACS Appl Mater Interfaces, 2015,7(2):1355-1363.
[19] Tang Y, Hu H, Zhang MG, et al. An aptamer-targeting photoresponsive drug delivery system using "off-on" graphene oxide wrapped mesoporous silica nanoparticles. Nanoscale, 2015, 7(14):6304-6310.
[20] Zhou Y, Wang Y, Zhang X, et al. Preparation and characterization of photosensitive and magnetic targeting graphene oxide nanocomposite. J Nanosci Nanotechnol, 2015, 15(3):2009-2014.
[21] Ren T, Li L, Cai X, et al. Engineered polyethylenimine/graphene oxide nanocomposite for nuclear localized gene delivery. Polym Chem, 2012, 3(9):2561-2569.
[22] Imani R, Emami SH, Faghihi S. Synthesis and characterization of an octaarginine functionalized graphene oxide nano-carrier for gene delivery applications. Phys Chem Chem Phys, 2015, 17(9):6328-6339.
[23] Li K, Feng L, Shen J, et al. Patterned substrates of nano-graphene oxide mediating highly localized and efficient gene delivery. ACS Appl Mater Interfaces, 2014, 6(8):5900-5907.
[24] Park H, Kim KH, Yoon J, et al. Fabrication of patterned flexible graphene devices via facile direct transfer of as-grown bi-layer graphene. Appl Surface Sci, 2015, 328:235-240.
[25] Yang X, Niu G, Cao X, et al. The preparation of functionalized graphene oxide for targeted intracellular delivery of siRNA. J Mater Chem, 2012, 22(14):6649-6654.
[26] Yang HW, Huang CY, Lin CW, et al. Gadolinium-functionalized nanographene oxide for combined drug and microRNA delivery and magnetic resonance imaging. Biomaterials, 2014, 35(24):6534-6542.
[27] Malmsten M. Inorganic nanomaterials as delivery systems for proteins,peptides, DNA, and siRNA. Curr Opin Colloid Interface Sci, 2013,18(5):468-480.
[28] Kurantowicz N, Sawosz E, Jaworski S, et al. Interaction of graphene family materials with Listeria monocytogenes and Salmonella enterica. Nanoscale Res Lett, 2015, 10:23.
[29] Mangadlao JD, Santos CM, Felipe MJ, et al. On the antibacterial mechanism of graphene oxide (GO) Langmuir-Blodgett films. Chem Commun (Camb), 2015, 51(14):2886-2889.
[30] Dallavalle M, Calvaresi M, Bottoni A, et al. Graphene can wreak havoc with cell membranes. ACS Appl Mater Interfaces, 2015, 7(7):4406-4414.
[31] Shao W, Liu X, Min H, et al. Preparation, characterization, and antibacterial activity of silver nanoparticle-decorated graphene oxide nanocomposite. ACS Appl Mater Interfaces, 2015, 7(12):6966-6973.
[32] Pant B, Pokharel P, Tiwari AP, et al. Characterization and antibacterial properties of aminophenol grafted and Ag NPs decorated graphene nanocomposites. Ceramics Int, 2015, 41(4):5656-5662.
[33] Shi J, Guo J, Bai G, et al. A graphene oxide based fluorescence resonance energy transfer (FRET) biosensor for ultrasensitive detection of botulinum neurotoxin A (BoNT/A) enzymatic activity. Biosens Bioelectron, 2015, 65:238-244.
[34] Lu P, Yu J, Lei Y, et al. Synthesis and characterization of nickel oxide hollow spheres-reduced graphene oxide-nafion composite and its biosensing for glucose. Sensors Actuators B, 2015, 208:90-98.
[35] Shi J, Chan C, Pang Y, et al. A fluorescence resonance energy transfer (FRET) biosensor based on graphene quantum dots (GQDs) and gold nanoparticles (AuNPs) for the detection of mecA gene sequence of Staphylococcus aureus. Biosens Bioelectron, 2015, 67:595-600.
[36] Zhang Y, Liu S, Li Y, et al. Electrospun graphene decorated MnCo2O4 composite nanofibers for glucose biosensing. Biosens Bioelectron,2015, 66:308-315.
[37] Tang Z, Wu H, Cort JR, et al. Constraint of DNA on functionalized graphene improves its biostability and specificity. Small, 2010, 6(11):1205-1209.
[38] Tan X, Li Y, Li X, et al. Electrochemical synthesis of small-sized red fluorescent graphene quantum dots as a bioimaging platform. Chem Commun (Camb), 2015, 51(13):2544-2546.
[39] Wen T, Yang B, Guo Y, et al. Organosilane-functionalized graphene quantum dots and their encapsulation into bi-layer hollow silica spheres for bioimaging applications. Phys Chem Chem Phys, 2014,16(42):23188-23195.
[40] Kumar S, Chatterjee K. Strontium eluting graphene hybrid nanoparticles augment osteogenesis in a 3D tissue scaffold. Nanoscale,2015, 7(5):2023-2033
[41] Elkhenany H, Amelse L, Lafont A, et al. Graphene supports in vitro proliferation and osteogenic differentiation of goat adult mesenchymal stem cells: potential for bone tissue engineering. J Appl Toxicol, 2015,5(4):367-374.
[42] Yang D, Li T, Xu M, et al. Graphene oxide promotes the differentiation of mouse embryonic stem cells to dopamine neurons. Nanomedicine (Lond), 2014, 9(16):2445-2455.
[43] Dinadayalane TC, Leszczynska D, Leszczynski J. Graphene:properties, biomedical applications and toxicity//Leszczynski J,Puzyn T. Towards efficient designing of safe nanomaterials:innovative merge of computational approaches and experimental techniques. Cambridge: Royal Society of Chemistry, 2012.
[44] Zhang Y, Ali SF, Dervishi E, et al. Cytotoxicity effects of graphene and single-wall carbon nanotubes in neural phaeochromocytomaderived PC12 cell. Acs Nano, 2010, 4(6):3181-3186.
[45] Vallabani NV, Mittal S, Shukla RK, et al. Toxicity of graphene innormal human lung cells (BEAS-2B). J Biomed Nanotechnol, 2010,7(1):106-107.
[46] Akhavan O, Ghaderi E, Emamy H, et al. Genotoxicity of graphene nanoribbons in human mesenchymal stem cells. Carbon, 2013, 54:419-431.
10.3969/j.issn.1673-713X.2016.04.011
国家自然科学基金青年科学基金(Y4811D405C)
830054 乌鲁木齐,新疆医科大学基础医学院(俞淼、武洋、程路峰);100049 北京,中国科学院高能物理研究所纳米材料的生物效应重点实验室(苏昊然)
苏昊然,Email:1558171505@qq.com;程路峰,Email:274188393@qq.com
2016-05-18

