体外大量扩增原发性肝癌肿瘤浸润淋巴细胞及其生物学特性的初步分析
秦鹏,柴晓菲,王昭月,买玲,高全立
·论著·
体外大量扩增原发性肝癌肿瘤浸润淋巴细胞及其生物学特性的初步分析
秦鹏,柴晓菲,王昭月,买玲,高全立
目的探讨体外大量培养扩增原发性肝癌肿瘤浸润淋巴细胞(TILs)的新方法,并初步研究其分子表型和功能特征。方法20 例手术切除的原发性肝癌组织经混合消化酶消化为单个细胞后,应用密度梯度离心法分离其中的淋巴细胞,然后应用两步培养法大量扩增 TILs,并检测它们的生长扩增速度。应用流式细胞仪检测扩增淋巴细胞的分子表型,ELISA 法检测其 IFN-γ 的分泌水平,并分析高表达 PD-1和低表达 PD-1 分子 TILs 分泌 IFN-γ 的能力。
结果18 例标本中的 TILs 在体外经两步法培养后可以扩增达到 1010数量级。扩增的 TILs 中 CD3+细胞的比例为(91.7 ± 7.4)%,CD3+CD56+细胞的比例为(28.5 ± 11.7)%,CD3+CD4+细胞的比例为(32.5 ± 19.6)%,CD3+CD8+细胞的比例为(62.5 ± 29.1)%。PD-1 分子在 CD3+CD8+细胞的比例为(23.5 ± 16.1)%。扩增的 TILs 分泌 INF-γ 的水平为(827.8 ± 307.7)pg/ml,其中 9 例 PD-1 分子低表达的 CD3+CD8+细胞的分泌 INF-γ 的水平为(1087.5 ± 249.6)pg/ml,6 例 PD-1 分子高表达的 CD3+CD8+细胞的分泌 INF-γ 的水平为(478.6 ± 69.3)pg/ml,两者相比有明显差异(P < 0.05)。
结论应用两步培养法从原发性肝癌中大量扩增 TILs 简便易行,扩增的 TILs 主要为 CD3+CD8+T 淋巴细胞,且TILs 中 PD-1 的表达与其分泌 IFN-γ 的能力呈负相关。
肿瘤浸润淋巴细胞;干扰素 γ;程序性细胞死亡受体 1;原发性肝癌
www.cmbp.net.cn中国医药生物技术, 2016, 11(4):324-328
原发性肝癌是在亚洲发病率很高的恶性肿瘤,我国肝癌发病率和死亡率是世界上最高的,占全球每年新发病例和死亡人数的 55%[1]。由于原发性肝癌起病隐匿,确诊时多已属中晚期,且患者对放疗和化疗均不敏感,因此治疗效果较差[2]。临床中发现个别肝癌患者单独应用免疫治疗后巨大肿块消失并能获得长期存活[3],提示部分肝癌对免疫治疗敏感。肿瘤浸润淋巴细胞(TILs)具有较强的特异性杀伤肿瘤细胞的能力,Klapper 等[4]首先在培养体系中应用大剂量 IL-2 将恶性黑色素瘤组织的TILs 扩增到一定数量,然后经 CD3 单抗和同种异体外周血单个核细胞刺激,将恶性黑色素瘤的TILs 扩增到 1010数量级,用于治疗进展期恶性黑色素瘤取得了超过 70% 的有效率。肝肿瘤微环境内往往浸润有大量的淋巴细胞,如能将它们扩增后回输,可能对肝癌有较好的治疗作用。本课题探讨应用两步法体外大量扩增肝癌 TILs,初步分析其分子表型和功能,为应用 TILs 治疗肝癌提供实验和技术基础。
1 材料和方法
1.1材料
20 例肝癌样本均为河南省肿瘤医院肝胆外科2009 年 11 月 - 2010 年 9 月手术切除所得,均经病理证实为肝细胞性肝癌。患者中男 13 例,女7 例,年龄 34 ~ 62 岁,平均年龄 46 岁。均在肿瘤中心取材,大小约为 2 cm × 2 cm × 2 cm;RPMI 1640 培养基为美国 Gibcobrl 公司产品;混合胶原酶(I,II,IV)、透明质酸酶、脱氧核糖核酸酶均购自美国 Sigma 公司;人 AB 血浆购自河南省中心血站;健康供者外周血单个核细胞由河南省中心血站惠赠;重组人白介素-2 购自北京四环生物制药有限公司;淋巴细胞分离液为中科院生物工程研究所产品;CD3、CD4、CD8、CD56、PD-1 以及 IgG1同型对照和 ELISA 检测 IFN-γ 试剂盒均购自美国 BD 公司。
1.2方法
1.2.1TILs 细胞的分离将手术切除的肿瘤组织立即在无菌条件下去除肿瘤表面坏死组织和结缔组织,用 RPMI 1640 漂洗并剪成约 0.5 mm × 0.5 mm × 1 mm 的小块,种瓶并用混合胶原酶(I,II,IV)、透明质酸酶和 DNA 酶 I 混合消化,37 ℃消化 3 ~ 4 h 后肿瘤组织被消化为单个核细胞,过滤并离心清洗。重新混悬离心后的沉淀并将等体积的 100% 和 75% 的淋巴细胞分离液先后置于离心管中,然后将细胞悬液慢慢加至最上层,非连续密度梯度离心 20 min(2000 r/min),收取下层界面的淋巴细胞。
1.2.2TILs 细胞的培养和扩增应用两步法扩增分离的 TILs。首先将分离出的 TILs 细胞悬浮于含有大剂量 IL-2(6000 U/ml)和 10% 人 AB 血清的 RPMI 1640 的培养基内,置于 37 ℃、5% CO2的培养箱内培养。每 3 ~ 5 天换液 1 次。当细胞总数生长至约 1 × 107个时,将其转入含有 30 ng/ml OKT3 和 2 × 108个同种异体的经辐射灭活的健康供者外周血单个核细胞(PBMC)的培养瓶内。健康供者 PBMC 辐照剂量为 50 Gy。第 2 天加入IL-2 并调整其在培养液中的浓度为 6000 U/ml。以后每 3 天计数 1 次细胞并定期传代。
1.2.3流式细胞仪检测 TILs 的分子表型流式染色 CD3、CD4、CD8、CD56 和 PD- 1,检测其在每个培养出的肿瘤浸润 T 淋巴细胞的表达。
1.2.4ELISA 检测按每孔 3 × 106个细胞的密度将培养出的淋巴细胞种入 96 孔板,24 h 后收上清,ELISA 试剂盒检测 IFN-γ 分泌量。
1.3统计学处理
两组比较用 t 检验,所有统计学处理均用SPSS17.0 软件完成。
2 结果
2.1体外 TILs 的大量扩增
应用含有大剂量 IL-2(6000 U/ml)和 10% 人AB 血清的 RPMI 1640 的培养基培养后,20 例肝癌标本中只有 1 例的 TILs 不能增殖,其余 19 例样本的 TILs 均能在体外快速扩增,但有 1 例扩增到 6.7 × 106个细胞时停止增长,其余的 18 例TILs 均能生长到 1 × 107数量级。当应用 CD3 单抗和灭活的健康供者的 PBMC 刺激培养后,18 例样本的 TILs 均能快速增殖到 1 × 109数量级,且持续增殖并最终达到 1010。每个样本均在扩增第10 天计数,结果见图 1。
2.2大剂量扩增后 TILs 的分子表型分析
18 例经两步法扩增的 TILs,经流式细胞分析后扩增的 TILs 中 CD3+细胞的比例为 91.7% ± 7.4%,CD3+CD56+细胞的比例为 28.5% ± 11.7%,CD3+CD4+细胞的比例为 32.5% ± 19.6%,CD3+CD8+细胞的比例为 62.5% ± 29.1%,图 2 为样本 5、11、17 TILs 扩增后流式细胞分析结果。

图1 18 例能快速扩增的 TILs 经过 CD3 和健康供者 PBMC 刺激10 d 时的细胞计数(N2 和 N14 扩增失败)Figure 1 The cell accounts of eighteen TILs which can be expanded rapidly after stimulated for 10 d by CD3 and healthy honers' PBMC (N2 and N14 were failed to be expanded)
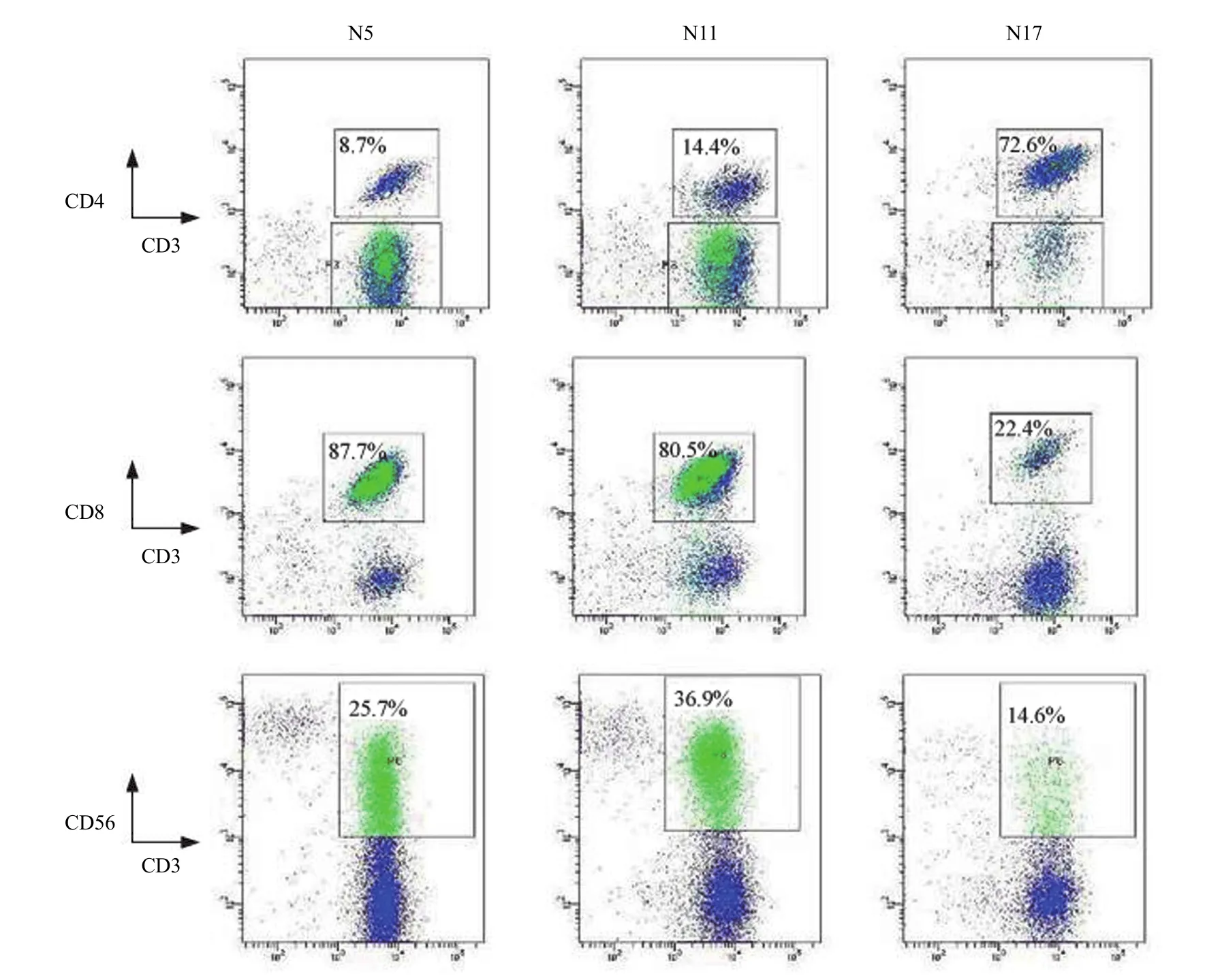
图2 流式细胞仪检测扩增 TILs 的表型(CD3、CD4、CD8、CD56 在 TILs 中的表达)Figure 2 The phenotype of expanded TILs by flow cytometry (The expression of CD3, CD4, CD8, CD56 on TILs)
2.3PD-1 在 CD3+CD8+TILs 的表达及 IFN-γ 的分泌
PD-1 分子在 CD3+CD8+细胞的比例为23.5% ± 16.1%(图 3)。扩增的 TILs 分泌 INF-γ的水平为(827.8 ± 307.7)pg/ml。
流式细胞仪检测 CD3+CD8+细胞表面可以检测到不同程度的 PD-1 的表达,为比较 PD-1 的表达程度对 TILs 细胞分泌 IFN-γ 的影响,本实验按其表达程度将这些细胞分为 PD-1 低表达组和高表达组,9 例表面表达 PD-1低于 10% 的归为低表达组,6 例表面表达 PD-1 高于 20% 的划为高表达组,另外 3 例表达在 10% ~ 20% 之间的未入组。结果见表 1,低表达 PD-1 分子的 CD3+CD8+细胞分泌 INF-γ 的水平为(1087.5 ± 249.6)pg/ml,高表达 PD-1 分子的 CD3+CD8+细胞分泌 INF-γ的水平为(478.6 ± 69.3)pg/ml,高表达 PD-1 组TILs 细胞 IFN-γ 分泌量明显少于低表达 PD-1组,两者相比有显著性差异(P < 0.05)。
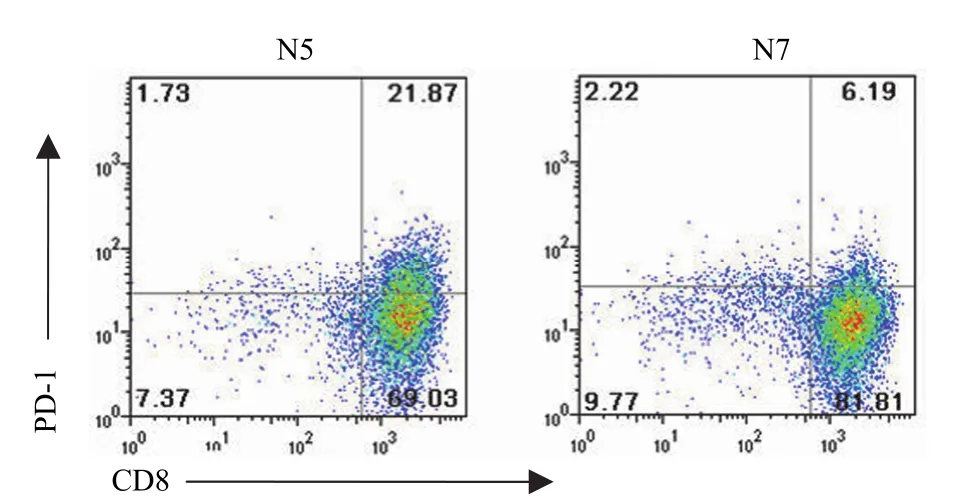
图3 流式细胞仪检测 N5 和 N7 CD3+CD8+TILs 表面PD-1 的表达Figure 3 The expression of PD-1 on N5 and N7's CD3+CD8+TILs tested by flow cytometry

表1 低表达 PD-1 组和高表达 PD-1 组CD3+CD8+细胞 IFN-γ 分泌量Table 1 The IFN-γ secretion of CD3+CD8+TILs in low PD-1 expressed group and high PD-1 expressed group
3 讨论
原发性肝癌为我国常见的恶性肿瘤之一,由于多数肝癌患者发现时已无手术机会以及肝癌细胞对化疗和放疗的不敏感,其治疗一直是一个亟待解决的难题。
肿瘤浸润淋巴细胞(TILs)回输是近年发展起来的一种抗肿瘤免疫治疗方法,如何分离培养肿瘤微环境内的 TILs 细胞并使其扩增到可以达到治疗效果的数量级一直存在一些技术和应用上的难题,且此方面的国内报道较少。
在本课题的研究过程中,通过尝试不同的培养方法,最终成功地应用两步法培养扩增切除的肝癌组织内的 TILs 细胞,使其达到 1010个数量级。两步法包括样本取回后淋巴细胞的分离和培养,以及培养一定程度后应用 CD3 和同种异体单个核细胞刺激 TILs 快速增殖。成熟的培养方法的建立给以后的试验性临床应用提供了良好的基础。
初步分析肝癌内 TILs 的分子表型发现,大部分 TILs 中以 CD8+细胞为主,而有研究发现,肝癌组织内浸润 CD8+细胞的数量与患者的预后呈正相关。也有人发现富集 CD8+细胞可以提高TILs 细胞杀伤恶性黑色素瘤细胞的功能[5],而肝癌TILs 中 CD8+细胞数量与其功能的影响仍有待进一步的研究。
实验结果还发现,在 CD3+CD8+细胞上可以检测到 PD-1 的表达,而且高表达 PD-1 组和低表达 PD-1 组其分泌 IFN-γ 的能力有明显不同,也就表示,TILs 表面 PD-1 的表达可以影响 TILs的功能。曾有人研究过恶性黑色素瘤内浸润 T 淋巴细胞表面 PD-1 的表达和功能的影响,结果证明肿瘤内浸润的肿瘤抗原特异性的 CD8 细胞高表达PD-1 且功能受损[6]。而本次实验则发现在肝癌TILs 内高表达 PD-1 的 CD3+CD8+细胞其功能也受到影响,分泌 IFN-γ 的能力减弱。
PD 是 I 型跨膜蛋白,属于免疫球蛋白超家族CD28/CTLA-4 亚家族成员。人 PD-1 基因位于2q37,在正常状态下 T、B 细胞不表达,但在活化状态下诱导高表达。PD-1 和 TCR(T 细胞受体)结合可导致 SHP-2 的迅速磷酸化而抑制 TCR 信号,进而传递负性信号,在外周免疫耐受的建立中有重要作用[7]。而 PD-1 如何通过通路传递信号影响肝癌 TILs 中 CD8+细胞的功能为下一步研究的重点。
[1] Bosch FX, Ribes J, Cléries R, et al. Epidemiology of hepatocellular carcinoma. Clin Liver Dis, 2005, 9(2):191-211.
[2] El-Serag HB. Hepatocellular carcinoma. N Engl J Med, 2011, 365(12):1118-1127.
[3] Giglia JL, Antonia SJ, Berk LB, et al. Systemic therapy for advanced hepatocellular carcinoma: past, present, and future. Cancer Control,2010, 17(2):120-129.
[4] Klapper JA, Thomasian AA, Smith DM, et al. Single-pass,closed-system rapid expansion of lymphocyte cultures for adoptive cell therapy. J Immunol Methods, 2009, 345(1-2):90-99.
[5] Prieto PA, Durflinger KH, Wunderlich JR, et al. Enrichment of CD8+ cells from melanoma tumor-infiltrating lymphocyte cultures reveals tumor reactivity for use in adoptive cell therapy. J Immunother, 2010,33(5):547-556.
[6] Ahmadzadeh M, Johnson LA, Heemskerk B, et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood, 2009, 114(8):1537-1544.
[7] Schmidt N, Flecken T, Thimme R. Tumor-associated antigen specific CD8+ T cells in hepatocellular carcinoma - a promising target for immunotherapy. Oncoimmunology, 2014, 3(9):e954919.
【Abstract】
ObjectiveTo explore a new method that can generate large scale tumor infiltrating lymphocytes (TILs) suitable for clinical use,and to analyze their molecular phenotype and biological function.
MethodsSingle cells were obtained by digesting freshly resected tumors of twenty hepatoma patients with mixed collagenase, and lymphocytes were then separated by the discontinuous density gradient centrifugation. TILs were expanded by two-step culturemethod. Molecular phenotype of generated TILs was tested by flow cytometry and the quantitation of IFN-γ secretion was detected by ELISA essay. The ability to secret IFN-γ from PD-1 high expressed TILs and PD-1 low expressed TILs was analysed afterwards.
ResultsThere were eighteen TILs samples reaching the 1010order of magnitude through two-step culture method. The proportion of CD3+TILs, CD3+CD56+TILs, CD3+CD4+TILs and CD3+CD8+TILs was (91.7 ± 7.4)%, (28.5 ± 11.7)%, (32.5 ± 19.6)% and (62.5 ± 29.1)%, respectively. The proportion of PD-1 expression in CD3+CD8+TILs was (23.5 ± 16.1)%. The quantitation of IFN-γ secretion in the expanded TILs was (827.8 ± 307.7) pg/ml, among which this IFN-γ values in six higher expressed PD-1 cases and nine lower expressed PD-1 cases of CD3+CD8+TILs were (478.6 ± 69.3) pg/ml and (1087.5 ± 249.6) pg/ml, respectively. The differences between these two groups had statistically significance (P < 0.05).
ConclusionIt is easy to expand TILs from primary hepatocarcinoma to a large scale number for clinical use by using the two-step culture method and the major population of the expanded TILs is CD3+CD8+T cells. In addition, the expresson of PD-1 in TILs are negatively correlated with its secretion of IFN-γ.
Author Affiliation: Cancer Biotherapy Department, The Affiliated Cancer Hospital of Zhengzhou University, Zhengzhou 450008,China
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):324-328
Large scale amplication of the tumor infiltrating lymphocytes from primary hepatocarcinoma ex vivo and analysis of their biological characteristics
QIN Peng, CHAI Xiao-fei, WANG Zhao-yue, MAI Ling, GAO Quan-li
Lymphocytes, tumor-infiltrating;Interferon-gamma;Programmed cell death 1 receptor;Primary hepatocarcinoma
GAO Quan-li, Email: quanligao1@aliyun.com
10.3969/j.issn.1673-713X.2016.04.007
国家自然科学基金青年基金(81502468)
450008 郑州大学附属河南省肿瘤医院生物治疗中心
高全立,Email:quanligao1@aliyun.com
2016-02-22

