破伤风类毒素原液质量分析方法的研究
夏德菊,谭亚军,田霖,王珣,马霄,肖詹蓉
·论著·
破伤风类毒素原液质量分析方法的研究
夏德菊,谭亚军,田霖,王珣,马霄,肖詹蓉
目的建立对破伤风类毒素原液进行质量分析的分子排阻色谱方法和聚丙烯酰胺凝胶电泳方法。
方法分别建立分子排阻色谱方法和聚丙烯酰胺凝胶电泳方法对破伤风类毒素原液单体和聚体含量进行分析,并对两种方法的关键影响因素及两种方法检测结果进行评价分析。结果以含 1% 异丙醇的 pH 7.0,0.2 mol/L 磷酸盐缓冲液为流动相,选取 TSK-GEL G3000SWxl 色谱柱,可以对破伤风类毒素单体、二聚体和多聚体分离,经配套软件分析得到其三个组分的相对含量;选用实验室自配的 10% 浓度的分离胶对破伤风类毒素原液进行电泳后经 Image Lab 软件分析可以对破伤风类毒素原液的单体和聚体进行纯度分析,两种方法检测结果具有可比性。
结论建立的两种检测破伤风类毒素原液单体和聚体含量的方法能够对所含单体、二聚体和多聚体进行分离和定量,两种方法相辅相成,可以对生产的破伤风类毒素原液批间一致性进行监控和用于不同目的的破伤风类毒素质量情况进行监督。
破伤风类毒素;电泳,聚丙烯酰胺凝胶;分子排阻色谱;单体;二聚体;多聚体
www.cmbp.net.cn中国医药生物技术, 2016, 11(4):333-339
破伤风疫苗作为常规计划免疫品种已广泛应用到婴幼儿和适宜人群的预防接种,其生产工艺也一直沿用传统的技术:即培养细菌收获其毒素,毒素经甲醛脱毒、精制或精制后经甲醛脱毒制成类毒素,再和铝佐剂吸附制成成品。因此破伤风类毒素(tetanus toxoid,TT 或 TTd)的制备是此疫苗的基础。近年来,随着国内外细菌性结合疫苗的发展,破伤风类毒素作为载体蛋白质的应用也得到加强[1-3]。但有文献报道,破伤风类毒素的制备过程中,甲醛脱毒处理会导致蛋白结合物的产生,因为在毒素的解毒过程中,脱毒剂与毒素分子,蛋白胨和培养基中的其他蛋白分子反应[4]。这些反应的结果导致三种形式的交联,产生三种类型的产物,即①一个毒素分子内的交联,仍是单体,但是分子结构发生改变;②毒素分子之间的交联,形成二聚体或多聚体;③毒素分子与培养基中的肽或杂蛋白交联[5]。目前各厂家的生产工艺和脱毒工艺也存在一些差别:如脱毒和精制顺序不一致,脱毒方法和脱毒剂不一致,这些差别也加大了不同厂家之间的破伤风类毒素原液的质量差异。
破伤风类毒素作为结合疫苗的载体蛋白应以分子质量相对较小的 TT 单体纯化蛋白为首选,而作为预防破伤风的 TT 抗原需要综合考虑抗原分子的免疫原性和聚合体引起的致敏性[6-11]。因此,对破伤风原液的单体和聚体含量的分析就显得尤其重要了,《中国药典》2015 年版对破伤风类毒素原液列出的检测项目只有絮状单位测定、pH 值、纯度、无菌检查、特异性毒性检查和毒性逆转试验,因此有必要对各个厂家生产的原液进一步用生化和免疫学方法对其单体和聚体含量进行分析,以保证用于不同目的的破伤风类毒素原液有明确的单体和聚体含量,并确保疫苗原液的批间一致性,保持足够的免疫原性和安全性。
本文拟建立分子排阻色谱(size exclusion chromatography,SEC)方法和聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)方法对破伤风类毒素原液的单体和聚体含量进行分析,以为国产破伤风类毒素原液的质量稳定性研究提供方法学基础。
1 材料与方法
1.1材料
1.1.1TT 原液由北京天坛生物制品股份有限公司菌苗室提供。
1.1.2凝胶过滤蛋白Marker 试剂盒(货号MWGF1000)购自美国 Sigma 公司,所用标准蛋白为标准品 1:转铁蛋白(443 kD)、标准品 2:乙醇脱氢酶(150 kD)和标准品 3:葡聚糖蓝(66 kD)。
1.1.3主要试剂及仪器甲叉双丙烯酰胺、丙烯酰胺、SDS、三羟甲基氨基甲烷(Tris)、过硫酸钠、甘氨酸、TEMED 为美国 Amresco 公司产品;考马斯亮蓝 R250、磷酸二氢钠、磷酸氢二钠等试剂均为国产分析纯试剂;预染蛋白 marker 购自赛默飞公司;10% 浓度预制电泳胶和电泳仪为美国Bio-Rad 公司产品;凝胶成像系统 ImageMaster VDS 为美国 GE Healthcare 产品;高效液相色谱仪为岛津 LC-20A 公司产品;TSK-GEL G3000SWxl色谱柱为日本 Tosoh 公司产品;Agilent SEC-3 色谱柱为安捷伦公司产品。
1.2方法
1.2.1分子排阻色谱方法的建立
1.2.1.1色谱条件的确定参照《中国药典》三部(2015 年版)通则中“分子排阻色谱方法”的一般要求,并参考“人免疫球蛋白类制品 IgG 单体加二聚体测定法”,确定本方法的色谱条件。
1.2.1.2色谱柱的比较按照确定的色谱条件,分别用 TSK-GEL G3000SWxl 和 Agilent SEC-3两种色谱柱对 TT 原液进行分析,比较两者的分离效果。
1.2.1.3确定 TT 保留时间用确定的色谱条件和色谱柱对蛋白标准品和 TT 原液分别进行分析,从标准品保留时间和 TT 蛋白分子量(150 kD)确定 TT 单体、二聚体、多聚体的保留时间。
1.2.1.4TT 原液单体和聚体含量分析按照确定的分子排阻色谱方法和确定的各组分保留时间,对 7 批 TT 原液分析后运用岛津液相系统配套分析软件,按照面积归一法,对每一样品的单体、二聚体和多聚体相对含量进行计算。
1.2.2SDS-PAGE 方法的建立
1.2.2.1电泳条件的确定参照《中国药典》三部(2015 年版)通则中“SDS-PAGE 凝胶电泳法”的一般要求,确定本方法的电泳条件。
1.2.2.2分离胶浓度的选择按照确定的电泳条件,选用了 10% 和 8% 两个浓度的分离胶,比较其对破伤风原液的分离效果。
1.2.2.3不同来源电泳胶的比较选用了实验室自配的 10% 浓度分离胶和商业购买的 10% 分离胶,比较其对破伤风原液的分离效果。
1.2.2.4TT 原液单体和聚体含量分析电泳胶脱色完成后用凝胶成像仪及 Image Lab 软件对每一批样品所含单体、二聚体和多聚体相对含量进行计算。
2 结果
2.1分子排阻色谱方法的建立
2.1.1色谱条件用岛津高效液相层析系统,以含 1% 异丙醇的 pH 7.0,0.2 mol/L 磷酸盐缓冲液为流动相,检测波长 280 nm,流速为 0.6 ml/min,上样量 10 μl,分析时间 30 min,记录色谱图。
2.1.2色谱柱的选择从图 1 两种色谱柱的重叠色谱图可以看出 TSK-GEL G3000SWxl 色谱柱对 TT 单体、二聚体和多聚体的分离效果要优于Agilent SEC-3 色谱柱。因此,选取 TSK-GEL G3000SWxl 色谱柱作为本方法的分析色谱柱。

图1 Agilent SEC-3 色谱柱(A)和 TSK-GEL G3000SWxl色谱柱(B)对 TT 原液的分离色谱图Figure 1 Separation chromatogram of TT liquid by Agilent SEC-3 column (A) and TSK-GEL G3000SWxl column (B)
2.1.3TT 原液中单体和聚体保留时间的确定结合 TT 蛋白分子量和凝胶过滤蛋白 marker试剂盒中三个标准品及 TT 原液的图谱分析,可确定 TT 单体、二聚体和多聚体的保留时间,即确定其特征吸收峰(图 2)。
2.1.4TT 原液单体和聚体含量分析结果7 批TT 原液液相重叠图谱见图 3,经计算其单体、二聚体和多聚体相对含量见表 1。
2.2SDS-PAGE 分析结果
2.2.1电泳条件的确定应用 Bio-Rad 垂直电泳仪,上样缓冲液中不含 DTT,所有样品上样体积为 20 μl/孔。电泳开始时设置电压为 80 V,样品进入分离胶后电压设为 120 V,待溴酚蓝到达分离胶底部时停止电泳。然后将凝胶浸泡于考马斯亮蓝染液中染色 3 h,最后经脱色液脱色直至背景无色后观察,和标准蛋白 marker 比对,破伤风原液单体、二聚体和多聚体的条带对应位置如图 4 所示。
2.2.2分离胶浓度的确定从图 5 可以得出 8%分离胶跑出的电泳图中各条带更弥散,而 10% 分离胶的电泳图各条带聚合效果好,分离度也较好,更易于最后软件的分析,因此本方法选用 10% 分离胶对破伤风原液进行分析。
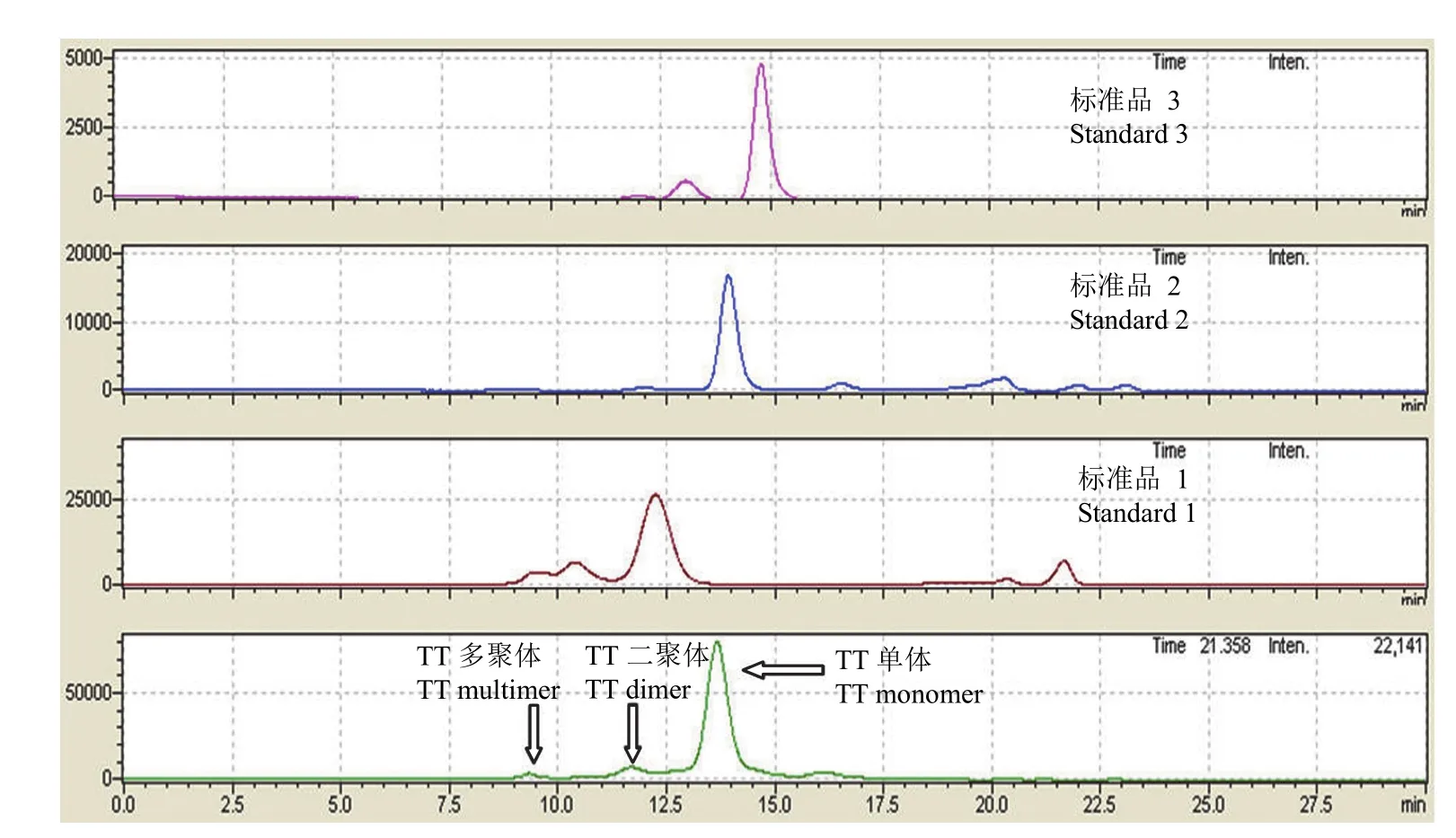
图2 标准品和 TT 原液的分离色谱图Figure 2 Standard and TT liquid separation chromatogram

图3 7 批 TT 原液色谱图Figure 3 Chromatogram of seven batches TT liquid

表1 7 批 TT 原液单体、二聚体和多聚体相对含量(%)Table 1 The monomers, dimers and multimers relative content of seven batches TT liquid (%)

图4 TT 原液 SDS-PAGE 分析Figure 4 SDS-PAGE analysis of TT liquid
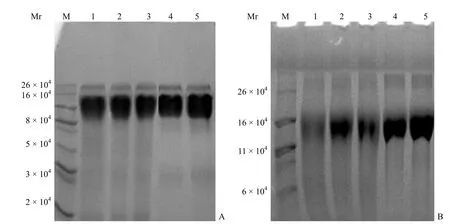
图5 TT 原液在不同浓度分离胶上的 SDS-PAGE 分析(A:10% 浓度分离胶;B:8% 浓度分离胶)Figure 5 SDS-PAGE separating analysis of TT liquid at different concentration gels (A: 10% separating gel; B: 8% separating gel)
2.2.3电泳胶来源的比较从图 6 可以看出实验室自配胶对二聚体的聚合效果要优于商业购买的胶,因此本方法最终选用实验室自配的电泳胶。
2.2.4TT 原液单体和聚体含量分析结果7 批TT 原液电泳图谱如图 7 所示,经计算其单体、二聚体和多聚体相对含量见表 2。
3 讨论
TT 作为单价或吸附百白破疫苗的主要成分已广泛用于婴幼儿及适宜人群的预防接种,其安全性已得到普遍认可,但是接种破伤风疫苗后的过敏反应一直都有报道[9-12]。破伤风毒素用甲醛脱毒过程中会出现蛋白聚集现象,一般是大分子蛋白的免疫原性要优于小分子蛋白,但过量的大分子蛋白可能会使机体出现致敏现象,但目前并没有统一方法对破伤风类毒素原液的单体和聚体含量进行检测。
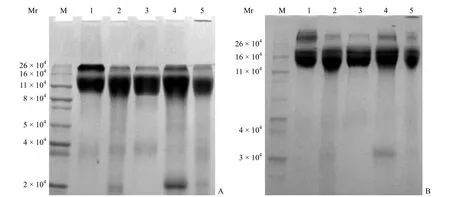
图6 TT 原液在不同来源电泳胶上的 SDS-PAGE 分析(A:实验室自配胶;B:商业购买预制胶)Figure 6 SDS-PAGE separating analysis of TT liquid on different sources gels (A: Gel prepared in laborarory; B: Gel purchased from market)
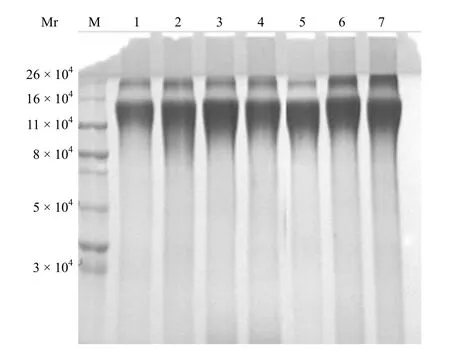
图7 7 批 TT 原液电泳图谱Figure 7 Electrophoresis chart of seven batches TT liquid

表2 7 批 TT 原液 SDS-PAGE 方法检测单体、二聚体和多聚体含量(%)Table 2 The monomers, dimers and multimers relative content detected by SDS-PAGE method of seven batches TT liquid (%)
本研究建立了分子排阻色谱方法和聚丙烯酰胺凝胶电泳方法对破伤风类毒素原液的单体和聚体含量进行检测。研究结果显示,两种方法都能对破伤风原液的单体、二聚体和多聚体进行分离,从检测结果来看,电泳方法对 TT 原液中单体的检测结果要普遍高于分子排阻方法,这可能有以下几个原因:首先,SDS-PAGE 方法的灵敏度不如分子排阻色谱方法,有些样品所含聚体和杂质含量比较少,电泳方法并未检测出;其次,破伤风毒素在纯化脱毒过程中,可能产生了一些小肽片段,或者是一些核酸类和肽聚糖类物质未除去,导致色谱系统的紫外分光光度计有信号记录而电泳方法无法显示出条带,最后,脱毒剂对破伤风毒素的处理过程导致破伤风类毒素原液的电泳图谱出现拖尾,背景较深,这影响了 Image Lab 软件对电泳图谱的分析。所以,分子排阻方法应该是结果相对精确的一种方法,但是相比较而言,SDS-PAGE 方法更简单易行,结果直观可靠,7 批样品检测结果的总体趋势是可以和分子排阻方法对应的,若实验室不具备高压液相层析系统,可以选择 SDS-PAGE 方法对破伤风原液脱毒后单体和聚体含量进行检测,具备条件的实验室,可以选用这两种方法分别进行检测,以使检测结果更直观可靠。
综上所述,本文建立的两种检测 TT 原液单体和聚体含量的方法能够对所含单体、二聚体和多聚体进行分离和定量,两种方法相辅相成,可以对生产的破伤风类毒素原液批间一致性进行监控和用于不同目的的破伤风类毒素质量情况进行监督。后续系列工作首先将进一步对影响电泳方法的因素进行分析,即对分子排阻方法保留时间较长的峰进行回收鉴定;然后还要对破伤风类毒素原液中不同分子质量的成分进行免疫学分析,为以破伤风类毒素为载体或联合的疫苗的安全性和免疫原性提供更多研究数据。
[1] Tontini M, Berti F, Romano MR, et al. Comparison of CRM197,diphtheria toxoid and tetanus toxoid as protein carriers for meningococcal glycoconjugate vaccines. Vaccine, 2013, 31(42):4827-4833.
[2] WHOExpertCommitteeonBiologicalStandardization. Recommendations to assure the quality, safety and efficacy of pneumococcalconjugatevaccines.Geneva:WorldHealth Organization, 2009 [2016-01-29]. http://www.who.int/biologicals/ areas/vaccines/pneumo/Pneumo_final_23APRIL_2010.pdf?ua=1.
[3] Centers for Disease Control and Prevention (CDC). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis (Tdap) vaccine from the Advisory Committee on Immunization Practices, 2010. MMWR Morb Mortal Wkly Rep,2011, 60(1):13-15.
[4] Aggerbeck H, Heron I. Detoxification of diphtheria and tetanus toxin with formaldehyde. Detection of protein conjugates. Biologicals, 1992,20(2):109-115.
[5] Relyveld EH, Henocq E, Bizzini B. Studies on untoward reactions to diphtheria and tetanus toxoids. Dev Biol Stand, 1979, 43:33-37.
[6] Vesikari T, Wysocki J, Chevallier B, et al. Immunogenicity of the 10-valent pneumococcal non-typeable Haemophilus influenza protein D conjugate vaccine (PHiD-CV) compared to the licensed 7vCRM vaccine. Pediatric Infect Dis J, 2009, 28(4 Suppl):S66-S76.
[7] Gross S, Janssen SW, de Vries B, et al. Collaborative study for the validation of alternative in vitro potency assays for human tetanus immunoglobulins. Biologicals, 2010, 38(4):501-510.
[8] Montecucco C, Schiavo G. Structure and function of tetanus and botulinum neurotoxins. Q Rev Biophys, 1995, 28(4):423-472.
[9] Peng XB. The development history of tetanus toxoid, current situation and research progress of new type tetanus vaccine. Prog Microbiol Immunol, 1997, 25(2):54-56. (in Chinese)
彭祥兵. 破伤风类毒素的发展历史、现状和新型破伤风疫苗的研究进展. 微生物学免疫学进展, 1997, 25(2):54-56.
[10] Hao MY. Joint DPT vaccine cause allergic reactions in 1 case. Chin J Vaccines Immunization, 2005, 11(5):342. (in Chinese)
郝美莹. 接种百白破联合疫苗致超敏反应 1例. 中国计划免疫,2005, 11(5):342.
[11] Duan XY, Chen SJ, Zhou RG, et al. The DPT vaccine Arthus reaction in 1 case. China Rural Health, 2013, (6):61. (in Chinese)
段旭云, 陈少军, 周荣光, 等. 接种百白破疫苗致Arthus反应1例.中国农村卫生, 2013, (6):61.
[12] Deng ZH, Zeng HS. Report one case about DTP vaccine allergies caused hands redden swelling itching 36 days and review of literature. J Qiqihar Univ Med, 2012, 33(15):2052-2054. (in Chinese)
邓朝晖, 曾海生. 百白破疫苗过敏致双手发红肿胀瘙痒36天1例并文献复习. 齐齐哈尔医学院学报, 2012, 33(15):2052-2054.
【Abstract】
ObjectiveTo establish size exclusion chromatography (SEC) method and polyacrylamide gel electrophoresis (SDS-PAGE) method for quality analysis of tetanus toxoid (TT) bulk.
MethodsSEC method and SDS-PAGE method were established to analyze the monomer and polymer contents of tetanus toxoid,furthermore, the key factors and results of the two methods were evaluated.
ResultspH 7.0, 0.2 mol/L phosphate buffer containing 1% isopropanol was selected as the mobile phase and TSK-GEL G3000SWxl column, TT monomers, dimers and multimers were separated, and then the three components of TT were obtained by supporting software analysis. TT also were separated after electrophoresis by choosing 10% concentration of gel preparing by our own laboratory software.
ConclusionThe dimers and multimers of TT are separated and quantified by the established two methods, and the two methods complement each other. They are used to monitor the consistency of different batches of tetanus toxoid and supervise the quality of tetanus toxoid.
Author Affiliations: Beijing Tiantan Biological Products Co.,Ltd., Beijing 100176, China (XIA De-ju, WANG Xun, XIAO Zhan-rong); National Institutes for Food and Drug Control, Beijing 100050, China (TAN Ya-jun, TIAN Lin, MA Xiao)
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):333-339
Study on quality analysis method for tetanus toxoid
XIA De-ju, TAN Ya-jun, TIAN Lin, WANG Xun, MA Xiao, XIAO Zhan-rong
Tetanus toxoid;Electrophoresis, polyacrylamide gel;Size exclusion chromatography;Monomer;Dimer;Multimers
TAN Ya-jun, Email: tyj.tyj@163.com
10.3969/j.issn.1673-713X.2016.04.009
100176 北京天坛生物制品股份有限公司(夏德菊、王珣、肖詹蓉);100050 北京,中国食品药品检定研究院(谭亚军、田霖、马霄)
谭亚军,Email:tyj.tyj@163.com
2016-02-22

