“离子反应”教学设计
□吴振兴
“离子反应”教学设计
□吴振兴
“离子反应”这一节是“化学物质及其变化”这一章的核心和基础,直接关系到后续相关内容的教学,因此,如何教好、学好这一节至关重要。在教学过程中,教师应通过转变教学思维,强化实验操作,注重要点分析,加强习题巩固等途径,更好地化抽象为具体,让学生更加生动、形象地去认识离子,学透离子反应,从而提高学习效率,提升学以致用的能力。
离子反应;课堂教学;实验教学
一、教材依据
本节课选自人教版高中化学必修一第二章 “化学物质及其变化”的第二节 “离子反应”第二课时 (P31~P33)。
二、教材分析
离子反应是中学阶段学习的重要化学用语及化学基本概念,贯穿于中学化学教材的始终,也是中学化学教学的重点和难点之一。在教学中,教师要把握讲授知识的深广度,明确不同阶段学生应学习哪些内容,讲到何种程度。在人教版教材中,“离子反应”的内容分散在必修1和选修4化学反应原理中,在必修教材中,只要求学生知道强酸、强碱、盐在水溶液中可以发生电离,及离子反应发生的条件和离子方程式的书写,而难度较大的强、弱电解质的概念及弱电解质的电离安排在化学反应原理中,这种螺旋式上升的知识体系符合学生的认知规律。
三、学情分析
知识方面:已经初步掌握了分类的方法、水溶液中发生复分解反应的条件、酸碱盐在水溶液中能发生电离以及主要存在形式、电解质与非电解质的概念,但对溶液中的复分解反应的理解存在一定的局限性。
能力方面:高一学生经过初三以及前面的学习,具有自己的学习方法、学习方式以及思考问题的方式。
心理方面:高一学生具有强烈的好奇心,喜欢在化学实验中去探索,但还需要教师进行相关理论指导。
四、设计理念
本节课主要围绕以下几个方面进行教学设计:①通过创设问题情境、实验环节使学生对科学探究保持浓厚的兴趣,从而更好地落实教学目标,并提高学生运用知识分析、解决问题的能力,体会化学知识的价值。②创新教师的教学方式和学生的学习方式,营造良好的师生关系,设计多样化的学习活动,实现师生之间真正的互动。要求学生通过观察实验现象,进行归纳总结,最终得出结论。
五、教学目标
1.知识与技能:①构建离子反应的概念,理解离子方程式的意义。②了解离子反应的发生条件。③能判断离子反应的发生。④能逐步写出常见反应的离子方程式。⑤能根据离子方程式写出化学方程式。
2.过程与方法:通过实验探究,培养学生主动构建概念的能力,体验溶液中的反应的分析、离子反应概念构建的过程及研究的思维方法。
3.情感态度与价值观:学生通过实验、对比、探究、讨论等过程,养成良好的科学探究精神和严谨的科学态度。
六、教学重难点
重点:理解离子反应、离子方程式概念及掌握离子方程式的书写方法。
难点:离子反应的本质以及离子方程式的意义。
七、教法、学法
1.实验探究法:通过学生动手实验,观察实验现象,认识到水溶液中发生的化学反应实质上是离子之间的反应。
2.“问题式”教学法:通过问题引导,让学生积极思维,主动参与教师的教学,设计一系列层层递进的问题,引导学生探究、讨论,提高学生分析问题和解决问题的能力。
3.归纳法:学生通过对水溶液中发生的化学反应的探究、讨论、归纳,最终掌握离子反应发生的条件及离子方程式的书写方法。
八、教学设计
1.新课引入
教师活动:
【复习回顾】上节课我们已经学习了电解质的概念,知道电解质在水溶液中能够发生电离,并学习了用电离方程式表示电解质电离成阴阳离子的过程。
问题1:
①电解质在溶液中主要是以何种状态存在的?
②写出下列电解质在水中的电离方程式。
A.CuCl2B.Na2SO4C.NaOHD.HCl
③完成上述电离方程式并写在黑板上作副板书。
2.观察实验,探究讨论
教师活动:
问题2:请判断下述四个反应能否发生,为什么?①向硫酸钠溶液中滴加氯化钾溶液;②向硫酸钠溶液中滴加氯化钡溶液;③向碳酸钠溶液中滴加稀盐酸;④向氢氧化钠溶液中滴加稀盐酸。
问题3:各小组通过实验探究验证四组物质在水溶液中能否发生反应。
学生活动:
学生回答哪几个反应可以发生,并说出原因;学生分组进行实验,观察实验现象,完成表格的内容,写出对应的化学方程式。
设计意图:培养学生的实验动手能力和观察能力,培养学生之间的合作精神。
3.运用知识,拓展探究
第一环节
教师活动:
讲解:我们现在用电离理论来探讨反应的实际过程,先讨论反应硫酸钠与氯化钾溶液:根据电解质在溶液中的主要存在形式,写出反应前后电解质在溶液中存在的状态。
[副板书]
Na2SO4+2KCl=2NaCl+K2SO4
2Na++SO42-+2K++2Cl-=2Na++2Cl-+2K++SO42-
我们再讨论氯化钡溶液与硫酸钠溶液的反应,化学方程式如下:
Na2SO4+BaCl2=BaSO4↓+2NaCl
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
反应的实质:SO42-+Ba2+=BaSO4↓
问题4:对比第一个实验和第二个实验反应前后溶液中的变化。
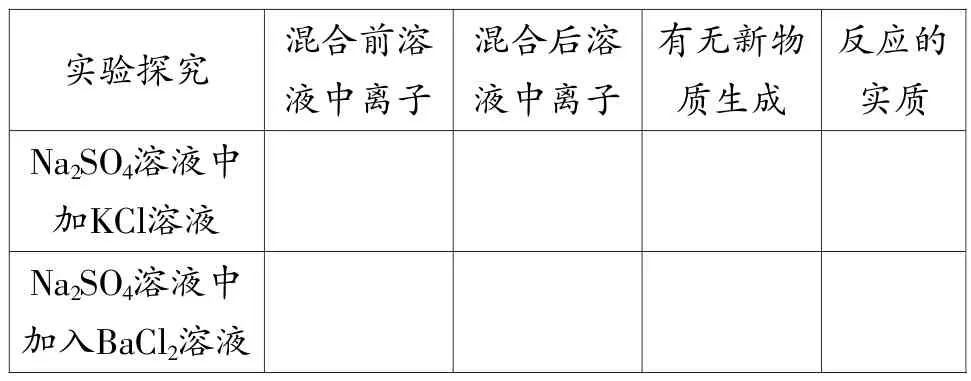
实验探究 混合前溶液中离子混合后溶液中离子有无新物质生成反应的实质Na2SO4溶液中加KCl溶液Na2SO4溶液中加入BaCl2溶液
【小结】氯化钡溶液与硫酸钠溶液反应是以离子进行的,反应的实质是Ba2+与SO42-进行了反应,而Na+与Cl-都未参加反应。离子之间的化学反应叫作离子反应,用来表示离子反应的式子叫离子方程式。
第二环节
教师活动:
【板书】离子反应:有离子参加的反应 (或在水溶液中发生的有电解质参加的反应)。
问题5:离子反应有什么特点?
【板书】离子反应特点:
①反应是在溶液中进行的。
②反应物是以离子形式存在并参加反应。
③有沉淀、气体、水等新物质生成。
第三环节
教师活动:
问题6:①给离子方程式下定义;②对照化学方程式,说明离子方程式的特性。
【板书】离子方程式:①定义:用实际参加反应的离子符号来表示反应的式子。②特点:表示了反应的实质,更简明。
【板书】离子方程式的书写步骤:
①写:写出化学方程式。
②拆:将易溶于水且易电离物质写成离子形式。
③删:将不参加反应的离子 (等式两边相同的离子)删除。
④查:检查离子方程式:最简,原子和电荷平衡。
学生活动:相互讨论,总结出离子方程式的定义和特点;认真倾听,记笔记。
第四环节
教师活动:
问题7:哪些是易溶于水且易电离的物质呢?
【随堂练习1】用离子方程式表示下列反应:①硫酸与氢氧化钠溶液反应;②盐酸与氢氧化钾溶液反应。
【追问】我们可以看出,两个反应的化学方程式不同,但都可以用相同的离子方程式表示。从中可以得到什么启示?
【板书】离子方程式的意义:不仅可以表示某一个具体的化学反应,还可以表示同一个类型的离子反应。
【分析】离子方程式H++OH-=H2O表示:强酸溶液和强碱溶液反应生成可溶性盐和水的化学反应。
学生活动:
【回答】易溶于水且易电离的物质包括:强酸:HCl、HNO3、H2SO4;强碱:NaOH、KOH、Ba(OH)2;可溶性盐:(查课本110页溶解性表);其他物质如单质、气体、氧化物、难溶物质、难电离物质等仍用化学式表示。
4.课堂总结,加深印象
教师活动:
【总结】电解质在溶液中主要是以离子形式存在的,水溶液中有电解质参加的反应实质上是离子之间的反应,我们学习了离子反应,离子反应的发生条件是有难溶物、气体、难电离等新物质生成。
学会了写电离方程式和离子方程式后,还要学会区别电离方程式、化学方程式和离子方程式。
5.巩固知识,加深理解
(1)下列物质混合后,不会发生离子反应的是 ()
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.NaOH溶液和盐酸
(2)下列各反应中,能用离子方程式H++OH-=H2O表示的是()
A.硫酸溶液和氢氧化钾溶液反应
B.盐酸和氨水反应
C.稀硫酸和氢氧化钡溶液反应
D.盐酸溶液和氢氧化铜反应
(3)生活中的离子反应:当胃酸 (含HCl)过多的时候医生经常用胃舒平 [主要成分是Al(OH)3]治疗。请写出反应的化学方程式和离子方程式。
九、板书设计
1.离子反应:有离子参加的反应 (或在水溶液中发生的有电解质参加的反应)。
离子反应特点:①反应是在溶液中进行的;②反应物是以离子形式存在并参加反应;③有难溶物、气体、难电离等新物质生成。
2.离子方程式:用实际参加反应的离子符号来表示反应的式子。离子方程式特点:①表示了反应的实质;②更简明。
3.离子方程式的书写步骤:①写:写出化学方程式;②拆:将易溶于水且易电离物质拆写成离子形式;③删:将不参加反应的离子 (等式两边相同的离子)删除;④查:检查离子方程式:最简,原子和电荷平衡。
4.离子方程式的意义:不仅可以表示某一个具体的化学反应,还可以表示同一个类型的离子反应。
十、教学反思
首先,离子反应对高一的学生来说有一定的难度,对于水溶液中发生的复分解反应只能从宏观实验现象认识,不能从微观的角度认识。从上课情况来看,师生间的交流能够顺利完成,效果明显比以前的教学感觉要好。课堂上,学生能根据教师对知识的铺垫,完成问题的分析、讨论,学生的主体作用得到了很好的发挥,教师能尽量让学生进入学习状态,发挥他们的积极主动性。
在教学中,教师应采取丰富的教学活动,采用实验探究法、问题教学法,活跃课堂气氛,为学生提供直观的实验现象,激发学生的学习兴趣,多媒体的应用在课堂上使抽象的内容直观化,并采用了分组讨论、知识的探究迁移、对比、应用等方式,加强了学生对新知识的理解。
(编辑:朱泽玲)
G633.8
A
1671-0568(2016)09-0096-03
吴振兴,湖南省新化县第四中学教师。

