微杆菌Microbacteriumsp.FY1538降解赤霉烯酮的活性研究
徐天宇,胡苏莹,周峻岗,吕 红
(1. 复旦大学 生命科学学院 遗传工程国家重点实验室,上海 200438;2. 上海工业菌株工程技术研究中心,上海 200438)
微杆菌Microbacteriumsp.FY1538降解赤霉烯酮的活性研究
徐天宇1,2,胡苏莹1,2,周峻岗1,2,吕红1,2
(1. 复旦大学 生命科学学院 遗传工程国家重点实验室,上海 200438;2. 上海工业菌株工程技术研究中心,上海 200438)
赤霉烯酮(Zearalenone, ZEN)主要是由镰刀菌属(Fusariumsp.)的某些种,如禾谷镰刀菌(Fusariumgraminearum)等通过聚酮类合成代谢途径生成并分泌的一种真菌毒素,具有类雌激素的性质. ZEN能引起家禽家畜和人的雌激素过多症,造成生殖紊乱、肝肾损伤,严重时可以致癌. 本研究用环戊酮作为唯一碳源, 从土壤中筛选获得一株可以有效降解ZEN的微杆菌(命名为Microbacteriumsp.FY1538). 该微杆菌在添加甲醇的LB培养基中发酵所得的上清液具有降解ZEN的活性. 进一步的分析证明了FY1538培养液上清中含有能够降解ZEN的酶. 经高效液相色谱分析,发现了ZEN生物降解的初步产物.
赤霉烯酮; 微杆菌; 生物降解
赤霉烯酮(Zearalenone, ZEN),又称为F-2毒素,主要是由镰刀菌属(Fusariumsp.)的某些种,如Fusariumgraminearum、F.culmorum、F.cerealis等通过聚酮类合成途径生成并分泌的一种真菌毒素[1]. ZEN具有弱雌激素活性,可以与动物的雌激素受体(17β-雌二醇受体)结合并触发细胞对雌激素的下游反应. ZEN并非甾体结构,而是一种雷锁酸内酯,全称为6-(10-羟基-6-酮基-反-1-十一碳烯基)β-雷锁酸内酯,相对分子质量 318,对热比较稳定. ZEN不溶于水,但可以溶于碱性水溶液、乙醚、氯仿、乙酸乙酯、甲醇、乙醇和乙腈等[1].
ZEN是一种雷锁酸内酯.1962年Stob等首先从发霉的玉米中分离得到了该毒素,命名为玉米赤霉烯酮[2].1966年Urry首次阐明了该毒素的结构(图1(a),见第224页)[3]. ZEN及其衍生物具有类雌激素活性,会使人和动物产生雌激素过量综合症,主要表现为影响雌性动物性征发育、抑制排卵会引发假孕、胎儿异常畸形、性腺肿胀发炎[4-5]. ZEN也会降低雄性动物的精液质量,造成不育[4]. 除此之外,ZEN还会造成急性中毒[6]、肝损伤[7]、免疫损伤[8]及致癌[9].
ZEN的降解方法有物理法、化学法和生物酶解法3种. 物理法降解ZEN主要是热处理和吸附. 在120~140℃加压处理2h后可以除去食物中73%~83%的ZEN[10]. 吸附ZEN则利用活性炭、硅藻土、纳米碳[11]等多孔材料. 然而,热处理ZEN降解不完全,吸附则没有根除ZEN本身,吸附剂的不恰当处理还会造成再次污染. 化学法处理ZEN主要是利用强氧化剂来破坏ZEN的结构. Alla报道,臭氧在乙腈水溶液中能够在15s内将20μg/mL的ZEN完全清除[12]. 化学法高效快速,但不适合处理食物和饲料,乙腈、臭氧或双氧水的毒性都甚于ZEN.
生物酶解法降解ZEN目前研究还不是很深入. 已报道可以降解ZEN的菌株很多,但明确降解机理的研究寥寥. 目前唯一降解机理完全研究清楚的是粉红黏帚霉(Gliocladiumroseum),其编码一种α/β水解酶zhd101,能够打开ZEN的大环酯键(图1(b)[13]),产物没有雌激素活性[5,13-14].
除此以外,雷元培等发现了一株枯草芽孢杆菌(Bacillussubtilis)ANSB01G可以使ZEN连接一个谷氨酸后酯键开环、脱水,产物无雌激素活性[15],但没有确定作用酶. 余元善等发现了一株不动杆菌(Acinetobactersp.)SM04表达的一种过氧化物酶和一种氧化酶对ZEN有活性,产物无雌激素活性,但产物结构未知[16].Vekiru等发现了一株解毒毛孢子菌(Trichosporonmycotoxinivorans)可以在ZEN大环酮基处进行Baeyer-Villiger反应,再水解打开大环,产物无雌激素活性,但酶未分离出[17]. 其他报道能降解ZEN的菌株还有粗糙脉孢霉(Neurosporacrassa)[18]、恶臭假单胞菌(Pseudomonasputida)[19]、黏质塞氏杆菌(Setratiamarcescens)[20]等,多数并没有明确降解机理,即降解酶或降解产物.
ZEN不溶于水,需要有少量甲醇、乙醇等有机溶剂助溶.本研究利用唯一碳源富集方法,从环境微生物中筛选获得了一株降解ZEN的微杆菌,命名为Microbacteriumsp.FY1538. 初步解析了该微杆菌FY1538对ZEN生物降解的机理,分离了一部分的初始降解产物.
1 材料与方法
1.1材料
微杆菌FY1538(Microbacteriumsp.FY1538)筛选所用的培养基配方如下:
无机盐培养基:0.67g NH4Cl,1.5g K2HPO4,0.5g KH2PO4,1.06g NaNO3,0.2g MgSO4·7H2O,0.023g CaCl2,加去离子水800mL溶解,pH调至7.2后定容至1L. 115℃灭菌20min. 使用前在无菌条件下加入10mL微量元素液.
微量元素液:200mg FeSO4·7H2O,50mg ZnSO4·7H2O,40mg MnCl2·4H2O,40mg CoCl2·6H2O,40mg CuSO4·5H2O,10mg H3BO2,50mg NaMoO4·2H2O,加80mL去离子水溶解,定容至100mL,用0.22μm 微孔滤膜过滤除菌.
唯一碳源培养基:在无机盐培养基的基础上,使用时加入终浓度5g/L的唯一碳源物质(如环戊酮),摇匀使用.

表1 实验所用的引物序列
LB培养基:10g/L 胰蛋白胨(Tryptone),5g/L 酵母提取物(Yeast extract),10g/L NaCl(如做成固体培养基则再加入1.5%琼脂糖). 调节pH为7.4后115℃灭菌20min.
实验中用到的PCR引物见表1. DNA序列测定由上海杰李生物技术有限公司完成. Taq酶购自TaKaRa公司. 薄层层析(TLC)硅胶板购自Merck公司. HPLC仪和C18色谱柱为Aglient公司产品. ZEN购自Sigma公司. 本实验中在未特别说明情况下,ZEN一律由甲醇配置,浓度为 5mg/mL.
1.2方法
1.2.1ZEN降解菌的筛选和鉴定
本研究所用土壤样品采自青海湖边、北京、上海郊区、河北、山东农村等地(表2).

表2 实验所用土壤样品列表
注:括号内为经纬度.
用适量0.15mol/L NaCl溶液振荡洗涤土壤样品,待其自然沉降2min后吸取1mL上清,加入到50mL 唯一碳源培养基中,30℃培养7d后,取1mL培养液转接到新的50mL唯一碳源培养基中,继续30℃培养7d. 反复转接4~5次后,取菌液适当稀释涂布LB、YEPD、PDA平板,挑取单一菌落接种到相应的液体培养基,加入终浓度25μg/mL ZEN,30℃培养2d. 培养液离心分离上清和菌体. 菌体用PBS重悬后用超声波充分破碎,离心分离破碎上清液和残渣. 用乙酸乙酯抽提培养液上清、破碎上清和破碎残渣中的ZEN,用TLC检测(检测波长为254nm),展开剂为石油醚∶丙酮∶乙酸乙酯(体积比5∶4∶1). 我们选出ZEN被有效清除的菌株,用16S rRNA引物(细菌)或18S rRNA引物(真菌)作菌落PCR扩增,鉴定种属.
1.2.2ZEN降解酶分布情况的检测
将ZEN降解菌株在含有终浓度25μg/mL ZEN的LB培养基中培养2d后,培养液离心分离上清液和菌体. 菌体用PBS重悬后超声波充分破碎,离心分离破碎上清和残渣. 向培养液上清、破碎上清和破碎残渣中分别加入终浓度50μg/mL ZEN,30℃ 水浴反应 16h,用乙酸乙酯抽提ZEN后用TLC检测.
将培养液上清用蛋白酶K 30℃处理过夜后,再加入终浓度50μg/mL的ZEN,30℃水浴16h,用乙酸乙酯抽提ZEN后用TLC检测.
1.2.3ZEN降解酶表达条件的初步探索
将ZEN降解菌株分别接种到在含有终浓度5μL/mL甲醇、5μL/mL乙醇、25μg/mL ZEN(甲醇溶解)、25μg/mL ZEN(乙醇溶解)的LB培养基中培养2d后,培养液离心取上清液,加入终浓度50μg/mL 的ZEN,30℃水浴16h,用乙酸乙酯抽提ZEN后用TLC检测.
1.2.4培养液上清ZEN降解酶酶活性质
将ZEN降解菌株在含有终浓度5μL/mL甲醇的LB培养基中培养2d后,培养液离心取上清作为ZEN降解酶液. 调节酶液不同的反应温度和不同的pH值,加入终浓度50μg/mL ZEN,水浴6h,用HPLC分别检测反应前后酶液中ZEN含量,以找到最适pH值及最适反应温度.
将酶液调至最适pH值,分别在40,50,60,70℃先水浴1h,然后加入终浓度50μg/mL ZEN,在最适反应温度下水浴反应6h,用HPLC分别检测反应前后酶液中ZEN含量,以确定活性酶本身的热稳定性.
2 结果与分析
2.1微杆菌Microbacteriumsp.FY1538的鉴定
我们在环戊酮唯一碳源的培养基中于LB平板上分离得到了一株能够有效清除ZEN的菌,通过16S rRNA鉴定该菌是属于微杆菌属(Microbacteriumsp.),我们将其命名为 FY1538. 用Mega5.0对Microbacteriumsp.FY1538与其他微杆菌构建16S rRNA序列的系统发育树(Neighbour-Joining,boot strap=500),发现与FY1538最为相近的微杆菌属模式菌株是Microbacteriumaerolatum(图2). FY1538在LB平板上生长的菌落为圆形,培养36h后直径大约1.5mm,不透明,有光泽,黄色(图3).
2.2ZEN降解产物的TCL检测
用含有ZEN的LB培养基培养该菌一段时间后,离心培养液分离上清和菌体,菌体超声波破碎,离心. 向培养液上清、菌体破碎上清和PBS重悬的破碎残渣中分别加入终浓度50μg/mL ZEN,30℃水浴反应16h,TLC检测(图4(a)). 发现只有培养液上清中赤霉烯酮消失,说明ZEN于胞外降解. 用蛋白酶K处理培养液上清24h后,再加入终浓度50μg/mL ZEN,30℃水浴16h,TLC检测(图4(b)). 发现经处理的培养液上清失去降解ZEN的能力,说明上清液的活性应该源于酶.
由于本实验中的ZEN均为甲醇溶解,因此我们用等量的纯甲醇作为实验对照,发现Microbacteriumsp.FY1538在加入纯甲醇的LB培养液上清中同样具有ZEN降解活性. 即在LB培养基中添加终浓度10μL/mL的纯甲醇,但不添加ZEN,接种Microbacteriumsp.FY1538培养2d后取上清,在上清中加入终浓度50μg/mL ZEN,30℃水浴16h,用TLC检测(图4(c)). 发现纯甲醇诱导的培养液上清与之前ZEN甲醇溶液诱导的上清具有相同的降解ZEN的活性.
将ZEN的溶剂更换为乙醇,重复上述实验,并用甲醇诱导上清去反应乙醇溶ZEN,用TLC检测(图4(d)). ZEN溶剂更换为乙醇后,Microbacteriumsp.FY1538并没有降解ZEN(lane1);纯乙醇诱导的培养液上清也不具有降解ZEN的活性(lane5),而纯甲醇诱导的培养液上清依旧可以降解更换溶剂的ZEN(lane6).这说明ZEN本身并非诱导剂,ZEN的降解活性源于甲醇诱导,乙醇不能诱导.我们未试验是否还有其他物质可以诱导.
2.3温度、pH对Microbacteriumsp.FY1538降解ZEN活力的影响
将甲醇诱导的培养液上清作为ZEN降解酶液,分析其最适反应温度. 加入终浓度50μg/mL ZEN,在不同温度水浴反应6h,用HPLC分别检测反应前后酶液中ZEN含量,得到的ZEN降解率. 发现该上清酶液最适反应温度为50℃左右,这时ZEN降解率达到95.6%. 低温对降解活性影响较小,25℃时ZEN降解率下降约20%;高温对降解活性影响很大,70℃时ZEN降解率下降约60%(图5(a)). 为了分析活性酶本身对不同温度的稳定性,我们将酶液分别在40,50,60,70℃水浴热处理1h,然后加入终浓度50μg/mL的ZEN,在最适温度50℃下水浴反应6h,用HPLC分别检测反应前后酶液中ZEN含量(图5(b)). 发现该上清液在40℃、50℃热预处理后,相对于未经过热处理的样品,酶活基本无变化;在60℃、70℃热处理后,酶活有比较明显下降,ZEN降解率降至78.2% (60℃)和59.0% (70℃). 说明该酶的耐热温度与最适反应温度相近.
调节酶液不同的pH,加入终浓度 50μg/mL ZEN,50℃水浴反应6h,用HPLC分别检测反应前后酶液中ZEN含量(图6). 发现实验最适反应pH=9,这时ZEN降解率达到97.1%. 上清酶液的原pH为8.4,与之非常相近. 低pH对降解活性影响很大,pH=4时酶几乎没有活性;高pH对降解活性影响也比较明显,pH=12时ZEN降解率下降约50%.
2.4ZEN降解产物的HPLC分析
将ZEN(甲醇溶)共培养得到的上清酶液加入终浓度50μg/mL ZEN(实验组),同时设置这样的一组上清酶液加入等量纯甲醇做对照(给出溶剂背景,以保证HPLC结果的精确性),在pH=9,50℃水浴进行反应. 反应0,1,2,3,4,5,6,10,15,20 h时用HPLC检测反应体系(图7,见第228页).
从图7可知随着反应时间延长,实验组中ZEN的含量明显下降,在21.6,23.3,23.8,24.8,25.3,25.7,26.1min出现新的峰Z1~Z7. 对照组在这一段区间20h内一直没有新峰出现. 推测这些新峰可能是ZEN的产物,微杆菌FY1538降解ZEN可能是多酶的连续反应.
图7(b)中Z1~Z7、ZEN的 HPLC峰面积随反应时间变化见表3. 从表3可知,随着反应时间的推移,反应体系中ZEN含量在不断下降;Z1~Z7的含量都呈现了一个先上升后下降的趋势,其中Z2含量在反应2h达到最高,Z3、Z4在3h达到最高,Z1、Z5、Z6、Z7在4h达到最高.反应经过25h后,Z1、Z3、Z4、Z7还有微量残存,Z2、Z5、Z6含量则低于检测限.
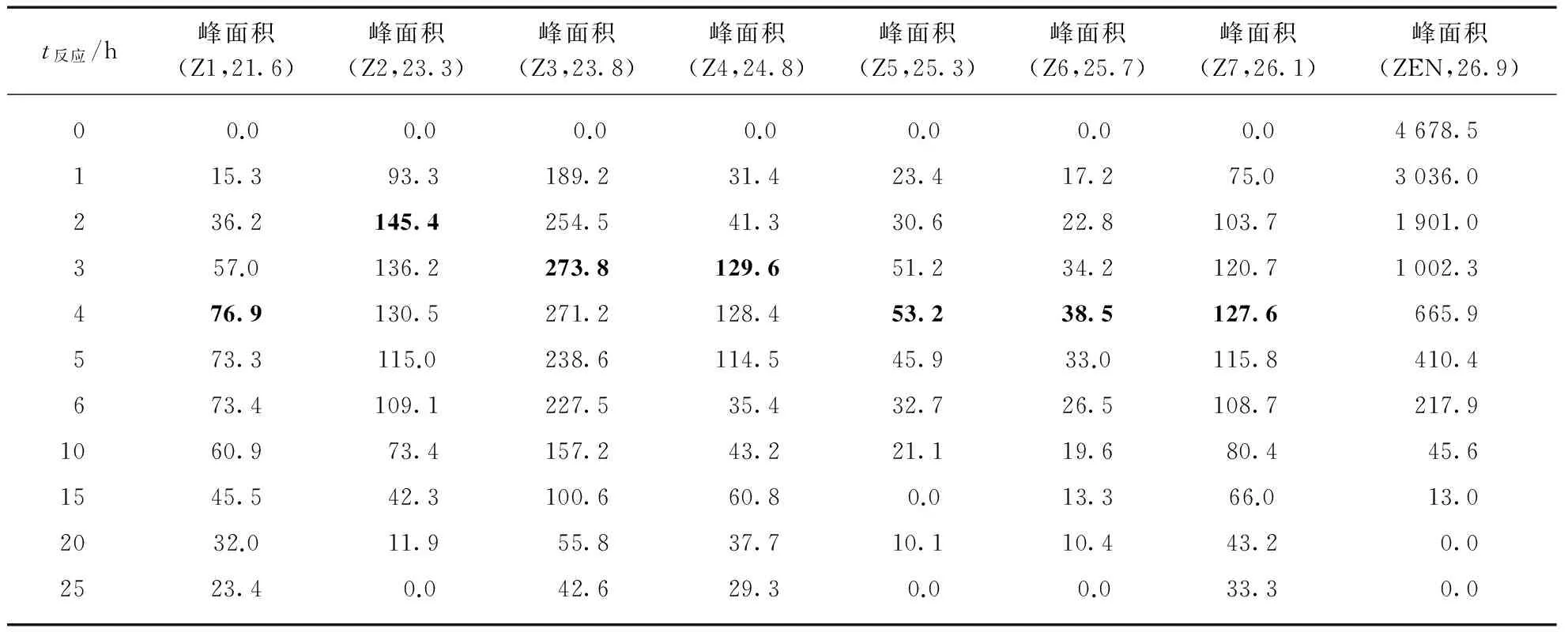
表3 ZEN及产物Z1~Z7的随反应时间峰面积变化
注:括号内是峰的名称和出峰时间(min),黑体标记数字为产物Z1~Z7的最大峰面积.
3 讨 论
本研究获得了一株能够降解ZEN的微杆菌Microbacteriumsp.FY1538. 目前尚未见到关于微杆菌降解ZEN的报道. 微杆菌是一类在土壤中分布广泛、种类繁多但又研究稀少的一类细菌. 已有的研究发现微杆菌属的细菌具有强大的有机物降解能力,有机大分子如黄原胶[21]、壳聚糖[22],芳香化合物萘、菲、蒽、芘[23]、苯乙酮[24]、苯胺[25],以及带有杂环的尿酸[26],除草剂氯乙酰[27]等多种化合物均有微杆菌可以降解的报道,不少研究已经分离获得了降解酶. 关于微杆菌的安全性方面,目前很少有资料表明该属细菌与人类疾病直接相关,Funke等发现一例眼外伤导致的微杆菌属感染[28],Sharma等从一名肺移植患者体内发现一株耐药性的微杆菌(Microbacteriumyannicii)[29]. 而微杆菌作为线虫[30]等低等生物的病原体的报道较多. 目前在已有的研究报道中,还没有发现微杆菌被特定物质诱导后能够产生某些特殊活性的报道.Microbacteriumsp.FY1538的全基因组测序工作即将开展,分析基因组测序信息将帮助我们更好地认识微杆菌受到甲醇诱导产生降解赤霉烯酮的活性的原因.
本研究采用的是唯一碳源的方法从环境中富集筛选目标微生物.实验初期曾用ZEN干粉的无机盐培养基悬浊液来富集,菌群几乎没有生长,ZEN也没有明显降解,富集没有成功,推测ZEN的结构复杂性影响了微生物对其的利用. 从ZEN结构上来看,酯键、酮基是比较容易打开的位点,断开酯键的酶已经有相关的报道(Gliocladiumroseum水解酶zhd101),而断开酮基相关的酶还没有被发现. 打开酮基需要BV单加氧酶(Baeyer-Villiger Monooxygenase, BVMO),这类酶可以发生Baeyer-Villiger反应,使酮基变为酯键,再用其他的酯酶水解打开. BVMO是B类黄素蛋白单加氧酶的一种,含FAD,依赖于辅酶NADPH[31]反应,Yachnin等揭示了它的机理[32]. 本研究最终选择了用环己酮、环戊酮、环十二酮、环十五酮代替ZEN作为唯一碳源来进行富集筛选,依据是这些化合物如果发生Baeyer-Villiger反应并水解后,能形成微生物容易利用的结构简单的脂肪醇酸,是比较理想的富集碳源. 后续实验也证实以这些环酮类作唯一碳源富集培养,培养液明显浑浊,菌群有了明显的生长.
对比已报道的其他ZEN降解菌的HPLC峰图,微杆菌FY1538与它们的降解现象并不一致.粉红黏帚霉(Gliocladiumroseum)降解ZEN的产物只有一个峰,出峰时间大大早于ZEN[13];解毒毛孢子菌(Trichosporonmycotoxinivorans)降解ZEN的产物也只有一个峰,出峰时间略早于ZEN[17],且峰面积与ZEN峰相当,而本研究中产物峰面积远小于ZEN峰;枯草芽孢杆菌(Bacillussubtilis) ANSB01G降解ZEN的产物有两个峰,出峰时间均略早于ZEN,峰面积远小于ZEN峰,与本实验现象最为相似,虽然产物峰数量较少[16],很可能ANSB01G与FY1538在降解ZEN上有一部分反应机理是相同或类似的. 其他的一些ZEN降解菌的研究并没有呈现相关的HPLC数据,目前还不能确定FY1538与它们反应机理之间的相似性.
ZEN被微杆菌降解后产物的结构、降解过程的机理,产物是否还有雌激素性质或其他毒性等是需要进一步研究的课题.
[1]PLACINTA M, D’MELLO J P F, MACDONALD A M C,etal. A review of worldwide contamination of cereal grains and animal feed withFusariummycotoxins [J].AnimalFeedScienceandTechnology, 1999,78:21-37.
[2]STOB M, BALDWIN R S, TUITE J,etal. Isolation of an anabolic,uterotrophic compound from corn infected withGibberellazeae[J].Nature, 1962,196:1318.
[3]URRY W H, WEHRMEISTER E B. The structure of zearalenone [J].TetrahedonLetters, 1966,27:3109-3114.
[4]GLENN A E. MycotoxigenicFusariumspecies in animal feed [J].AnimalFeedScienceandTechnology, 2007,137(3/4):213-240.
[5]KAKEYA H, TAKAHASHI-ANDO N, KIMURA M,etal. Biotransformation of the mycotoxin, zearalenone, to a non-estrogenic compound by a fungal strain ofClonostachyssp. [J].Bioscience,BiotechnologyandBiochemistry, 2002,66(12):2723-2726.
[6]JECFA. Safety evaluation of certain food additives and contaminants [R]. WHO/FAO Food additives Series 44,2000.
[7]MAAROUFI K, CHEKIR L, CREPPY E E,etal. Zearalenone induces modifications of haematological and biochemical parameters in rats [J].Toxicon(Oxford), 1996,34(5):535-540.
[8]ABBES S, OUANES Z, BEN SALAH-ABBES J,etal. The protective effect of hydrated sodium calcium aluminosilicate against haematological, biochemical and pathological changes induced by zearalenone in mice [J].Toxicon, 2006,47(5):567-574.
[9]ABBES S, OUANES Z, SALAH-ABBES J B,etal. Preventive role of aluminosilicate clay against induction of micronuclei and chromosome aberrations in bone-marrow cells of Balb/c mice treated with zearalenone [J].MutationResearch, 2007,631(2):85-92.
[10]BULLERMAN L B, BIANCHINI A. Stability of mycotoxins during food processing [J].InternationalJournalofFoodMicrobiology, 2007,119(1):140-146.
[11]YIN S, MENG Q, ZHANG B,etal. Alleviation of zearalenone toxicity by modified halloysite nanotubes in the immune response of swine [J].FoodAdditContamPartAChemAnalControlExpoRiskAssess, 2015,32(1):87-99.
[12]ALLA A. Zearalenone:Incidence,toxigenic fungi and chemical decontamination in Egyptian cereals [J].Nahrung-Food, 1997,41(6):362-365.
[13]TAKAHASHI A N, KIMURA M H, OSADA H,etal. A novel lactonohydrolase responsible for the detoxification of zearalenone:Enzyme purification and gene cloning [J].BiochemJournal, 2002,365(1):1-6.
[14]EL-SHARKAWY S, ABUL-HAJJ Y J. Microbial cleavage of zearalenone [J].Xenobiotica, 1988,18(4):365-371.
[15]雷元培.ANSB01G菌对玉米赤霉烯酮的降解机制及其动物试验效果研究[D].北京:中国农业大学,2014.
[16]余元善.AcinetobacterspSM04降解玉米赤霉烯酮的研究[D].广州:华南理工大学,2014.
[17]VEKIRU E, HAMETNER C, MITTERBAUER R,etal. Cleavage of zearalenone byTrichosporonmycotoxinivoransto a novel nonestrogenic metabolite [J].AppliedandEnvironmentalMicrobiology, 2010,76(7):2353-2359.
[18]GALAGAN J E, CALVO S E, BORKOVICH K A,etal. The genome sequence of the filamentous fungusNeurosporacrassa[J].Nature, 2003,422(6934):859-868.
[19]ALTALHI A D, EL-DEEB B. Localization of zearalenone detoxification gene(s) in pZEA-1 plasmid ofPseudomonasputidaZEA-1 and expressed inEscherichiacoli[J].JournalofHazardousMaterials, 2009,161(2/3):1166-1172.
[20]AZIZ N H. The role of chitinese ofSerratiamarcescensin controlling the production of zearalenone byFusariumgraminearum[J].ActaMicrobiologicaPolonica, 2002,51(2):131-137.
[21]钱方.黄原胶生物降解及其寡糖生理括性的研究[D].大连:大连理工大学,2008.
[22]孙玉英.壳聚糖酶的性质及基因的克隆和表达研究[D].青岛:中国海洋大学.
[23]王春明,李大平.微杆菌3-28对萘、菲、蒽、芘的降解 [J].应用与环境生物学报,2009,15(3):361-366.
[24]罗莉.Microbacteriumsp.中关键羰基还原酶的分离纯化及性质研究[D].武汉:武汉科技大学,2012.
[25]沈晓莉,王健鑫.一株对硝基苯胺降解菌Microbacteriumsp.PNA8的分离鉴定及其降解条件研究 [J].微生物学通报,2009,36(10):1496-1500.
[26]张鹏程,卢向锋.微杆菌属ZZJ4-1菌株的耐热尿酸氧化酶基因的克隆及重组酶性质 [J].生物工程学报,2012,28(7):813-822.
[27]袁艺.氯乙酰胺除草剂降解菌株Microbacteriumsp.T4-7的鉴定及其降解相关酶的酶学特性[D].南京:南京农业大学,2012.
[28]FUNKE G, HAASE G, SCHNITZLER N,etal. Endophthalmitis due to microbacterium species:Case report and review ofMicrobacteriuminfections [J].ClinicalInfectiousDiseases, 1997,24(4):713-716.
[29]SHARMA P, DIENE S M, THIBEAUT S,etal. Phenotypic and genotypic properties ofMicrobacteriumyannicii, a recently described multidrug resistant bacterium isolated from a lung transplanted patient with cystic fibrosis in France [J].BMCMicrobiology, 1995,13(1):1-11.
[30]DARBY C. Interactions with microbial pathogens[D]. Birmingham, USA:University of Alabama, 2005.
[31]MASSEY V. The chemical and biological versatility of riboflavin [J].BiochemSocTrans, 2000,28(4):283-296.
[32]YACHNIN B J, TARA S, MCEVOY M B,etal. The substrate-bound crystal structure of a Baeyer-Villiger monooxygenase exhibits a Criegee-like conformation [J].JAmChemSoc, 2012,134(18):7788-7795.
Analysis of Zearalenone-Degrading Activities ofMicrobacteriumsp.FY1538
XU Tianyu1, 2, HU Suying1, 2, ZHOU Jungang1, 2, LÜ Hong1, 2
(1. State Key Laboratory of Genetic Engineering, School of Life Sciences, Fudan University, Shanghai 200438, China;2.ShanghaiEngineeringResearchCenterofIndustrialMicroorganisms,Shanghai200438,China)
Zearalenone(ZEN), is secreted by the numerousFusariumspecies, such asFusariumgraminearum, via the pathway of polyketide synthesis. It is a nonsteroidal oestrogenic mycotoxin with stable physicochemical property. ZEN causes hyperestrogenism in poultry, livestock and human beings. In human bodies, the accumulation of ZEN can make damage in reproductive system, kidney, liver, and even induce cancers. In this study, we isolated a bacterium ofMicrobacteriumsp. from soil, which can use cyclopentanone as the sole carbon source and degrade ZEN efficiently. We designated this bacterium asMicrobacteriumsp.FY1538, and preserved it in China General Microbiological Culture Collection Center (CGMCC NO.10614). Being cultured in LB medium and induced by methanol, thisMicrobacteriumproduces the enzymes for degrading ZEN in the supernatant. After analyzing the supernatant with degraded ZEN via HPLC, we found several potential products.
Zearalenone;Microbacterium; biodegradation
0427-7104(2016)02-0223-09
2015-05-21
国家高技术研究发展计划(2013AA102803B,2014AA021301),上海科委基地建设(13DZ2252000)和遗传工程国家重点实验室开放课题
徐天宇(1990—),男,硕士研究生;吕红,女,教授,通讯联系人,E-mail:honglv@fudan.edu.cn.
Q 939.96
A

