昆虫细胞中共表达人糖基转移酶对重组蛋白SEAP表达的影响
唐巍玲, 田苗苗, 黎健蓓, 钟 江
(复旦大学 生命科学学院 微生物学与微生物工程系 上海 200438)
昆虫细胞中共表达人糖基转移酶对重组蛋白SEAP表达的影响
唐巍玲, 田苗苗, 黎健蓓, 钟江
(复旦大学 生命科学学院 微生物学与微生物工程系 上海 200438)
杆状病毒-昆虫细胞表达系统有表达量高及蛋白翻译后修饰较完善等特点,但与哺乳动物相比其缺乏几种关键的糖基转移酶.许多研究表明将哺乳动物的糖基转移酶基因转入昆虫细胞中,能使得昆虫细胞表达蛋白的修饰得到有效改善.本研究通过RT-PCR克隆了人Ⅱ型N-乙酰葡萄糖胺转移酶(β-1,2-N-acetylglucosaminyltransferase Ⅱ)和Ⅰ型β-1,4-半乳糖基转移酶(β-1,4-galactosyltransferase)基因,并将它们分别插入重组杆状病毒上,获得了表达GnT2和β4GalT1的重组杆状病毒.以具有糖基化修饰位点的人分泌型碱性磷酸酶(Secreted Alkaline Phosphatase, SEAP)为对象,将表达糖基转移酶的重组杆状病毒和表达SEAP的重组杆状病毒共感染细胞,Western blot分析结果表明共感染时所表达的SEAP蛋白条带分子量明显大于其单独表达时的分子量.结果表明重组病毒共感染对杆状病毒-昆虫细胞表达的SEAP有修饰作用.
SEAP; 蛋白修饰; GnT2; β4GalT1; Bac-to-Bac
杆状病毒-昆虫细胞作为应用广泛的蛋白表达系统之一,具有安全、高效等优点.该表达系统拥有较完善的蛋白翻译后修饰途径[1],但在蛋白质修饰方面,昆虫细胞与哺乳动物细胞有较大的差别.例如,由于缺乏几种关键的与蛋白糖基化相关的酶,其蛋白糖链为低甘露糖型,具有易使人产生过敏反应的α-1,3-岩藻糖核心且末端没有唾液酸残基[2-3].而这种寡糖链的差异有可能影响蛋白的构象乃至功能[4].改造昆虫细胞蛋白修饰途径,使其蛋白产物更加接近哺乳动物蛋白是目前研究的热点[5-7].Aumiller及同事构建了稳定遗传的昆虫细胞系SfSWT-5,含有人β-1,2-N-乙酰葡萄糖胺转移酶Ⅱ型(β-1,2-N-acetylglucosaminyltransferase Ⅱ, GnT2)等6个哺乳动物糖基化相关酶基因,与未经改造的Sf9细胞相比,Sf SWT-5能对外源蛋白基因末端唾液酸化.这表明,通过改造昆虫细胞修饰途径来产生更复杂的蛋白产物是可行的,转入的酶基因所表达的酶拥有生物学活性,也预示着将来昆虫细胞在表达哺乳动物糖蛋白方面有很大的应用潜力[8-14].
本实验设想不通过建立稳定细胞系,而是通过表达不同糖基转移酶的重组杆状病毒的共感染,对人分泌型碱性磷酸酶(Secreted Alkaline Phosphatase, SEAP)进行加工,来验证这些酶在昆虫细胞中不仅能表达,而且有生物学活性,为将来深入研究昆虫细胞中蛋白糖基化的功能和机制,进一步优化昆虫细胞蛋白修饰途径做准备.为此,选取了两个人源糖基转移酶,N-乙酰葡萄糖胺转移酶Ⅱ型(GnT2)和β-1,4-半乳糖基转移酶Ⅰ型(β-1,4-galactosyltransferase, β4GalT1),通过Bac-to-Bac方法分别构建重组杆状病毒vGnT2和vβ4GalT1,并在感染重组杆状病毒的昆虫细胞中检测到酶的表达.进一步的实验发现,vGnT2和vβ4GalT1共感染可以提高昆虫细胞表达的SEAP的分子量,提示重组病毒表达的GnT2和β4GalT1对外源糖蛋白确实有修饰的作用.
1 材料与方法
1.1材料
E.coliTG-1菌株、DH10Bac菌株和HeLa细胞系,草地贪夜蛾Spodopterafrugiperda细胞系Sf9、及High Five细胞由本实验室保存.细菌37℃培养于LB培养基或者LB选择培养基,HeLa细胞37℃培养,5% CO2中以RPMI1640培养基(北京索莱宝生物技术公司)添加10%胎牛血清(FBS)培养.昆虫细胞Sf9 用TMN-FH (Sigma-Aldrich)添加10%胎牛血清,或用Sf900-Ⅲ无血清(Life Technology),于27℃培养;昆虫细胞High Five用Express 5无血清培养基(Life Technology)于27℃培养.T载体质粒、pFastBacHTB质粒、表达SEAP的重组病毒AcSEAP[15],表达EGFP的重组病毒AcGFP由本实验室保存.
各种限制性内切酶,DNA聚合酶,T4 DNA连接酶,PNGaseF(peptideN-glycosidase F)及反转录试剂盒等均购自TaKaRa公司;琼脂糖DNA回收试剂盒购自天根公司;引物由捷瑞公司和赛百盛公司合成,所用引物序列见表1;测序由博尚测序公司和美吉测序公司完成.鼠源抗His-tag抗体购自上海利堃贸易有限公司,兔源抗SEAP抗体购自Bio-Rad公司,羊源抗鼠及抗兔抗体均购自Sigma公司.
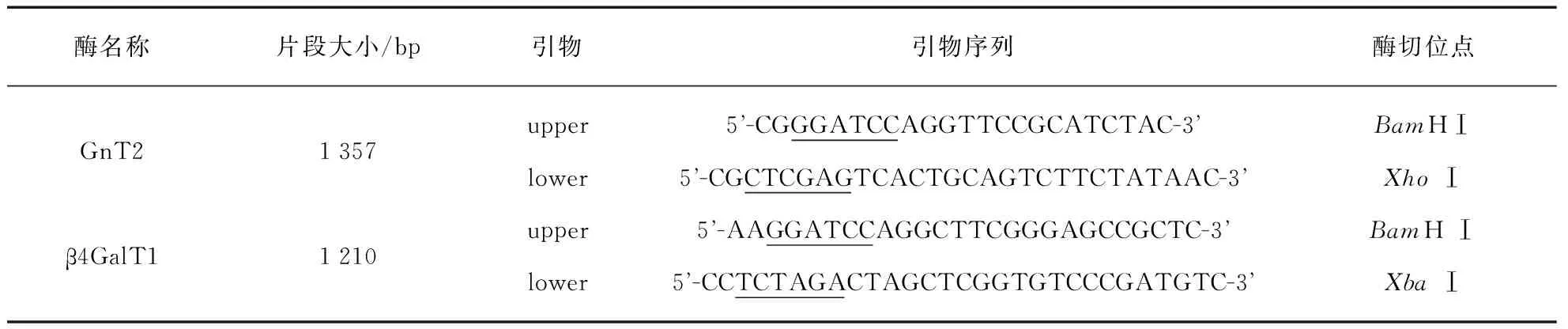
表1 糖基转移酶引物序列
注:加下划线部分表示酶切位点.
1.2重组转移质粒的构建
在培养的HeLa细胞中加入500μL RNAiso Plus(TaKaRa),平放1~2min,洗下细胞后,加入 100μL 氯仿抽提,12000g4℃离心15min,将上清转移至RNA-free离心管中,用异丙醇沉淀RNA.沉淀于冰上干燥后加入43μL DEPC H2O,5μL 10×DNase Ⅰ Buffer和2μL rDNase Ⅰ,37℃反应15min消化DNA,用PrimeScript RT Master Mix Perfect Real Time试剂盒(TaKaRa)反转录,并用GnT2和β4GalT1引物(表1)进行PCR.扩增产物经T载体克隆,并测序验证.
取与已知正确序列相符的GnT2和β4GalT1基因克隆,提取质粒,分别以BamHⅠ和XhoⅠ,及BamHⅠ和XbaⅠ双酶切,并克隆到pFastBacHTB的相应酶切位点,获得转移质粒pFastBacHTB-GnT2和pFastBacHTB-β4GalT1.
1.3重组病毒的构建
利用Bac-to-Bac系统(Invitrogen)根据标准程序进行重组病毒的构建.将转移质粒pFastBacHTB-GnT2和pFastBacHTB-β4GalT1分别转化至E.coliDH10Bac感受态细胞,用含卡那霉素、庆大霉素、四环素、X-Gal、IPTG的LB培养基筛选,选取白色克隆,经PCR验证带有目的基因后,提取Bacmid DNA.
Sf9细胞接入24孔细胞板(每孔2×105个细胞),过夜培养后,用Cellfectin Ⅱ (Invitrogen)将Bacmid 转入Sf9细胞,分别获得表达GnT2和β4GalT1的重组病毒vGnT2和vβ4GalT1.原代病毒以极低感染复数感染Sf9细胞,获得用于后续实验的病毒感染液.
1.4重组蛋白的检测
用适量Sf9 或 High Five细胞接种96孔板,然后用重组病毒vGnT2和vβ4GalT1感染,3d后将贴壁细胞用1×PBS洗涤并吹下,2500r/min离心5min,用60μL PBS悬浮,加入SDS-PAGE样品缓冲液,以8%浓度的分离胶进行SDS-PAGE,电泳后转移至PVDF膜进行免疫印迹实验,一抗为鼠源抗His-tag抗体(1∶5000稀释),二抗为AP偶联的羊源抗鼠抗体(1∶3×104稀释).
1.5SEAP活性的检测
96孔细胞培养板中接入等量High Five细胞,并按相同病毒感染复数的AcSEAP及vGnT2,vβ4GalT1感染细胞,并用AcGFP病毒平衡感染复数,使得各样品总的病毒感染复数相同.感染72h后收上清.测定酶活时,96孔板每孔加入5μL感染上清液,20μL 0.05% CHAPS(溶于PBS)、和200μL显色剂(含2mol/L二乙醇胺,1mmol/L MgCl2,0.5mmol/L ZnCl2),室温暗处孵育45min后,在405nm测量吸光度.
1.6Western blot
先用vGnT2或vβ4GalT1感染Sf9或High Five细胞,24h后再用AcSEAP感染,72h后收集上清液,进行Western blot,一抗为兔源抗SEAP抗体(1∶400稀释),二抗为AP偶联的羊源抗兔抗体(1∶104稀释).
1.7MALDI-TOF MS
用vGnT2、vβ4GalT1及AcSEAP感染High Five细胞,3d后收集上清,将2mL上清液超滤浓缩至100μL,其间加几次双蒸水将盐洗脱除去,得到蛋白样品.将未感染vGnT2及vβ4GalT1的SEAP蛋白样品和感染vGnT2及vβ4GalT1的SEAP蛋白样品交由生工公司(Sangon)进行MALDI TOF MS分析.
2 结 果
2.1重组杆状病毒的获得
从HeLa细胞中提取总RNA并反转录成cDNA,用表1中的特异性引物进行PCR扩增GnT2和β4GalT1基因,将扩增条带连接到T载体上,经DNA测序确认获得正确的GnT2和β4GalT1基因.进一步将这两个基因分别通过双酶切和连接接入pFastBacHTB,分别获得转移质粒pFastBacHTB-GnT2和pFastBacHTB-β4GalT1.利用Bac-to-Bac系统构建分别带有GnT2和β4GalT1的Bacmid,将Bacmid DNA转染Sf9细胞,得到重组病毒vGnT2和vβ4GalT1.效价测定表明,vGnT2和vβ4GalT1与野生型病毒相当,表明这两个酶的表达对病毒复制没有显著影响.
将病毒感染Sf9细胞3d后,收集细胞样品进行Western blot检测.由于pFastBacHTB载体带有6×His-tag,可以用His-tag抗体检测重组蛋白的表达情况,结果如图1所示.带His-tag的GnT2蛋白和β4GalT1蛋白理论大小分别为 54.5kDa 和47kDa,可以看出,在细胞中β4GalT1和GnT2都能表达,其中未感染病毒的Sf9细胞样品为阴性对照.
2.2重组病毒共感染对SEAP蛋白表达量的影响
将AcSEAP单独感染High Five细胞,或与vGnT2和/或 vβ4GalT1共同感染细胞,感染72 h后,测量培养基中SEAP活性,如图2所示.可看出在用等量AcSEAP感染细胞,并用AcGFP平衡感染总效价时,加入AcGFP组的酶活略低于AcSEAP单独感染的对照组酶活(AcSEAP+AcGFP为单独感染组的96.4%),而加入vGnT2或者vβ4GalT1的样品吸光度明显低于阳性对照(AcSEAP+vGnT2+AcGFP为单独感染组的86.7%;AcSEAP+vβ4GalT1+AcGFP为单独感染组的89.25%),AcSEAP与vGnT2和vβ4GalT1同时感染时吸光度最低(AcSEAP+vβ4GalT1+vGnT2+AcGFP为单独感染组的73.12%).说明在共感染重组病毒时,SEAP蛋白的活性水平有所降低.
2.3共感染表达糖基转移酶的病毒对SEAP分子量的影响
将AcSEAP与vGnT2和vβ4GalT1同时感染昆虫High Five细胞.感染3d后收集上清样品,浓缩后分别用PNGaseF进行处理,进行Western blot,结果见图3.PNGaseF能将蛋白的N-糖链水解切除,Western blot结果仅显示除去糖链后的蛋白条带.图3(a)中,AcGFP作用为平衡病毒感染复数,不影响SEAP分子量大小,经过PNGaseF水解后二者SEAP条带大小基本一致,且明显小于未水解的样品;而未经PNGaseF处理时,加入vGnT2和vβ4GalT1共感染时的SEAP条带比感染AcGFP的条带略有滞后,SEAP分子量前者比后者大.
图3(b)虽未用AcGFP来平衡总病毒感染复数,但可以看出,各样品经PNGaseF水解后条带大小无明显差异,而未经水解的样品中,在vGnT2或vβ4GalT1存在时产生的SEAP分子量比对照组略大.
2.4MALDI-TOF MS分析
取AcSEAP单独感染及AcSEAP与vGnT2及vβ4GalT1共感染的High Five细胞培养液上清,经超滤浓缩后,用MALDI-TOF MS检测上清液的蛋白质信号,结果如图4(见第236页)所示.
SEAP蛋白分子量约为56.4kDa,去除信号肽后约为54.3kDa. 图4中可看出共感染vGnT2及vβ4GalT1(图4(a))与AcSEAP单独感染时的蛋白信号(图4(b))相比,发生了明显的变化.单独感染时的主要峰在 55086 Da处,而共感染时在 55378.6680(峰1)、56840.6133(峰2)、58763.7578 和 60736.5625 的位置均有明显信号峰,意味着相应大小的蛋白所占比例有所提高.
3 讨 论
本文构建了表达两种人糖基转移酶的重组杆状病毒vGnT2和vβ4GalT1,并分析了它们在昆虫细胞中表达重组蛋白以及对外源糖蛋白表达修饰的影响,证明两种酶均能在细胞中得到有效表达,且有生物活性.
蛋白质是生物体内重要活性物质,作为药物治疗疾病的前景远阔.蛋白的修饰对于蛋白质性质具有极大影响[16].例如,在肿瘤细胞中,糖链的唾液酸化修饰异常会引起肿瘤细胞的黏附、侵袭和迁移等[17];促红细胞生成素(EPO)是一种糖蛋白药物,糖链对于其体内活性有重要作用,若缺乏糖链则会在体内被迅速水解失活.昆虫细胞糖基化途径的限制性阻碍了其表达哺乳动物蛋白质的能力,进一步影响它在医药上特别是在治疗上的应用.随着研究深入和技术进步,越来越多证据表明往昆虫细胞中引入其缺乏的糖基转移酶,有助于改善其蛋白修饰能力,这在医药科研上有重要意义.例如,改造细胞株Sf β4GalT/ST6与Sf9相比能产生末端唾液酸化的N-多糖,且在缺乏CMP-唾液酸的情况下进行唾液酸化;Sf SWT-5除了表型能稳定遗传外,其产生的糖链末端唾液酸化程度很高[18].
SEAP蛋白是人胚胎碱性磷酸酶突变体,缺乏胎盘碱性磷酸酶羧基末端的24个氨基酸,在High Five细胞内没有类似蛋白的表达,因此在Western blot时不会有内源表达干扰.SEAP蛋白有两个糖基化位点,Asn-144和Asn-271,但它只在Asn-271处有一个N-型连接的侧糖链,改变这个糖链结构对于SEAP的影响很大,且因为该蛋白带有信号肽,可以分泌到细胞外,无须裂解细胞就可以检测其活性,因此SEAP很适合用于蛋白修饰相关的研究[19].AcSEAP是用杆状病毒多角体启动子超表达SEAP基因的重组病毒.在Western blot的结果中,感染vGnT2、vβ4GalT1或二者同时感染的SEAP条带比阴性对照SEAP条带有滞后,说明GnT2和β4GalT1对外源糖蛋白SEAP有直接修饰作用,导致该蛋白分子量有所上升;而经过PNGaseF处理后各样品蛋白条带大小无差别,说明GnT2和β4GalT1极有可能是通过对糖链的影响来改变SEAP的分子量及活性的.
SEAP理论大小约55371.1Da,在MALDI-TOF的结果中,感染vGnT2及vβ4GalT1的细胞上清液与未感染重组病毒的相比,出现了疑似经过修饰的SEAP糖蛋白信号峰,位置与Western blot结果中条带大小基本相符.GnT2是Ⅱ型β-1,2-N-乙酰氨基葡萄糖基转移酶,β4GalT1是Ⅰ型β-1,4-半乳糖基转移酶,重组病毒编码的糖基转移酶可能是在SEAP的N-糖链支链末端分别或同时加上N-乙酰氨基葡萄糖或者半乳糖,但其具体是如何修饰的,在修饰后昆虫细胞是否对蛋白进一步加工或者进行了怎样的进一步加工,修饰前后的糖链结构产生了具体怎样的变化,以及验证疑似SEAP峰是否真的就是修饰前和修饰后的SEAP,还有待更细致的生化实验来深入研究[20].
本文的结果表明,vGnT2和vβ4GalT1不仅可以在昆虫细胞High Five中表达,而且可以通过共感染的方式改变人分泌型碱性磷酸酶SEAP的修饰并增大其分子量,与国外已有研究中将糖基转移酶基因整合到昆虫细胞基因组中建立稳定遗传细胞系的方法不同,本文采用的感染表达方法更加灵活和快速,这意味着将来有可能通过选择性采用表达不同相关酶的重组病毒,较为方便地针对性改变外源蛋白翻译后修饰情况,为将来研究蛋白糖链的功能和机制,优化昆虫细胞蛋白翻译后修饰打下了基础.
[1]HAMILTON S R. Production of complex human glycoproteins in yeast [J].Science, 2003,301(5637):1244-1246.
[2]VERVECKEN W, KAIGORODOV V, CALLEWAERT N,etal.Invivosynthesis of mammaliaN-like, hybrid-typeN-glycans inPichiapastoris[J].AppliedandEnvironmentalMicrobiology, 2004,70(5):2639-2646.
[3]HAMILTON S R, DAVIDSON R C, SETHURAMAN N,etal. Humanization of yeast to produce complex terminally sialylated glycoproteins [J].Science, 2006,313(5792):1441-1443.
[4]胡嘉彪,张芃,牛艳山,等.昆虫细胞内N-糖基化途径及人源化糖蛋白表达 [J].昆虫学报,2011,54(6):722-728.
[5]JARVIS D L, SHI X. ProteinN-glycosylation in the baculovirus-insect cell system [J].CurrentDrugTarges, 2007,8(10):1116-1125.
[6]WILDT S, GERNGROSS T U. The humanization ofN-glycosylation pathways in yeast [J].NatureReviewsMicrobiology, 2005,3(2):119-128.
[7]韦亚东,牛淼淼,刘子瑜,等.昆虫与哺乳动物蛋白质N-糖基化修饰异同的比较及其潜在的应用意义 [J].中国蚕业,2011,32(2):8-13.
[8]AUMILLER J J, MABASHI-ASAZUMA H, HILLAR A,etal. A new glycoengineered insect cell line with an inducibly mammalianized proteinN-glycosylation pathway [J].Glycobiology, 2012,22(3):417-428.
[9]ALTMANN F, STAUDACHER E, WILSON I B H,etal. Insect cells as hosts for the expression of recombinant glycoproteins [J].GlycoconjugateJournal, 1999,16(2):109-123.
[10]CASTILHO A, STRASSER R, STADLMANN J,etal. In planta protein sialylation through overexpression of the respective mammalian pathway [J].JournalofBiologicalChemistry, 2010,285(21):15923-15930.
[11]GEISLER C, JARVIS D L. Identification of genes encodingN-glycan processing β-N-acetylglucosaminidases inTrichoplusianiandBombyxmori:Implications for glycoengineering of baculovirus expression systems [J].BiotechnologyProgress, 2010,26(1):34-44.
[12]TOTH A M, GEISLER C, AUMILLER J J,etal. Factors affecting recombinant Western equine encephalitis virus glycoprotein production in the baculovirus system [J].ProteinExpressionandPurification, 2011,80(2):274-282.
[13]SERENA M S, GEISLER C, METZ G E,etal. Expression and purification of Suid Herpesvirus-1 glycoprotein E in the baculovirus system and its use to diagnose Aujeszky’s disease in infected pigs [J].ProteinExpressionandPurification, 2013,90(1):1-8.
[14]LEE P L, KOHLER J J, PFEFFER S R. Association of β-1,3-N-acetylglucosaminyltransferase 1 and β -1,4-galactosyltransferase 1, trans-Golgi enzymes involved in coupled poly-N-acetyllactosamine synthesis [J].Glycobiology, 2009,19(6):655-664.
[15]王鑫.杆状病毒复制和基因表达的表观遗传学调控研究[D]. 上海:复旦大学,2010.
[16]KAINZ E, GALLMETZER A, HATZL C,etal.N-glycan modification inAspergillusSpecies [J].AppliedandEnvironmentalMicrobiology, 2008,74(4):1076-1086.
[17]陈莉锋.α2,6-唾液酸转移酶对OVCAR3细胞吉非替尼敏感性的研究[D].温州:温州医学院,2013.
[18]江春雨,郭泽坤.人泛素基因原核表达载体构建、表达及鉴定 [J].安徽农业科学,2008, 36(2):449-450.
[19]NAM J H, ZHANG F, ERMONVAL M,etal. The effects of culture conditions on the glycosylation of secreted human placental alkaline phosphatase produced in chinese hamster ovary cells [J].BiotechnologyandBioengineering, 2008,100(6):1178-1192.
[20]张芃.利用具备N-糖基化途径的家蚕细胞系表达糖基化蛋白研究[D].杭州:浙江大学,2012.
The Effect of Human Glycosyltransferases Co-expression on the Expression of SEAP in Insect Cells
TANG Weiling, TIAN Miaomiao, LI Jianbei, ZHONG Jiang
(Department of Microbiology and Microbial Engineering, School of Life Sciences,FudanUniversity,Shanghai200438,China)
The baculovirus-insect cell expression system has the characteristics of high expression level and good post-translational protein modificaiton. But comparing to mammalian cells, it lacks several key glyco-syltransferases. In the current work, human β-1,2-N-acetylglucosaminyltransferase Ⅱ (GnT2) and β-1,4-galactosyltransferase (β4GalT1) were obtained by RT-PCR and used to construct two baculoviruses expressing GnT2 and β4GalT1. Then, the two recombinant viruses were used to infect insect cells together with another recombinant baculovirus expressing a human glycoprotein SEAP (secreted embryonic alkline phosphatase) to test their effect on SEAP glycosylation. Western blot showed that co-infection increased the molecular weight of SEAP. This result was confirmed by MALDI-TOF MS. It is suggested that co-infection of baculoviruses expressing human glycosyltransferase could be used to modify the baculovirus-expressed SEAP in insect cells.
SEAP; protein modification; GnT2; β4GalT1; Bac-to-Bac
0427-7104(2016)02-0232-07
2015-10-16
国家科技重大专项(2011ZX09506-001)
唐巍玲(1990—),女,硕士研究生. 钟 江,男,教授,通讯联系人,E-mail:jzhong@fudan.edu.cn.
Q 786
A

