土壤有机碳分解温度敏感性及其形成机理研究
宋卓然,李兆磊,陈学萍,方长明
(1. 复旦大学 生命科学学院 生物多样性科学研究所,上海 200438; 2. 江苏滩涂生物农业协同创新中心,盐城 224002)
土壤有机碳分解温度敏感性及其形成机理研究
宋卓然1,2,李兆磊1,2,陈学萍1,2,方长明1,2
(1. 复旦大学 生命科学学院 生物多样性科学研究所,上海 200438; 2. 江苏滩涂生物农业协同创新中心,盐城 224002)
土壤有机碳分解的温度敏感性(Q10)对预测生态系统碳循环对全球气候变化的响应具有重要意义.科学研究已证实有机碳质量和土壤微生物对有机碳分解的温度敏感性都有一定的影响,但目前的分歧仍然很大.本研究以灭菌后的土壤作为碳源,用少量未灭活的鲜土作为微生物源,采用变温培养方法,在受控条件下对比不同碳源+微生物源组合中土壤有机碳分解的温度敏感性,解析土壤底物和微生物对土壤呼吸和温度敏感性的贡献.结果表明:(1) 接种后的土壤呼吸随微生物源发生相应变化;未灭菌土壤的呼吸速率低于灭菌后接种自身土壤的呼吸值;土壤可溶性有机碳含量越高呼吸越强.(2) 与未灭菌土壤相比,灭菌后接种本源微生物的Q10显著降低;土壤灭菌后接种比自身Q10高的异源微生物,Q10会随之升高,接种比自身Q10低的异源微生物则Q10随之降低.表明微生物源和有机碳质量对碳分解的温度敏感性都起重要影响.在酸性土壤中,微生物对碳分解Q10值的影响要大于碳源,微生物的贡献约为63.2%,碳源贡献为36.8%.在碱性土壤中,碳源的贡献则更为重要,微生物的相对贡献约为41.8%,碳源相对贡献为58.2%.
土壤呼吸; 碳源质量; 微生物; Q10;pH
全球变暖已成为当今世界最受关注的问题之一,通常都认为全球变暖的根本原因是大气中CO2等温室气体的浓度快速上升.土壤是陆地生态系统的核心,是陆地生态系统中最大及周转最慢的碳库[1].全球土壤表层(1m)有机碳库约有1500Pg碳,是大气碳库的2 倍,是生物碳库的3倍,土壤碳库的微小变化可能会对大气CO2浓度产生重要影响[2],有可能加剧全球变暖.
土壤呼吸是陆地生态系统中土壤碳库释放CO2的一个重要过程,也是土壤和大气之间碳转移的主要途径之一,占生态系统总呼吸的60%~90%[3-4].温度是影响土壤呼吸的一个重要环境因子[5].土壤呼吸的温度敏感性即土壤呼吸对温度的响应,通常用Q10来描述[6],即其他环境因子不变时,温度每升高10℃土壤呼吸增加的倍数[7].Q10值的微小变化可能导致对未来土壤碳库大小评估的巨大偏差[8],理解温度敏感性的内在调控机理对预测未来土壤碳变化具有重要意义.
土壤有机碳(SoilOrganicCarbon,SOC)质量和土壤微生物对有机碳分解都起着重要作用.最近的研究报道主要关注土壤底物质量对土壤有机碳分解温度敏感性的影响,Zhou[9]将粉质黏土、壤土、砂质土等3种不同类型的土壤进行了160d的室内培养,发现粉质黏土的土壤有机碳可利用性较低,具有更高的温度敏感性.Kirschbaum[10]发现在森林生态系统中,凋落物越易于分解,其温度敏感性越低.不少研究却得到相反结果,他们认为难分解有机碳的温度敏感性并不比易分解有机碳的温度敏感性高[11-12].除了关注土壤底物质量与温度敏感性的关系,一些学者还报道了土壤呼吸温度敏感性和土壤微生物之间的关系.土壤异养呼吸反映土壤微生物对有机碳的利用,所以温度敏感性的本质是土壤微生物活性对温度的响应.微生物群落的差异可能是影响土壤有机碳分解温度敏感性的重要因素[12-13].Balser等[14]对3个不同生态系统的土壤微生物群落结构进行研究后发现,不同群落结构的微生物具有不同的温度敏感性.虽然微生物是土壤呼吸的主要参与者,但是目前关于微生物对温度敏感性影响的研究并不多,且他们关注的只是微生物对温度敏感性的定性影响[15],并没有关注土壤底物质量和微生物对有机碳分解温度敏感性的相对定量贡献.因此只有综合考虑有机碳质量和微生物对Q10的影响,并且将有机碳底物和微生物对温度敏感性的影响置于统一的体系下,比较两者的相对贡献,才能对Q10有着更加全面和深入的认识.
本研究采用土壤碳源和微生物的不同组合来解析微生物和土壤碳源质量对土壤温度敏感性的相对贡献.
1 材料与方法
1.1土壤样品采集与分析
本实验选取11种来自不同地点的土壤,以覆盖不同的土壤背景(表1),于2013年9月至2014年3月完成样品采集.取样时清除地表的植物及碎屑,在每个地点分别随机设置3个采样点.在每个样点用8cm直径的土壤取样器取表层土(0~20cm).土样带回实验室进行简单处理,剔除根系、土壤动物、小石头等杂物,并尽量保持原有湿度,放置于温室中储存培养.新鲜土壤样品的含水量用烘干法测定.野外采集的鲜土样经自然风干,研磨过孔径2mm(10目)的不锈钢筛后备用.取处理后的土样用数字酸度计(PHS-3E,上海佑科仪器仪表有限公司)测定土壤pH值(水土比为2.5∶1),加水的样品在2h内测试完毕.取适量经初步处理的土样,研磨过孔径为0.15mm(100目)的不锈钢筛后,分析土壤总碳、有机碳和氮含量.土壤总碳与总氮含量使用碳氮分析仪(FlashEA1112SeriesNCAnalyzer,ThermoFisherScientific,USA)测定,土壤有机碳含量采用总有机碳分析仪(MultiN/C3100withsolidmoduleHT1300,AnalytikJenaAG,Germany)测定.
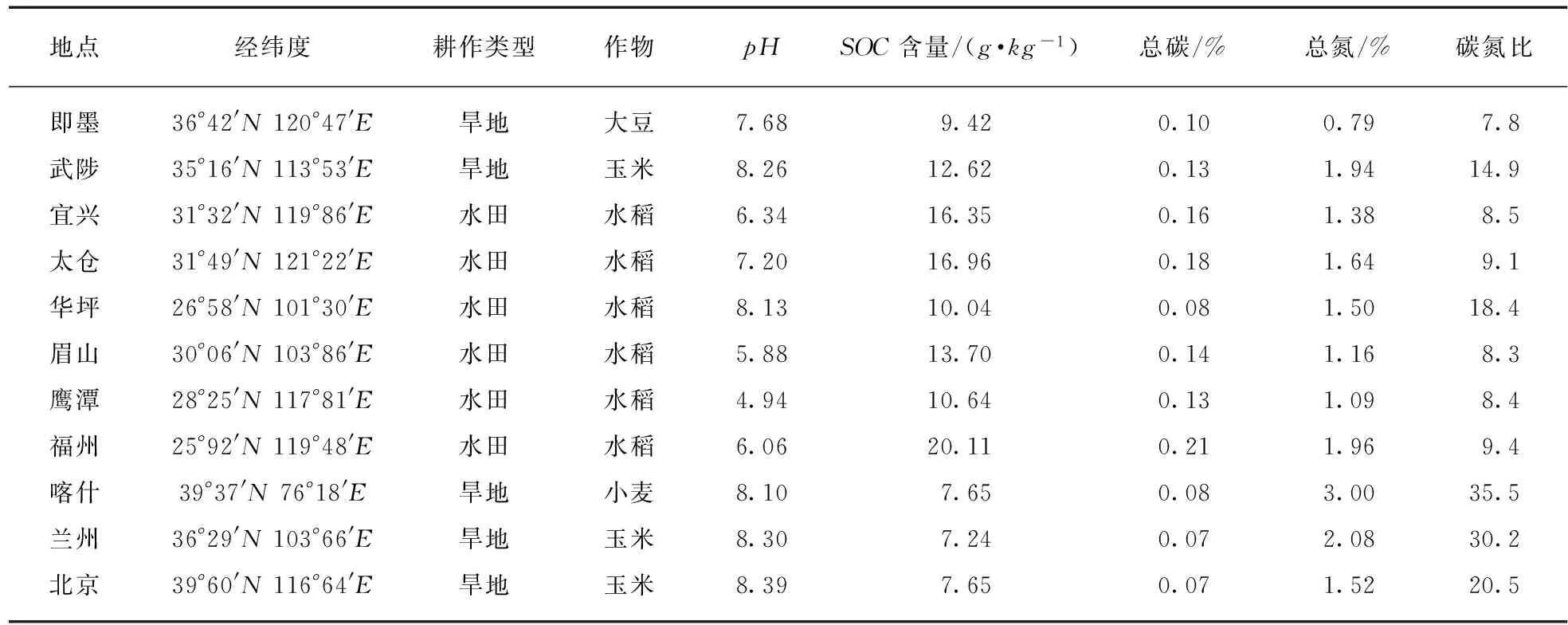
表1 各样地土壤背景和相关理化性质
1.2土壤灭菌与培养
将待灭菌土壤的含水量调节至田间最大含水量的60%,在温度为20℃的培养箱内预培养2~3d.用铝箔包封好土样,置于灭菌锅内,在121℃高温高压条件下灭菌1.5h;灭菌过程隔夜重复3次.灭菌后的样品放入4℃冰箱,密封备用;样品必须在3d之内用于培养实验,以减小放置时间过长的影响.
在无菌条件下称取相当于20g干土的灭菌土壤于玻璃培养瓶(预先做灭菌处理)中,用无菌水将受试土壤的含水量调节至田间最大含水量的60%(记为处理STER);称取相当于20g干土的未灭菌鲜土(记为CK0)于培养瓶中,调节含水量;称取相当于19.5g干土的灭菌土壤于培养瓶中,接种相当于0.5g干土的自身未灭菌鲜土(记为CK1),接种相当于0.5g干土的其他样点未灭菌鲜土(记为CK2).在CK1和CK2处理中,接种的少量未灭菌鲜土视为微生物源.所以CK1为接种本源微生物,CK2为接种异源微生物.
土壤培养方法参照文献[16-17]:用灭菌的橡皮塞密封培养瓶;每个处理的样品有3个重复.样瓶置于25℃培养箱预培养7d后,于低温恒温水浴槽(DC-0530,上海比朗仪器)中进行变温培养.新鲜空气经由分配系统均匀连续地通过每一个培养瓶,流速约为750mL/min.温度变化范围为4~28℃,以4℃以为变温步长,共7个温度梯度.培养过程中温度先从28℃逐步降到4℃到,再由4℃由逐步升温到28℃.改变温时,温度在1h内逐渐变化达到设定的改变值,避免温度快速升降对微生物造成影响.温度平稳后再测定土壤呼吸速率.考虑到在整个培养过程中土壤呼吸可能随时间单调下降[17],我们用升温和降温阶段呼吸的平均值代表每个设定温度下的土壤呼吸速率.
1.3土壤呼吸测定及Q10计算
在每一设定温度,当温度稳定后,开始测定土壤呼吸.首先停止新鲜空气在培养系统里的流动,立即用注射器于每个样瓶抽取5mL样气;密闭培养瓶一段时间,密闭时间长短通过预试验确定(使培养瓶内CO2浓度的增加适中),在密闭结束时再次抽取5ml样气.完成第二次取样后,恢复系统的气体流动.气体样品中的CO2浓度用Agilent6890N型气相色谱仪(AgilentTechnologies,Inc.)测定.CO2分离采用不锈钢填充柱,填料为PorapakQ(0.3mm/0.2mm),柱长2m,内径2mm;载气为高纯氮(99.999%),流速为25mL/min;柱箱温度55℃,CO2测量使用氢火焰离子检测器(FID),温度为200℃,高纯氢气和高纯空气的流速分别为40和400mL/min.
土壤样品呼吸速率的计算公式如下:

(1)
其中R为土壤呼吸速率(μmol·g-1·h-1);22.4为标准状态下(273.2K,1013kPa)气体的摩尔体积(L/mol);T0和P0分别为标准状态时空气的绝对温度(K)和气压(kPa);P为采样时培养瓶内的气压(kPa);T为采样时培养瓶内的绝对温度(K);Δt为密闭时间(h);ΔC为密闭时间内CO2浓度(mg/m3)的增加值;V为培养瓶内的空气体积(L);m为培养土壤的干重(g).
土壤呼吸速率R和土壤温度t(℃)之间的关系公式为:
R=aebt,
(2)
其中,a为温度在0℃时的呼吸速率,b为土壤呼吸的温度敏感性参数.
土壤呼吸对温度的响应,即温度敏感性,通常以Q10(Q10=e10b)表示.为便于比较不同情景下的土壤呼吸,定义20℃时的土壤呼吸速率R20为土壤参考呼吸速率[18-19](R20=ae20t). 微生物对土壤呼吸温度敏感性的影响用公式CTmicro=[Q10(CK2)-Q10(CK1)]/Q10(CK1)表示;碳源质量变化对温度敏感性的影响用公式CTsub=[Q10(CK0)-Q10(CK1)]/Q10(CK1)表示;微生物对温度敏感性的相对贡献用公式:Con(micro)=CTmicro/(CTmicro+CTsub)表示;碳源质量对温度敏感性的相对贡献用公式Con(sub)=CTsub/(CTmicro+CTsub)表示.
1.4数据分析
采用单因素方差分析接种后土壤和未灭菌土壤呼吸速率之间的差异、接种后土壤与未灭菌土壤Q10之间的差异.用元分析检验Rlow+Rhigh与Rhigh+Rlow两类组合及相应CK1的R20间的差异,检验Q10,low+Q10,high和Q10,high+Q10,low两类组合和相应CK1的Q10间的差异.Rlow+Rhigh代表低呼吸速率的底物接种高呼吸的微生物组合,Rhigh+Rlow代表高呼吸速率底物接种低呼吸微生物组合.Q10,low+Q10,high代表低温度敏感性底物接种高敏感性微生物组合, Q10,high+Q10,low代表高敏感性底物接种低敏感性微生物组合.相关参数Q10(CK2)和Q10(CK1)的平均值被用来计算响应比(ResponseRatio,RR),RR=Q10(CK2)-Q10(CK1).相关参数CTmicro和CTsub的平均值被用来计算响应比,RR=CTmicro/CTsub. 所有统计分析均使用SPSS13.0完成,所有数据作图采用Sigmaplot12.0完成.
2 结 果
2.1灭菌及接种后土壤呼吸的变化
表2是不同土壤灭菌后接种自源微生物(CK1)与未灭菌土壤(CK0)参考呼吸的差异.与CK0相比,CK1的R20总体升高了144%.有7个样品的土壤灭菌+接种后呼吸要显著高于未灭菌土壤(P<0.05),其中鹰潭组变化最大,接种后呼吸增长了10倍.即墨,太仓,宜兴3个土样接种前后土壤呼吸的变化不大,差异不显著(P>0.05).兰州土样的呼吸速率在灭菌+接种后降低了34%(P<0.05).

表2 CK0与CK1 的R20比较
图1(a)是CK2中Rhigh+Rlow类组合与接种自源微生物(CK1)处理的参考呼吸间的比较.对于Rhigh+Rlow类组合,CK2参考呼吸速率R20平均降低了15.8%.图1(b)是CK2中Rlow+Rhigh类组合与接种自源微生物(CK1)处理的参考呼吸间的比较,CK2的参考呼吸速率R20比CK1的R20升高了13.9%.
2.2灭菌和接种后土壤呼吸Q10的变化
表3数据显示,土壤灭菌后接种自源微生物(CK1)后呼吸的Q10比未灭菌土壤(CK0)显著降低(P<0.05).其中,武陟、华坪和即墨等3个样品下降最明显,超过了20%;福州、喀什、兰州和宜兴等四个样品变化较小,下降值不超过10%.
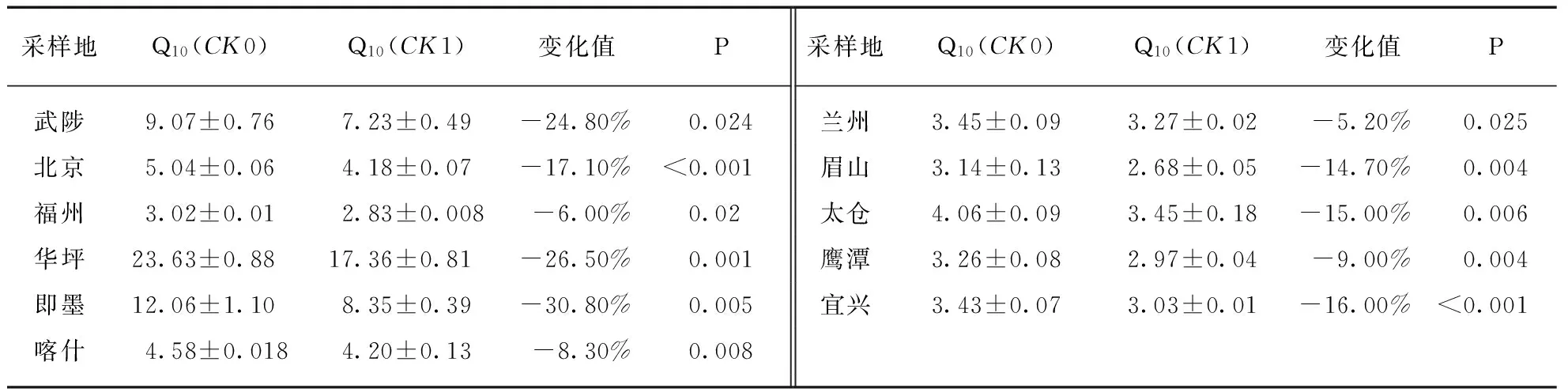
表3 CK0 和CK1的Q10比较
对于Q10, low+Q10, high类组合,绝大多数样品Q10值的变化位于1∶1等值线的上方(图2(a),见第262页),即接种高Q10值的异源微生物使土壤呼吸的Q10值显著增加.而在Q10, high+Q10, low类组合,CK2与CK1间的差异不明显(图2(b)),数据点在1∶1等值线的上下方的分布相近.
图3(见第262页)是用元分析方法对不同组合土壤呼吸Q10值变化的结果.与CK1相比,Q10, low+Q10, high类组合的Q10值显著增加(Mean=0.1906,SE=0.0149,t=12.807,P<0.001),而Q10, high+Q10, low类组合的Q10值虽然降低较少,但在统计上具有显著性(Mean=-0.0663,SE=0.0318,t=-2.082,P=0.041).
2.3微生物和碳源对土壤呼吸Q10的相对贡献
图4显示,土壤的酸碱性对组合实验中Q10变化有显著影响.在pH<7的酸性土壤底物中,碳源变化对温度敏感性的影响CTsub都小于0.2,而微生物变化的影响CTmicro变化介于0~1.0之间,多集中在0~0.3的范围.CTmicro和CTsub的比值绝大部分大于1,说明微生物的影响大于碳源.当土壤底物的pH>7时,碳源改变对Q10值的影响处于0~0.5之间,与改变微生物的影响相似.
统计分析结果显示(图5),在酸性土壤中,微生物对Q10变化的贡献显著高于碳源改变的贡献(Mean=0.5616,SE=0.1076,t=5.221,P<0.001).所有组合中,微生物的平均贡献为63.19%,碳源的平均贡献为36.81%.在碱性土壤中,微生物的贡献要显著低于碳源的贡献(Mean=-0.4976,SE=0.1008,t=-4.934,P<0.001).所有组合中,微生物对Q10变化的平均贡献为41.78%,碳源的平均贡献为58.22%.
3 讨 论
3.1接种本源土壤微生物对土壤呼吸的影响
本研究发现,灭菌后接种原土的样品呼吸值高于未灭菌土样.我们认为是高温高压灭菌后使土壤有机碳质量上升引起的,高温高压会杀死土壤中的微生物,这部分被杀死的微生物会显著增加土壤中的DOC(可溶性有机碳)[20],Marschner&Bredow[21]发现高温高压灭菌后的土壤DOC,比不灭菌土壤增加了一倍.DOC与土壤呼吸之间存在着很强的关联性[22],短期的呼吸速率受底物可利用性如DOC含量控制,即土壤有机碳可利用性越高,呼吸速率越高[23-24].Haei等[25]通过实验发现,土壤呼吸强弱的变化主要来源于不同处理导致的土壤DOC含量变化,两者呈显著正相关.Cleveland[26]认为,在一个12h的培养实验中,土壤有机碳易分解组分随着时间而逐渐减少,有机碳分解速率也随之减小.
3.2接种异源土壤微生物对土壤呼吸的影响
在本研究中各种组合中,土壤灭菌后接种呼吸值高的异源微生物会比接种本源微生物的呼吸值要高;同样,灭菌后接种呼吸低的异源微生物组合土壤呼吸比接种本源微生物的呼吸低;这说明微生物群落的差异是导致土壤呼吸差异的一个关键因素.微生物是土壤呼吸的主要执行者,不同的土壤有着不同的微生物群落结构,影响到土壤呼吸的强弱.有人发现在酸碱性不同的土壤中微生物群落结构会有显著的不同,酸性土壤中的真菌和放线菌往往是以K对策为主的微生物,比土壤细菌更不易受干旱胁迫的影响[27].范分良等[15]发现,不同微生物接种到相同的灭菌土壤后,土壤呼吸出现显著差异,他们把这种差异归结于土壤微生物群落结构的差异.Strickland等[28]发现,相同的植物灭菌残体接种不同的未灭菌土壤后,秸秆的降解速率差异显著.这两组结果与本研究得出的现象相类似,说明微生物是影响着土壤呼吸强弱的一个主要因素.
3.3接种本源微生物对碳分解温度敏感性的影响
在前面已经讨论到高温高压灭菌会带来土壤中易分解碳如DOC含量显著升高,在实验中,我们发现所有土壤样品在灭菌后接种本源微生物相比未灭菌的土壤,Q10值显著降低.我们认为这种降低可能主要是土壤有机碳质量上升引起的.He等[29]曾观测类似的现象,发现Q10的变化主要来源于输入的有机碳及有机碳质量.有很多研究报道,土壤易分解碳的温度敏感性要低于难分解碳[6,30-31].Ågren等[32]从微生物酶促动力学方向研究了温度敏感性与底物质量的关系,认为复杂的有机化合物一般具有较低的分解速度和较高的活化能;随着土壤有机质分子量和分子结构复杂性的增加,促使其发生生化反应所需的能量也增加,因而对温度的敏感性也相应地增加.这些观点与本研究得到的结果相吻合.
3.4接种异源微生物对温度敏感性的影响
我们设计的土壤组合实验,将土壤灭菌后接种异源土壤的微生物,以分离有机底物和微生物的贡献.从实验结果可以看出,微生物部分决定了土壤呼吸的温度敏感性,因为同一土壤底物接种不同的异源微生物后的Q10差异显著.Q10, low土壤底物接种Q10, high微生物后Q10显著增加,反之亦然, 说明微生物是调控土壤碳分解的温度敏感性的主要因子.Lipson[13]的田间原位试验发现,细菌群落随着季节和纬度的变化可导致温度敏感性相应变化.Balser等[14]用PLFA的方法分析了3个土壤的微生物群落结构,同时在不同温度下用BIOLOG方法测得3个微生物群落的温度敏感性显著不同,认为细菌群落的差异决定了呼吸速率和底物利用的格局.Monson等[33]发现,随着雪层厚度变化,土壤呼吸出现的高温度敏感性主要来自于微生物在低温时对土壤有机碳的高利用率,即微生物内在活性的变化引起了温度敏感性的变化.同样有研究发现微生物群落的改变也会影响着温度敏感性,Leifeld等[34]发现土壤呼吸的高温度敏感性主要依赖于土壤pH和土壤碳氮比,而这两者又是控制微生物群落结构的主要因素.
3.5pH对土壤有机碳分解的作用
我们发现,在酸性土壤中微生物对温度敏感性的贡献高于碳源,而在碱性土壤中刚好相反.pH是土壤化学性质的综合量度,它可以改变细胞中的生物大分子的电荷,进而影响微生物活性[35].而且pH还影响土壤微生物群落组成,许多研究发现酸性土壤中不适合细菌生长,真菌和放线菌活性高,而在碱性土壤中细菌的活性更高[36-37].土壤真菌和放线菌主要是K对策者,而细菌更多的是以R对策生长[38].K对策者相比R对策者能利用更多的输入能源来生长和维持生命,在碳循环中同化效率更高[39],真菌对碳的高同化效率,可能使酸性土壤中微生物对温度敏感性的作用比底物的影响要大.
4 结 论
1) 在灭菌土壤底物+微生物接种实验中,低呼吸底物接种异源高呼吸微生物(Rlow+Rhigh)组合使土壤呼吸增高,高呼吸底物接种异源低呼吸微生物(Rhigh+Rlow)组合则使土壤呼吸降低,揭示微生物是影响土壤呼吸的关键因子.同时,土壤灭菌后接种本源微生物后呼吸上升,表明土壤碳源质量越高,呼吸速率也越高.
2) 土壤有机碳分解温度敏感性受碳源和土壤微生物共同决定,在酸性土中微生物对温度敏感性的贡献要大于碳源,而在碱性土中碳源的贡献更大.
[1]JANZENHH.Carboncyclinginearthsystems—asoilscienceperspective[J]. Agriculture Ecosystems & Environment, 2004,104(3):399-417.
[2]SCHLESINGERWH,ANDREWSJA.Soilrespirationandtheglobalcarboncycle[J].Biogeochemistry, 2000,48(1):7-20.
[3]GOULDENML,MUNGERJW,FANSM, et al.Measurementsofcarbonsequestrationbylong-termeddycovariance:Methodsandacriticalevaluationofaccuracy[J]. Global Change Biology, 1996,2(3):169-182.
[4]LONGDOZB,YERNAUXM,AUBINETM, et al.SoilCO2effluxmeasurementsinamixedforest:Impactofchamberdisturbances,spatialvariabilityandseasonalevolution[J]. Global Change Biology, 2000,6(8):907-917.
[5]FANGCM,SMITHP,MONCRIEFFJB, et al.Similarresponseoflabileandresistantsoilorganicmatterpoolstochangesintemperature[J].Nature, 2005,436(7052):881-881.
[6]FIERERN,CRAINEJM,MACLAUCHLANK, et al.Litterqualityandthetemperaturesensitivityofdecomposition[J].Ecology, 2005,86(2):320-326.
[7]KIRSCHBAUMMUF.Thetemperature-dependenceofsoilorganic-matterdecomposition,andtheeffectofglobalwarmingonsoilorganic-Cstorage[J].Soil Biology & Biochemistry, 1995,27(6):753-760.
[8]XUM,QIY.Soil-surfaceCO2effluxanditsspatialandtemporalvariationsinayoungponderosapineplantationinnorthernCalifornia[J]. Global Change Biology, 2001,7(6):667-677.
[9]ZHOUP,LIY,RENXE, et al.Organiccarbonmineralizationresponsestotemperatureincreasesinsubtropicalpaddysoils[J].Journal of Soils and Sediments, 2014,14:1-9.
[10]KIRSCHBAUM,MUF.Seasonalvariationsintheavailabilityoflabilesubstrateconfoundthetemperaturedependenceoforganicmatterdecomposition[J].Global Change Biology, 2013,57:568-576.
[11]CONENF,LIEFIELDJ,SETHB, et al.Warmingmineralizesyoungandoldsoilcarbonequally[J].Biogeosciences, 2006,3:515-519.
[12]DALIASP,ANDERSONJM,BOTTNERP, et al.Temperatureresponsesofcarbonmineralizationinconiferforestsoilsfromdifferentregionalclimatesincubatedunderstandardlaboratoryconditions[J]. Global Change Biology, 2001,7(2):181-192.
[13]LIPSONDA.Relationshipsbetweentemperatureresponsesandbacterialcommunitystructurealongseasonalandaltitudinalgradients[J].Fems Microbiology Ecology, 2007,59(2):418-427.
[14]BALSERTC,WIXONDL.Investigatingbiologicalcontroloversoilcarbontemperaturesensitivity[J].Global Change Biology, 2009,15(12):2935-2949.
[15]范分良,黄平容,唐勇军,等.微生物群落对土壤微生物呼吸速率及其温度敏感性的影响 [J].环境科学,2012,33(3):932-937.
[16]CHENXP,TANGJ,JIANGLF, et al.EvaluatingtheimpactsofincubationproceduresonestimatedQ10valuesofsoilrespiration[J]. Soil Biology & Biochemistry, 2010,42(12):2282-2288.
[17]FANGC,MONCRIEFFJB.ThedependenceofsoilCO2effluxontemperature[J]. Soil Biology & Biochemistry, 2001,33(2):155-165.
[18]BLAGODATSKAYA,E,ZHENGX,BLAGODATSKYS, et al.OxygenandsubstrateavailabilityinteractivelycontrolthetemperaturesensitivityofCO2andN2Oemissionfromsoil[J]. Biol Fertil Soils, 2014,50:775-783.
[19]ALEXANDERG,BADERN,CHENGWX.Effectsofsubstrateavailabilityonthetemperaturesensitivityofsoilorganicmatterdecomposition[J]. Global Change Biology, 2009,15:176-183.
[20]KUZYAKOVY,BLAGODATSKAYAE,BLAGODATSKYS, et al.CommentsonthepaperbyKemmittet al. (2008) ‘Mineralizationofnativesoilorganicmatterisnotregulatedbythesize,activityorcompositionofthesoilmicrobialbiomass—Anewperspective’SoilBiology&Biochemistry40, 61-73:Thebiologyoftheregulatorygate[J].Soil Biology & Biochemistry, 2009,41(2):435-439.
[21]MARSCHNERB,BREDOWA.Temperatureeffectsonreleaseandecologicallyrelevantpropertiesofdissolvedorganiccarboninsterilisedandbiologicallyactivesoilsamples[J].Soil Biology & Biochemistry, 2002,34(4):459-466.
[22]MICHAELSONGJ,PINGCL.SoilorganiccarbonandCO2respirationatsubzerotemperatureinsoilsofArcticAlaska[J]. Journal of Geophysical Research:Atmospheres,2003,108(D2):ALT5-1-ALT5-10.
[23]VANHeesPAW,JONESDL,NYBERGL, et al.Thecarbonwedonotsee-theimpactoflowmolecularweightcompoundsoncarbondynamicsandrespirationinforestsoils:Areview[J].Soil Biology & Biochemistry, 2005,37(1):1-13.
[24]VANHEESPAW,JONESDL,NYBERGL, et al.Modellinglowmolecularweightorganicaciddynamicsinforestsoils[J]. Soil Biology & Biochemistry, 2005,37(3):517-531.
[25]HAEIM,ROUSKJ,ILSTEDTU, et al.Effectsofsoilfrostongrowth,compositionandrespirationofthesoilmicrobialdecomposercommunity[J]. Soil Biology & Biochemistry, 2011,43(10):2069-2077.
[26]CLEVELANDCC,NEMERGUTDR,SCHMIDTSK, et al.Increasesinsoilrespirationfollowinglabilecarbonadditionslinkedtorapidshiftsinsoilmicrobialcommunitycomposition[J]. Biogeochemistry, 2007,82(3):229-240.
[27]ZAKDR,HOLMESWE,MACDONALDNW, et al.Soiltemperature,matricpotential,andthekineticsofmicrobialrespirationandnitrogenmineralization[J].Soil Science Society of America Journal, 1999,63(3):575-584.
[28]STRICKLANDMS,LAUBERC,FIERERN, et al.Testingthefunctionalsignificanceofmicrobialcommunitycomposition[J].Ecology, 2009,90(2):441-451.
[29]HENP,WANGRM,GAOY, et al.ChangesinthetemperaturesensitivityofSOMdecompositionwithgrasslandsuccession:ImplicationsforsoilCsequestration[J].Ecology and Evolution, 2013,3(15):5045-5054.
[30]KNORRW,PRENTICEIC,HOUSEJI, et al.Long-termsensitivityofsoilcarbonturnovertowarming[J].Nature, 2005,433(7023):298-301.
[31]LIUHS.Thermalresponseofsoilmicrobialrespirationispositivelyassociatedwithlabilecarboncontentandsoilmicrobialactivity[J]. Geoderma, 2013,193:275-281.
[32]ÅGRENGI,BOSATTAE.Reconcilingdifferencesinpredictionsoftemperatureresponseofsoilorganicmatter[J]. Soil Biology & Biochemistry, 2002,34(1):129-132.
[33]MONSONRK,LIPSONDL,BURNSSP, et al.Winterforestsoilrespirationcontrolledbyclimateandmicrobialcommunitycomposition[J]. Nature, 2006,439(7077):711-714.
[34]LEIFELDJ,VONLUTZOWM.Chemicalandmicrobialactivationenergiesofsoilorganicmatterdecomposition[J].Biology and Fertility of Soils, 2014,50(1):147-153.
[35]李东坡,武志杰,陈利军.不同施肥黑土微生物量氮变化特征及相关因素 [J].应用生态学报,2004,15(10):1891-1896.
[36]李忠,孙波,林心雄.我国东部土壤有机碳的密度及转化的控制因素 [J].地理科学,2001,21(4):301-307.
[37]朱海平,姚槐应,张勇勇等.不同培肥管理措施对土壤微生物生态特征的影响 [J].土壤通报,2003,34(2):140-142.
[38]唐琨,朱伟文,周文新等.土壤pH对植物生长发育影响的研究进展 [J].作物研究,2013,27(2):207-212.
[39]YAMAMURAS,AMACHIS.Microbiologyofinorganicarsenic:Frommetabolismtobioremediation[J]. Journal of Bioscience and Bioengineering, 2014,118(1):1-9.
A Study on the Temperature Sensitivity of Soil OrganicCarbonDecompositionandUnderlyingMechanisms
SONG Zhuoran1,2, LI Zhaolei1,2, CHEN Xueping1,2, FANG Changming1,2
(1. Institude of Biodiversity Science, School of Lifes Sciences, Fudan University, Shanghai 200438, China;2. Jiangsu Coastal Biological Agriculture Synthetic Innovation Center, Yancheng 224002, China)
Understandingtheregulatingmechanismsofthetemperaturesensitivityofsoilorganiccarbondecompositionisessentialtopredictthefuturechangeofsoilorganiccarbonpoolunderglobalclimatechange.Previousstudieshavereportedthatthequalityoforganiccarbonandsoilmicrobesplaycriticalrolesinorganiccarbondecomposition.However,thetemperaturesensitivity(commonlyreferredtoasQ10)ofsoilrespirationremainsuncertain,andisstillhotlydebated.InthisstudyweperformedanincubationexperimentinthelaboratorytoestimateQ10valuesofsoilheterotrophicrespiration,andtoassesstherolesofmicroorganismandsubstrateinthetemperaturesensitivityofsoilorganicmatterdecomposition.Theresultsandconclusionsofthisstudyaresummarizedasfollows:(1)Weusedsterilizedsoilasacarbonsourceandinoculatedasmallamountoffreshsoilasmicrobialagent.Soilrespirationafterinoculateddifferentmicrobeschangedaccordingly.Wefoundtheformerrespirationratewaslowerthanthatofthelatter,suggestingthatsoilcarbonquality(basedonthecontentofdissolvableorganiccarbon)willaffectsoilrespiration,thehigherqualityofsoilcarbonsource,thestrongerthesoilrespiration. (2)Comparedwithnotsterilizedsamples,theQ10valueofsterilizedsoilafterinoculationofthesamefreshsoilreducedsignificantly.Thisresultprovedthatcarbonsourcequalityplaysanimportantroleonthetemperaturesensitivity,thehighercarbonquality,thelowerQ10ofcarbondecomposition.TheQ10ofsterilizedsoilinoculatedwithmicrobesofhighQ10increasedaccordingly,andtheQ10ofsterilizedsoilinoculatedwithmicrobesoflowQ10decreased.ThisvariationinQ10revealedthatmicroorganismisoneofkeyfactorsaffectingthetemperaturesensitivity.Inacidsoils,thecontributionofmicrobestoQ10wasgreaterthanthatofcarbonsource,with63.2%frommicrobialsourceand36.8%fromcarbonsource.Inalkalinesoils,thecontributionswere41.8%and58.2%,respectively.
soilrespiration;substrate;microorganism; Q10;pH
0427-7104(2016)02-0257-10
2015-05-14
宋卓然(1991—),男,硕士研究生;方长明,男,教授,通讯联系人,E-mail:cmfang@fudan.edu.cn
Q148
A

