CAV1脚手架样结构域多肽抑制HEp2细胞生长的实验研究
顾栋桦,付琳琳,平金良
CAV1脚手架样结构域多肽抑制HEp2细胞生长的实验研究
顾栋桦,付琳琳,平金良
目的研究CAV1脚手架样结构域(CSD)多肽对喉鳞癌细胞株HEp2细胞生长的影响及其机制。方法CSD多肽和乱序多肽由人工合成得到,并在N'末端用生物素标记,用免疫细胞化学法检测CSD多肽在HEp2细胞中的内化情况,细胞生长能力用MTT法检测;流式细胞仪检测HEp2细胞的细胞周期及细胞凋亡;免疫印迹法检测HEp2细胞中Erk1/2蛋白的表达及磷酸化程度。结果免疫细胞化学检测显示CSD多肽能够较好的进入HEp2细胞内;用CSD多肽处理细胞能够明显抑制肿瘤细胞的生长,使更多的细胞处于G0/G1细胞静止期,并能够增加HEp2细胞的凋亡率;CSD多肽不影响HEp2细胞中Erk1/2蛋白的表达,但能明显减少Erk1/2蛋白的磷酸化水平。结论CSD多肽能够抑制HEp2细胞的生长,并且促进其细胞凋亡;Erk1/2蛋白的磷酸化水平下降可能是其重要的分子机制。
Caveilin-1;细胞生长;多肽;鳞状细胞癌
Caveolin-1(CAV1)是一种细胞膜蛋白,是构成细胞膜上一种小凹结构的关键成分。目前研究发现CAV1在细胞膜上的信号转导蛋白活性调节中发挥重要作用,并参与调控细胞的生物学行为。CAV1蛋白具有一个脚手架样结构域(CSD),依赖这个结构可以和许多信号转导相关蛋白结合,抑制蛋白的酪氨酸激酶活性[1]。本研究用体外细胞实验来研究人工合成的CSD多肽对喉鳞癌细胞株 HEp2细胞生长的影响,并探讨CSD多肽做为抗肿瘤药物的可行性。现报道如下。
1 资料与方法
1.1材料与试剂CSD多肽序列由上海翱博生物科技有限公司合成,氨基酸序列为DGI WKA SFT TFT VTK YWF YR,N端连接生物素标记,另外以同样的氨基酸构成乱序排列的乱序多肽WFADGI SKT VRKYWFTFT YT做为阴性对照。多肽用细胞培养液DMEM (Sigma公司,美国)稀释溶解至终浓度4.0 M后处理培养细胞。碱性磷酸酶标记的抗生物素(Biotin)小鼠单克隆抗体(工作浓度1:300)购于美国Jackson Im-
1.2方法
1.2.1免疫细胞化学法检测多肽的细胞渗透能力细胞培养6孔板中放置24 mm×24 mm盖玻片,把处于生长对数期的HEp2细胞接种于6孔板中,当细胞贴壁生长至盖玻片上,细胞密度为70%时,加入CSD多肽,孵育6h后取出盖玻片,用冷丙酮固定10 min,用碱性磷酸酶标记的抗生物素(Biotin)小鼠单克隆抗体37℃孵育2 h,PBS冲洗后加入NBT/BCIP显色。
1.2.2流式细胞仪检测细胞生长至50%汇合时,加入多肽处理6 h后,用胰酶消化细胞制成细胞悬液,用冷柠檬酸缓冲液固定30 min,溴化丙啶染色后流式细胞仪检测细胞周期和凋亡,增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)。实验组分为CSD多肽组、乱序肽组及未处理组,实验重复3次。
1.2.3MTT法检测细胞体外生长细胞消化后,按1 000个/孔密度接种于96孔板中,分为CSD多肽组、乱序肽组及未处理组。在培养的1、2、3、4、5、6、7 d加入MTT 20l/孔,继续闭光培养4 h,弃上清加入150 l/孔二甲基亚砜溶解结晶,在酶联免疫检测仪(Molecular Devices公司)上读取吸光值(A),测定波长490 nm。空白对照孔设为不含细胞的完全培液。每组设4孔,结果取均值,实验重复3次。以时间为横轴,A490为纵轴做细胞生长曲线图。
1.2.4免疫印迹法检测细胞呈生长对数期时,用多肽处理,分组同前,处理48h后收集细胞,裂解细胞提取总蛋白,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)变性电泳,然后将蛋白转移至聚偏二氟乙烯(PVDF)膜上,加入相应的一抗,4℃孵育过夜,用PBS洗涤后,加入过氧化物酶标记的二抗,37℃孵育1 h,最后用ECL法试剂盒按产品说明书步骤显色。条带用 Pro Analyzer4.0软件进行积分吸光度(IA)分析,以 -actin作为内参。所有实验重复3次。
1.3统计方法采用SPSS13.0统计软件进行数据分析,计量资料以均数±标准差表示,CSD多肽组、乱序肽组与未处理组数据分析采用检验。<0.05为差异有统计学意义。

表1 流式细胞仪检测细胞周期及凋亡
2 结果
2.1CSD多肽在 HEp2细胞内渗透能力用CSD多肽处理HEp2细胞6 h后,用免疫细胞学检测生物素标记的 SCD多肽,经NBT/BCIP显色,显微镜下可发现HEp2细胞胞质中内出现蓝紫色颗粒(图1)。
2.2CSD多肽对 HEp2细胞生长的影响用多肽处理HEp2细胞后,用MTT法生成的生长曲线来看(图2),未处理组和乱序多肽组的HEp2细胞在第5天开始进入生长平台期;而用CSD多肽处理的HEp2细胞生长明显减慢,从第2天开始其A490值(0.79±0.13)比未处理组(1.67±0.43)明显降低,差异有统计学意义(=3.38,<0.05),乱序肽组和未处理组差异无统计学意义(=0.34,>0.05)。
2.3CSD多肽对 HEp2细胞的细胞周期和凋亡的影响与未处理组相比,CSD多肽组更多的细胞处于生长静止期(G0/G1期)(=5.02,<0.05),而且S期和G2/M期的细胞比例低于未处理组(=4.06、4.28,均<0.05),乱序肽组和未处理组差异均无统计学意义(均>0.05)。CSD多肽组的细胞凋亡率明显高于未处理组(=4.93,<0.05),而未处理组和乱序肽组差异无统计学意义(=0.17,>0.05)。见表1。
2.4CSD多肽对HEp2细胞Erk1/2蛋白磷酸化的影响用多肽处理24h后,CSD多肽组磷酸化ERK1/2蛋白明显低于未处理组,用 -actin作为内参校正后,CSD多肽组磷酸化ERK1/2蛋白相对表达量为未处理组的61.29%,差异有统计学意义(=2.94,<0.05);未处理组和乱序肽组差异无统计学意义(=0.42,>0.05)。见图3。
3 讨论
CAV1是 caveolae的主要功能蛋白,其基因位于7号染色体q31.1,这个区域是许多肿瘤容易发生丢失的脆性位点,形成的蛋白大小为21~24 kD,其N端第14位氨基酸残基具有酪氨酸磷酸化位点,C端具有棕榈酰化位点,第82 ~101氨基酸序列为CAV1的重要功能区域,具有CSD,依赖这个结构可以和许多信号转导相关蛋白(如EGFR、G蛋白等)结合,抑制其酪氨酸激酶活性,并调节其下游信号转导通路[1]。
近年来的研究结果表明许多肿瘤中存在着 CAV1基因表达及功能的异常,虽然CAV1在不同肿瘤中的作用报道不一,但在一部分肿瘤中,CAV1表现出抑制肿瘤的作用,例如很多肿瘤细胞株的CAV1表达处于低水平状态[2],增加CAV1基因的表达水平可以抑制肿瘤细胞的生长和转移、促进肿瘤细胞的凋亡[3-4]。而且一些肿瘤中,如乳腺癌[5]、肝癌[6]及腺泡状横纹肌肉瘤[7]等肿瘤组织中,CAV1表达水平明显减少,并且CAV1低表达的患者预后更差。Jung等[8]的研究中,CAV1阴性的头颈部鳞癌更易发生上皮-间质转化,更容易发生转移,并且预后不良。笔者前期的研究发现HEp2细胞高表达CAV1基因后,肿瘤细胞的生长能力能明显被抑制[9],说明CAV1在喉鳞癌细胞中可能起着抑癌基因的作用。

图1 免疫细胞化学法检测(NBT/BCIP显色,×400)
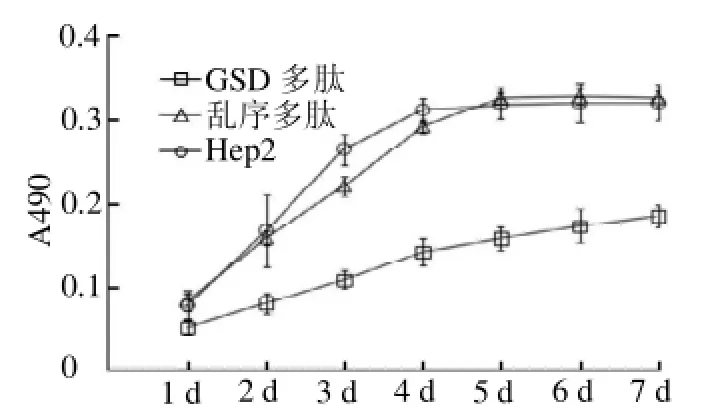
图2 细胞生长曲线

图3 免疫印记法检测蛋白表达水平
CAV1蛋白的脚手架结构是它发挥生物学功能的重要结构,Tahir等[10]用CSD肽处理前列腺癌细胞,能够有效地减少肿瘤新生血管的生成、抑制肿瘤的生长。本研究结果表明,用合成的CSD多肽能够顺利渗入HEp2细胞内。用CSD多肽处理HEp2细胞,能明显抑制细胞的生长,更多的细胞处于生长静止期,并且细胞凋亡率也明显上升。结果说明利用CAV1的CSD氨基酸序列体外合成的多肽能够发挥其生物学效应,并且抑制HEp2细胞的生长,并促进凋亡。
细胞的生长受许多信号转导通路的调节,胞外信号调节激酶(ERK)是丝裂原活化蛋白激酶家族的成员,是调节细胞生长和发育信号网络的重要环节[11],目前研究表明CAV1能够与上皮生长因子受体(EGFR)结合,并能够抑制期下游Erk1/2蛋白的磷酸化程度[1]。本研究结果显示用CSD多肽处理HEp2细胞后,细胞 Erk1/2蛋白的磷酸化水平明显下降,提示CSD多肽抑制HEp2细胞生长可能与降低 Erk1/2蛋白磷酸化水平以及相关的生长信号通路被抑制有关。
综上所述,体外合成的CSD多肽能够有效进入HEp2细胞内,并且能够抑制HEp2细胞的生长,促进肿瘤细胞的凋亡,CSD多肽还能抑制Erk1/2蛋白的磷酸化水平,其抑制细胞生长能力可能和 Erk1/2蛋白相关的生长信号通路被抑制有关,CSD多肽的抑制肿瘤的功能及具体的分子机制还有待深入研究。
[1]Sohn J,Brick RM,TuanRS.Fromembryonic development to human diseases:The functional role of caveolae/caveolin[J].BirthDefectsResCEmbryoToday,2016,108 (1):45-64.
[2]LamazeC,TorrinoS.Caveolaeandcancer: Anewmechanical perspective[J].Biomed J,2015,38(5):367-379.
[3]ZhangK,YangG,Wu W,et al.Decreased Expression of Caveolin-1 and E-Cadherin Correlates with the Clinicopathologic Features of Gastric Cancer and the EMT Pro cess[J].RecentPatAnticancerDrugDiscov,2016,11(2):236-244.
[4]Quann K,Gonzales DM,Mercier I,et al. Caveolin-1 is a negative regulator of tumor growth in glioblastoma and modulates chemosensitivity to temozolomide[J].Cell Cycle,2013,12(10):1510-1520.
[5]黄杰,廖湘晖,彭丽娇.窖蛋白-1和埃兹蛋白在乳腺癌组织中的表达及其与预后的关系[J].中华实验外科杂志,2013,30(6):1281-1282.
[6]王冰,王欣,徐明丽.窖蛋白-1和RhoE在肝癌癌变过程中表达及其临床意义 [J].中华实验外科杂志,2014,31(8):1805-1807.
[7]Juan HM,Santiago RV,David HM,et al. Caveolin-1 is down-regulated in alveolar rhabdomyosarcomas and negatively regulates tumor growth[J].Oncotarget,2014,5(20):9744-9755.
[8]JungAC,Ray AM,Ramolu L,et al.Caveolin-1-negative head and neck squamous cell carcinoma primary tumors display increasedepithelialtomesenchymaltransition andprometastatic properties[J].Oncotarget,2015,6(39):41884-41901.
[9]顾栋桦,唐峰,王震,等.caveolin-1对喉鳞状细胞癌生物学特性的影响[J].中华肿瘤杂志,2007,29(5):329-333.
[10]TahirSA,ParkS,ThompsonTC.Caveolin-1 regulates VEGF-stimulated angiogenic ac tivitiesinprostatecancerandendothelialcells [J].CancerBiolTher,2009,8(23):2286-2296. [11]Kim EK,Choi EJ.Compromised MAPK signaling in humandiseases:an update[J]. Arch Toxicol,2015,89(6):867-882.
10.3969/j.issn.1671-0800.2016.07.049
R739.6;R392
A
1671-0800(2016)07-0937-03
湖州市科技计划项目(2012YSB19、2013GYB11)
313000浙江省湖州,湖州市中心医院
顾栋桦,Email:donghuagu @sohu.communoResearch公司,兔抗人Erk1/2多克隆抗体(工作浓度1:1 000)、兔抗人磷酸化Erk1/2多克隆抗体(工作浓度1:1000)购自美国cell signaling公司,鼠抗人 -actin单克隆抗体(工作浓度1:1000)购自美国Sigma公司,过氧化物酶标记的二抗(工作浓度1:2 000)购于上海鼎国公司,5-溴-4-氯-3-吲哚基-磷酸盐/四唑硝基蓝(NBT/BCIP)购于瑞士Roche公司,ECL法试剂盒购于美国Pierce公司。细胞株及培养条件:人喉鳞癌细胞HEp2细胞购于美国ATCC公司,细胞在37℃、5%CO2、饱和湿度的条件下用含10%胎牛血清(hyclone公司,美国)的无菌DMEM培养基培养,细胞生长至70%~80%细胞密度时传代。
2016-03-22(本文编辑:陈志翔)

