骨髓间充质干细胞促进皮肤创口愈合及W n t信号通路在愈合过程中的作用
王志红,黄汉,张斌,马竞,张佳
(1.辽宁医学院 研究生学院,辽宁 锦州 121001;2.辽宁医学院附属第一医院 口腔科,辽宁 锦州 121001)
论著
骨髓间充质干细胞促进皮肤创口愈合及W n t信号通路在愈合过程中的作用
王志红1,黄汉2,张斌2,马竞2,张佳1
(1.辽宁医学院 研究生学院,辽宁 锦州 121001;2.辽宁医学院附属第一医院 口腔科,辽宁 锦州 121001)
目的研究骨髓间充质干细胞(B M S C s)对皮肤创口愈合及W n t信号通路在愈合过程中的作用。方法原代培养S p r a g u e D aw l y大鼠B M S C s并C D29、C D44、C D90、C D45细胞表面标志物鉴定;构建SD大鼠皮肤创口损伤模型;实验分组:磷酸缓冲盐溶液(P B S)对照组、B M S C s组,分别将P B S、B M S C细胞皮下注射到创口周围,观察创口愈合情况,计算创口愈合率;蛋白免疫印迹法检测W n t1和β-c a t e nin基因表达水平。结果第3代B M S C s形态多为梭形、多突形。B M S C s可均一表达C D29、C D44、C D90,其阳性率分别为87.29%、91.66%和76.18%;而C D45呈阴性,其阳性率为3.14%。B M S C s可显著促进大鼠创口愈合;B M S C s组大鼠创面愈合率均高于P B S组,差异有统计学意义。蛋白免疫印迹结果B M S C s促进W n t1和β-c a t e nin基因蛋白表达。结论B M S C s能促进创口愈合,其促进作用可能与W n t信号通路有关。
骨髓间充质干细胞;伤口愈合;信号通路
口腔颌面部外伤、肿瘤等常可造成大面积创伤缺损、瘢痕,严重者可致面部外形改变,由于位置特殊,常给患者造成巨大心理压力。常规的皮肤、组织瓣等移植治疗有许多条件限制,难以满足目前临床需要。骨髓间充质干细胞(bone marro w mesenchymal stem cells,B M S C s)属于多潜能干细胞,具有多向分化潜能,在特定诱导条件下可分化成多种组织细胞,能够作为理想的种子细胞用于组织器官损伤修复。
1 材料与方法
1.1动物与试剂
实验所用S pra g u e Da w ly大鼠(以下简称S D大鼠)雄鼠由辽宁医学院动物中心提供。达尔伯克必需基本(d u lbecco's minim u m essential medi u m,D M E M)低糖培养基购自美国H yclone公司,胎牛血清购自美国H yclone公司,W nt1、β-链蛋白(β-catenin)抗体购自上海万类生物公司。
1.2SD大鼠BMSCs的原代培养
选取同一时期繁殖的4只200 g左右S D雄鼠,10%水合氯醛按0.3ml/100 g腹腔注射麻醉,75%酒精浸泡消毒,超净台内取双侧股骨,分离去除骨表面附着组织。剪开一侧骨骺,暴露髓腔,用含20%胎牛血清的D M E M完全培养基自另一侧骺端反复冲洗骨髓腔,将冲洗液收集到10 cm培养皿中,吹打混匀,置于37℃、5%二氧化碳C O2、饱和湿度的培养箱中培养。
3 d后首次更换培养基,每48 h更换培养基,直至细胞融合至90%,0.25%胰蛋白酶消化,按1∶3接种于新的培养皿,2~3 d更换培养基,选择形态均一、生长状态良好的继续传代,第3~5代培养的B M S C s用作实验收集细胞。
1.3细胞鉴定
取第3代骨髓间充质干细胞,0.25%胰酶消化,离心收集细胞,加磷酸缓冲盐溶液(phosphate b uff er saline,P B S)吹打成细胞悬液,调整密度为1×106/ml,加入到已标记抗体(C D29、C D44、C D90、C D45)的流式管中,37℃孵育30min,离心收集细胞,留沉淀,P B S漂洗3次,P B S重悬细胞,流式细胞仪检测并分离含B M S C s阳性表面标志物的细胞继续培养用于后续实验。
1.4皮肤创口损伤模型制备及处理
S D雄鼠20只,随机分成两组。经10%水合氯醛麻醉后,背部剃毛,用无菌眼科剪在一侧背部做直径2 cm左右的全层皮肤损伤模型,将P B S、分离纯化后的B M S C s分别皮下注射到两组大鼠创口周围,模型制备当天记为第1天,分别于1、7和14d观察创口愈合情况,计算创面愈合率。创面愈合率(%)=(开始创伤面积-未愈合创面面积)/开始创伤面积。
1.5蛋白免疫印迹法
14 d麻醉处死实验大鼠,沿创口周围2mm处剪下创口皮肤全层,取下的组织经研磨、裂解,提取蛋白样品。蛋白浓度测定后,样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,半干法转至聚偏二氟乙烯膜上。一抗4℃过夜,三羟甲基氨基甲烷缓冲盐溶液(tris b uff ered saline and t w een 20,T B S T)洗3次,二抗室温1 h,化学发光法检测蛋白表达。
1.6统计学方法
采用S P SS 17.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,各组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1第3代大鼠骨髓间充质干细胞
B M S C s细胞形态多为梭形、多突形,其中混杂圆形的造血细胞。细胞培养5~7 d细胞融合可>90%;传代细胞24 h内基本贴壁,之后细胞单克隆复制多呈束状或漩涡状排列。见图1。
2.2BMSCs表面标记物鉴定流式细胞仪的检测
第 3代大鼠的 B M S C s可均一表达 C D29、C D44、C D90,其阳性率分别为87.29%、91.66%和76.18%;而C D45呈阴性,其阳性率为3.14%。
2.3大鼠创口愈合过程

图1 第3代大鼠骨髓间充质干细胞 (×100)
3组实验大鼠7和14 d时创口愈合情况比较,B M S C s组大鼠创口愈合明显较P B S组快,B M S C s可显著促进大鼠创口愈合(见图2)。B M S C s组7和14 d大鼠创面愈合率分别为(86.464±1.278)%和(90.062±0.172)%均明显高于P B S组的(41.972± 1.621)%和(61.664±2.477)%,经用单因素方差分析,差异有统计学意义(P=0.000)(见图3)。
2.4蛋白免疫印迹法检测
B M S C s组W nt1和β-catenin基因蛋白表达水平高于P B S组。见图4。
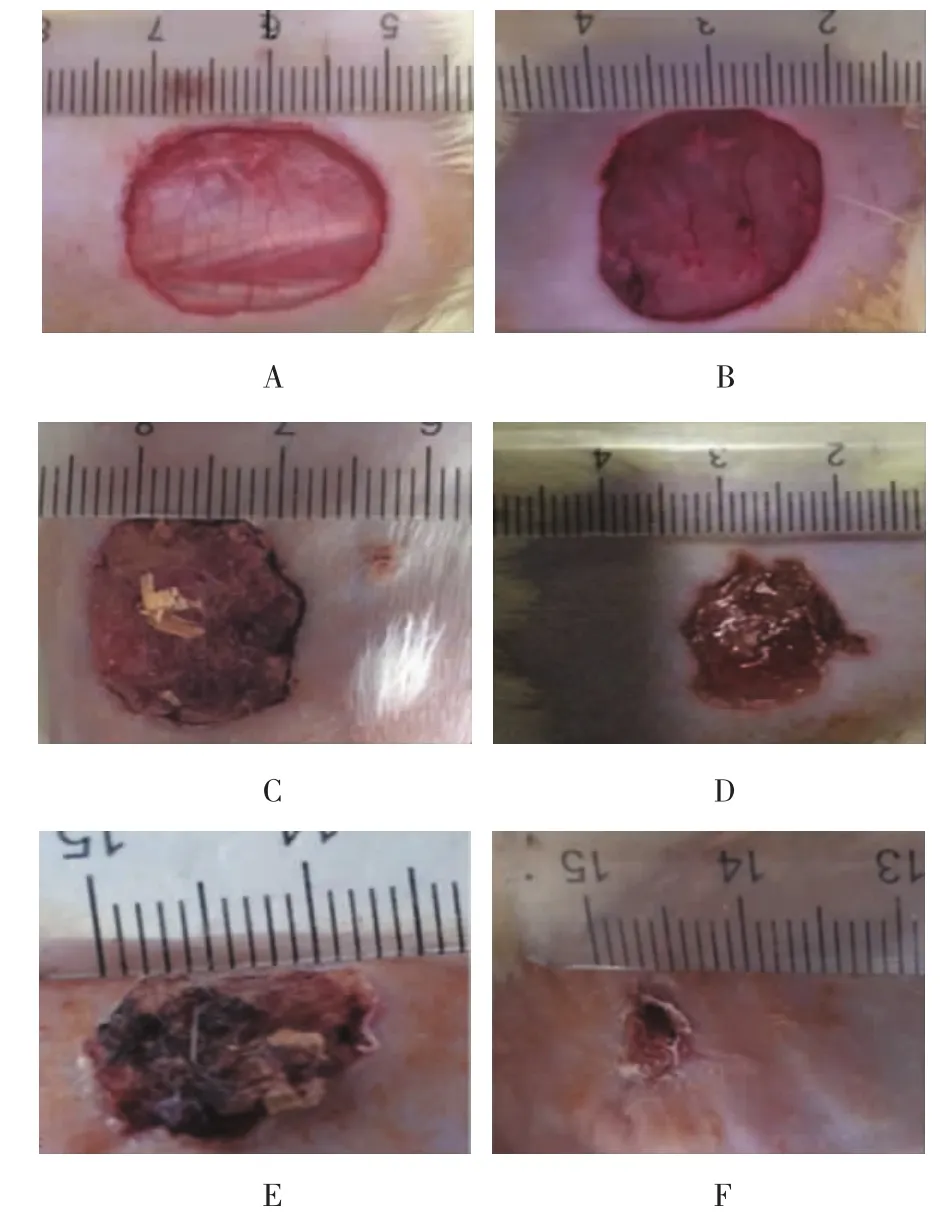
图2 大鼠创口愈合过程
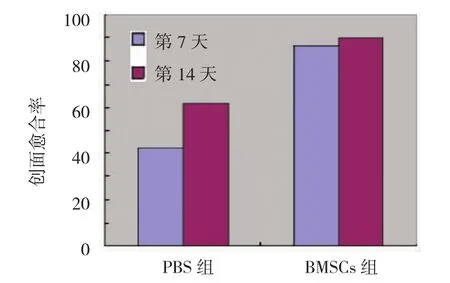
图3 大鼠创口愈合率

图4 免疫印迹法检测W n t1和β-c ate n i n蛋白表达水平
3 讨论
皮肤创口愈合是一个涉及多种细胞、多种因子的修复、重建过程[1],是各种组织再生和肉芽组织增生、瘢痕组织形成的复杂组合,表现出各种过程的协同作用。大致包括炎症、增殖和重塑阶段[2]。长期的皮肤创口愈合不良对患者生活、工作具有重大影响,是临床研究的重点与热点。近年来,随着分子生物学的发展,人们对皮肤创面愈合机制的研究也逐渐深入。
B M S C s属于多能干细胞,具有多向分化潜能、造血支持、免疫调控和自我复制等特点。在特定诱导条件下,体内或是体外培养的B M S C s可分化为骨、软骨、内皮、心肌等多种组织细胞,能够用于衰老病变组织器官的损伤修复。B M S C s在骨髓中的含量很少,约占有核细胞的0.001%~0.100%[3],原代培养B M S C s通过换液去除大量未贴壁的造血细胞,呈圆形或类圆形的贴壁细胞传代培养后形态多为梭形、多突形。本研究中,原代培养的B M S C s可大量扩增并传代,且经鉴定第3代大鼠的B M S C s可均一表达C D29、C D44、C D90,其阳性率分别为87.29%、91.66% 和76.18%;而C D45呈阴性,其阳性率为3.14%。
B M S C s可显著促进实验大鼠创口愈合,且创面愈合率明显高于对照组。B M S C s促进创口愈合的具体机制目前仍不完全清楚。其可能机制有:①B M S C s的自我更新能力和多向分化能力可长期保持,其可在创面局部增生并分化为创面修复所需的细胞,如角质形成细胞、毛囊细胞、皮脂腺细胞、汗腺细胞等[4-5]。②促进皮肤网状嵴样结构形成。③B M S C s的旁分泌作用。许多研究表明,B M S C s可分泌大量促进创面愈合的生长因子[6]。④免疫调理作用。⑤B M S C s可能还有促进体内干细胞迁移到伤口局部、减轻纤维化、保持细胞外基质内环境平衡及减少细胞凋亡等作用[7]。
大量实验研究表明,W nt蛋白家族参与细胞增殖、凋亡、分化等多种生物学过程[8],并参与维持干细胞的多潜能性等。W nt信号通路是一条高度保守的信号通路,由W nt蛋白及其受体、调节蛋白等组成。W nt信号通路主要有3条途径:①经典W nt/β-catenin通路,又称为经典W nt通路;②W nt/PCP通路,又称平面细胞极性信号通路;③W nt/C a2+通路。其中,最被熟知的是经典W nt/β-catenin通路,而W ntl是激活经典W nt信号通路的主要W nt蛋白[9-10]。有研究证实,经典W nt信号通路中的相关成员参与创面愈合[11],其参过程可能与其具有调控皮肤及其附属器的发育、诱导皮肤附件的形态发生、促进创面血管新生及上皮重塑等多种功能有关。免疫印迹检测结果表明,B M S C s能促进W nt1和β-catenin基因蛋白表达水平,激活经典W nt/β-catenin,促进创口愈合。
B M S C s能够有效促进大鼠皮肤创伤愈合,为临床治疗提供实验依据。但B M S C s实际应用到临床仍有一些不足之处。自体和同种异体干细胞移植治疗均已有致瘤报道,例如干细胞移植后致皮肤恶性肿瘤、胃癌、成骨肉瘤等[12]。并且B M S C s还可促进宿主体内原有肿瘤的生长[13]。另外,B M S C s体外移植后能否继续保持未分化状态、是否能起到长期的作用效果还需要进一步探索。因此,B M S C s治疗创口愈合的临床应用还有待进一步评估。
[1]L EE S H,Z A HOO R M,HW A N G JK,et al.V alproic acid ind u ces c u taneo u s w o u ndhealin ginv i v oandenhances k eratinocyte motility[J].P L o S O ne,2012,7(11):D O I:10.1371/j o u rnal.pone.0048791.
[2]M END O C AR J,C OU T I N HO-NETT OJ.C ell u lar aspects o f w o u nd healin g[J].A n B ras Dermatol,2009,84(3):257-262.
[3]祝旭龙,颜谭,姚维杰,等.大鼠骨髓间充质干细胞的分离与培养方法优化[J].南方医科大学学报,2014,34(11):1621-1626.
[4]M A K,L I A O S,H E L,et al.E ff ects o f nano f iber/stem cell composite on w o u nd healin g in ac u te fu ll-thic k ness s k in w o u nds[J]. Tiss u e En g P art A,2011,17(9/10):1413-1424.
[5]WU Y,C H EN L,S C O TT P G,et al.M esenchymal stem cells enhance w o u nd healin g thro u g h di ff erentiation and an g io g enesis[J]. S tem C ells,2007,25(10):2648-2659.
[6]HO C K I N G A M,GI B R A N N S.M esenchymal stem cells:paracrine si g nalin g anddi ff erentiationd u rin g c u taneo u s w o u nd repair[J]. E x p C ell R es,2010,316(14):2213-2219.
[7]B A R A N I A K P R,MC DE V I TT D C.S tem cell paracrine actions and tiss u e re g eneration[J].R e g en M ed,2010,5(1):121-143.
[8]IG O T A S,T O S A M,M U R A K A MI M,et al.I denti f ication and characteri z ation o f W nt si g nalin g path w ay in k eloid patho g enesis[J]. I nt J M ed S ci,2013,10(4):344-354.
[9]H L UB E K F,B R A B L ET Z T,BU D C Z I E S J,et al.H etero g eneo u s e x pression o f W nt/beta-catenin tar g et g enes w ithincolorectal cancer[J].I nt J C ancer,2007,121(9):1941-1948.
[10]M A N O L A G A S S C,A L M E I D A M.G one w ith the W nts:betaeatenin,T-cell f actor,f or k head bo x O,and o x idati v e stress in a g e-dependent diseases o f bone,lipid,and g l u cose metabolism[J]. M olEndoerinol,2007,21(11):2605-2615.
[11]K A T OH M,K A T OH M.W NT si g nalin g path w ay and stem cell si g nalin g net w or k[J].C lin C ancer R es,2007,13(14):4042-4045.
[12]H E R B E R T S C A,KW A M S,H E R M S EN H P.R is k f actors in the de v elopment o f stem cell therapy[J].J Transl M ed,2011,9: 29.
[13]L A Z ENNE C G,JO R G EN S EN C.C oncise re v ie w:ad u lt m u ltipotent stromal cells and cancer:ris k or bene f it[J].S temC ells,2008,26(6):1387-1394.
(童颖丹 编辑)
Effect of bone marrow mesenchymal stem cells on skin wound healing and role of W nt signaling pathway in healing process
Zhi-hong Wang1,Han Huang2,Bin Zhang2,Jing Ma2,Jia Zhang1
(1.Graduate School of Liaoning Medical University,Jinzhou,Liaoning 121001,China;2.Department of Stomatology,the First Affiliated Hospital of Liaoning Medical University,Jinzhou,Liaoning 121001,China)
Objective To study the effect of bone marrow mesenchymal stem cells(BMSCs)on skin wound healing and the role of Wnt signaling pathway in the healing process.M ethods Primary cultured BMSCs were from SD rats.CD29,CD44,CD90 and CD45 cell surface markers were identified.SD rat skin wound healing model was constructed.Experimental groups included PBS control group and BMSCs group,in which the PBS and BMSCs were injected subcutaneously around the wound respectively.Wound healing was observed and the rate of wound healing was calculated.Using Western blot Wnt1 andβ-catenin expression levels were detected. Results The third-generation BMSCs were fusiform and multi-shaped with protrusions.BMSCs could uniform ly express CD29,CD44 and CD90,the positive rates were 87.29%,91.66%and 76.18%respectively;the positive rate of CD45 was only 3.14%.BMSCs could significantly promote wound healing in the rats.The wound healing rate of the BMSCs group was significantly higher than that of the PBS group,and the BMSCs promoted Wnt1 andβ-catenin protein expressions.Conclusions BMSCs can promote wound healing,which may be related to the promotion of the role of Wnt signaling pathway.
bone marrow mesenchymal stem cell;wound healing;signal pathway
R 683
A
10.3969/j.issn.1005-8982.2016.15.010
1005-8982(2016)15-0056-04
2015-12-18
黄汉,E-mail:k q2015525@163.com;Tel:0416-4197262

