磷酸化蛋白激酶样内质网激酶、C/E BP同源蛋白在慢性间歇低氧大鼠肺组织中的表达变化及意义*
张嘉宾,张盼盼,王红阳,寇育乐,王玲
(华北理工大学附属医院 呼吸科,河北 唐山 063000)
论著
磷酸化蛋白激酶样内质网激酶、C/E BP同源蛋白在慢性间歇低氧大鼠肺组织中的表达变化及意义*
张嘉宾,张盼盼,王红阳,寇育乐,王玲
(华北理工大学附属医院 呼吸科,河北 唐山 063000)
目的探讨慢性间歇低氧(C I H)大鼠肺组织中磷酸化的蛋白激酶样内质网激酶(p-P E R K)、CC AAT增强子结合蛋白(C/EB P)同源蛋白(C H O P)表达变化及意义。方法将60只大鼠随机分成正常组(U C组)、C I H组,每组各自分成3、7、14、21和28 d 5个时间亚组。采用H E法观察U C组和C I H组大鼠肺组织病理形态变化;采用免疫组织化学法检测p-P E R K、C H O P蛋白表达及两者的相关性;采用逆转录-聚合酶链反应(R T-P C R)方法检测两组大鼠肺组织C H O P mR NA表达。结果①C I H组肺泡壁及间质轻度水肿,少量炎症细胞浸润,肺泡结构紊乱,部分肺泡融合;U C组大鼠肺组织无明显病理变化。②C I H组肺组织p-P E R K、C H O P蛋白表达高于U C组,于21 d表达最高。③C I H组肺组织C H O P mR NA表达高于U C组,于21 d表达最高。④P-P E R K、C H O P表达的上调呈正相关。结论慢性间歇低氧可引起肺组织损伤,而p-P E R K、C H O P蛋白的活化表达在慢性间歇低氧大鼠肺组织的损伤中可能存在一定的作用。
阻塞性睡眠呼吸暂停低通气综合征;慢性间歇低氧;磷酸化蛋白激酶样内质网激酶;C/EB P同源蛋白;肺损伤
阻塞性睡眠呼吸暂停低通气综合征(obstr u cti v e sleep apnea-hypopnea syndrome,O S A H S)是以反复发生的低氧/复氧过程为特征的睡眠障碍性疾病[1],使人体在睡眠过程中处于慢性间歇低氧(chronic intermittent hypo x ia,CI H)状态,目前已知这种特殊模式的低氧可对人体的多个系统造成损害,如心脑血管疾病、认知功能障碍、内分泌系统疾病及肝损害等[2-3]。而缺氧是诱导内质网应激反应(endoplasmic retic u l u m stress response,E RS)的重要外界因素之一[4]。磷酸化的蛋白激酶R样内质网激酶(phosphorylatedprotein k inaser li k eE Rk inase,p-P E R K)、CC AA T增强子结合蛋白(C/E B P)同源蛋白(C HO P)是参与E RS的重要因子,当E RS持续存在时细胞外受体激酶磷酸与葡萄糖调节蛋白78(g l u cose-re g ulated protein 78,G R P78)解离,发生自身联合,自身磷酸化而激活,p-P E R K磷酸化真核翻译起始因子重组人真核起始因子2-α(e uk aryotic initiation f ac tor 2-α,e I F2a),继而选择性地增加活化转录因子4 (acti v atin g transcription f actor 4,A T F4)m R N A的表达,最终上调促凋亡因子C HO P的表达,导致细胞凋亡[5]。本课题通过建立CI H大鼠模型,模拟O S A H S患者睡眠过程中的低氧状态,探讨E RS相关因子p-P E R K、C HO P在CI H大鼠肺组织的表达变化,阐述p-P E R K、C HO P蛋白的表达在CI H大鼠肺损伤发生过程中的作用,为临床治疗及预防O S A H S患者肺组织损伤提供实验基础。
1 材料与方法
1.1慢性间歇低氧模型的建立及分组
采用随机数字表法将60只W istar大鼠随机分成正常组(U C组)、CI H组。每日于相同时间,将CI H组大鼠置于有机玻璃饲养箱内,首先,给予氮气30 s(氧浓度低至5%),流速压力为0.15MP a;其次,注入空气40 s(恢复氧浓度至21%),流速压力控制在0.8 MP a;再次,继续注入空气50 s(氧浓度维持在21%),流速压力0.8MP a,使低氧箱内氧浓度在5%~21%间形成周期交替,每120 s为1个循环周期,造成间歇低氧条件。将U C组大鼠每日于相同时间置于与5%CI H组相同的有机玻璃饲养箱内,持续注入空气120 s,流速压力为0.8MP a,氧气浓度维持在21%。两组大鼠生活条件及饲养条件相同。两组分别在建立模型的3、7、14、21和28 d随机选取6只大鼠处死备用。
1.2方法
各组大鼠以10%水合氯醛(300m g/k g)腹腔注射麻醉后,开胸暴露心脏和双肺。室温肝素生理盐水经左升主动脉将心脏血液快速冲洗干净,取出双肺,再次用生理盐水冲洗2遍后,将左侧肺浸入4%多聚甲醛中固定,石蜡包埋、切片,用于H E染色及免疫组织化学法染色;将右侧肺组织置入-80℃冰箱冷冻保存,用于逆转录聚合酶链反应(re v erse transcription polymerase chain reaction,R T-PC R)检测C HO P m R N A。
1.3病理形态观察
4%多聚甲醛固定肺组织,常规石蜡包埋、切片,经二甲苯脱蜡、梯度乙醇脱水、苏木精-伊红染色法(hemato x ylin-eosin stainin g,H E)染色,光镜下观察病理形态变化。
1.4免疫组织化学法检测各组肺组织p-P E R K、C H OP蛋白的表达
分别于3、7、14、21和28 d的两组大鼠中随机抽取2张切片,经3%过氧化氢溶液浸润10min去除内源性过氧化物酶,按照免疫组织化学法试剂盒说明书进行操作。运用M otic医学图像分析系统对结果进行分析,以每张切片的积分光密度值(inte g ral optical density,I O D)代表蛋白相对表达水平,每张切片在×200镜下随机选取5个视野,检测I O D值,取平均值作为样本。
1.5RT-PCR法检测C H OP m RN A的表达
C HO P基因引物序列的设计与合成由上海生物工程有限公司完成。于冰上取冻存的右侧肺组织,每份样本约30m g,严格按照R N A提取试剂盒(日本Ta K a R a公司)提取m R N A,并检测其浓度,将提取的R N A进行琼脂糖凝胶电泳判断所提取的R N A有无降解,根据逆转录试剂盒(日本Ta K a R a公司)合成cDN A,再按照扩增试剂盒(Ta K a R a)操作步骤进行扩增,C HO P cDN A正反向引物各取0.4μl(其中正向引物为:5'-C TT C T C T GGC TT GGC T G A C T-3',反向引物为:5'-T CCC TT GG T C TT CC T CC T C T-3'),之后一次添加产物片段,cDN A模板2.0μl、R O X1 0.4μl以及荧光(避光)10μl,将以上混合物按照以下条件进行扩增:95℃预变性30 s,95℃变性5 s,60℃退火31 s,共40个循环。分别得到扩增曲线、熔解曲线及待测样本表达量,应用R otor-G ene 3000分析软件判断熔解曲线特异性及扩增曲线是否为阳性;采用2-△△ct相对定量分析法计算两组C HO P m R N A的相对含量。1.6统计学方法
采用S P SS 16.0统计软件对数据进行分析,计量资料以均数±标准差(x±s)表示,多组间比较用单因素方差分析,若方差齐则用两两比较t检验,用P earson相关性分析法分析p-P E R K与C HO P表达的关系,P<0.01为差异有统计学意义。
2 结果
2.1两组大鼠肺组织病理形态的变化
CI H组大鼠肺组织水肿,肺泡间隔增宽,部分肺泡融合成较大的含气囊腔,肺泡腔可见出血和蛋白渗出物,毛细血管床可见炎症细胞浸润;与CI H组比较,U C组无明显病理变化。实验结果说明慢性低氧环境可造成大鼠肺组织损伤。见图1。
2.2免疫组织化学法检测两组大鼠肺组织p-P E R K、C H OP蛋白表达的变化


图1 大鼠肺组织病理形态 (H E×200)
光学显微镜下观察阳性细胞,阳性细胞胞浆呈棕黄色或浅黄色。U C组仅见少量散在阳性表达,CI H组阳性细胞表达明显增多,主要集中在肺泡上皮细胞。U C组各时间亚组p-P E R K、C HO P蛋白的表达未见明显差异;与U C组比较,CI H组各时间点p-P E R K、C HO P蛋白表达I O D值均高于U C组(P<0.05)。p-P E R K、C HO P蛋白表达I O D值均随间歇低氧时间延长呈逐渐上升趋势,其中p-P E R K蛋白表达28 d最高,而C HO P蛋白表达21 d最高,21与28 d比较差异无统计学意义(P>0.05)。结果说明,慢性间歇低氧环境可使大鼠肺组织p-P E R K、C HO P蛋白表达升高。见图2、3和表1、2。
2.3RT-PCR法检测C H OP m RN A表达的变化

图2 大鼠肺组织p-P E R K表达(免疫组织化学法×200)
U C组各时间亚组C HO P m R N A的表达未见明显变化;与U C组比较,CI H组各时间点C HO P m R N A的表达增强(P<0.05),且C HO P m R N A的表达随慢性间歇低氧时间的延长呈逐渐增强趋势,于21 d表达最高,21与28 d比较,差异无统计学意义(P>0. 05)。结果说明慢性间歇低氧可使大鼠肺组织C HO P m R N A的表达升高。见图4和表3。

图3 大鼠肺组织C H OP表达(免疫组织化学法×200)
表1 UC组与C I H组p-P E R K蛋白表达I OD值比较(n=6,)
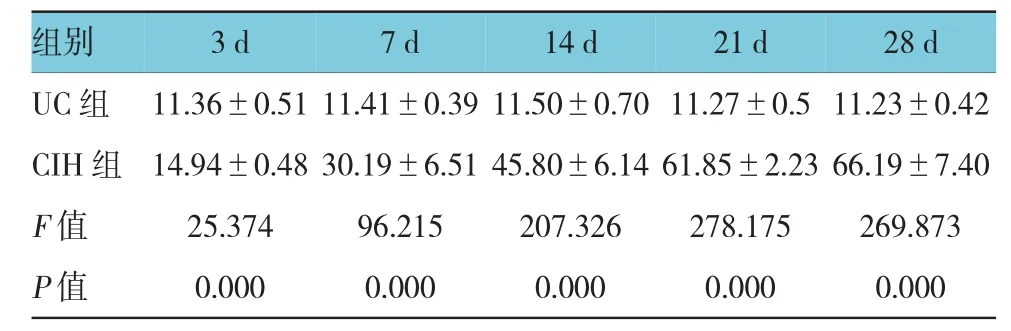
表1 UC组与C I H组p-P E R K蛋白表达I OD值比较(n=6,)
组别2 8 d U C组 1 1 . 3 6 ± 0 . 5 1 1 1 . 4 1 ± 0 . 3 9 1 1 . 5 0 ± 0 . 7 0 1 1 . 2 7 ± 0 . 5 1 1 . 2 3 ± 0 . 4 2 C I H组 1 4 . 9 4 ± 0 . 4 8 3 0 . 1 9 ± 6 . 5 1 4 5 . 8 0 ± 6 . 1 4 6 1 . 8 5 ± 2 . 2 3 6 6 . 1 9 ± 7 . 4 0 F值 2 5 . 3 7 4 9 6 . 2 1 5 2 0 7 . 3 2 6 2 7 8 . 1 7 5 2 6 9 . 8 7 3 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 3 d 7 d 1 4 d 2 1 d
图4 大鼠肺组织C H OP m RN A表达
表2 UC组与C I H组C H OP蛋白表达I OD值比较(n=6,)
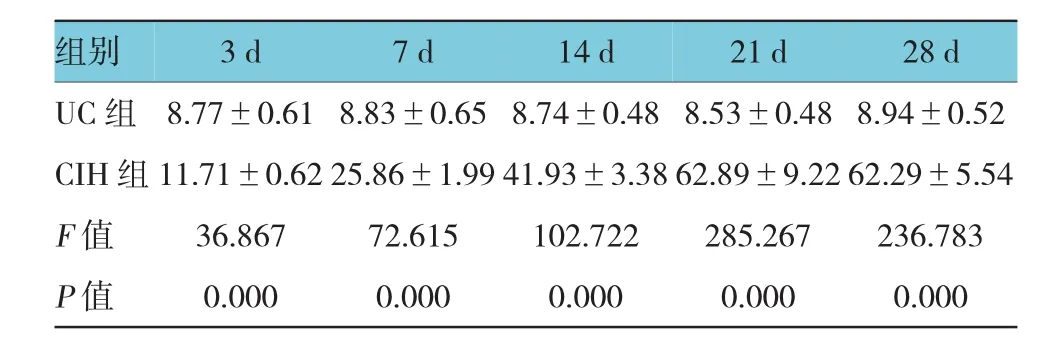
表2 UC组与C I H组C H OP蛋白表达I OD值比较(n=6,)
组别2 8 d U C组 8 . 7 7 ± 0 . 6 1 8 . 8 3 ± 0 . 6 5 8 . 7 4 ± 0 . 4 8 8 . 5 3 ± 0 . 4 8 8 . 9 4 ± 0 . 5 2 C I H 组1 1 . 7 1 ± 0 . 6 2 2 5 . 8 6 ± 1 . 9 9 4 1 . 9 3 ± 3 . 3 8 6 2 . 8 9 ± 9 . 2 2 6 2 . 2 9 ± 5 . 5 4 F值 3 6 . 8 6 7 7 2 . 6 1 5 1 0 2 . 7 2 2 2 8 5 . 2 6 7 2 3 6 . 7 8 3 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 3 d 7 d 1 4 d 2 1 d
表3 UC组与C I H组C H OP m RN A表达水平比较(n=6,)
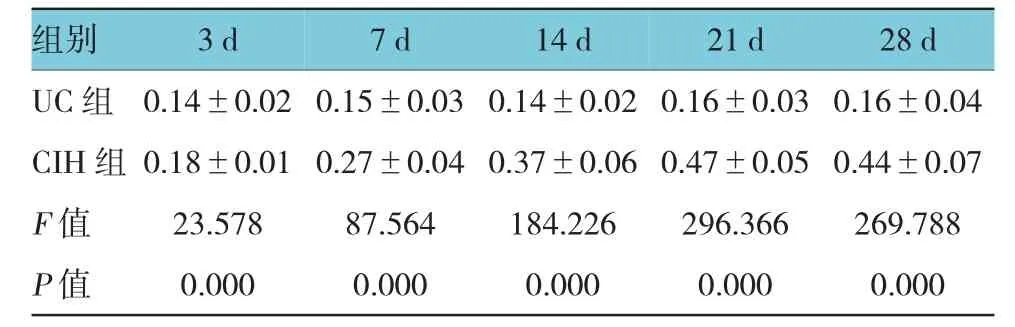
表3 UC组与C I H组C H OP m RN A表达水平比较(n=6,)
组别2 8 d U C组 0 . 1 4 ± 0 . 0 2 0 . 1 5 ± 0 . 0 3 0 . 1 4 ± 0 . 0 2 0 . 1 6 ± 0 . 0 3 0 . 1 6 ± 0 . 0 4 C I H 组 0 . 1 8 ± 0 . 0 1 0 . 2 7 ± 0 . 0 4 0 . 3 7 ± 0 . 0 6 0 . 4 7 ± 0 . 0 5 0 . 4 4 ± 0 . 0 7 F值 2 3 . 5 7 8 8 7 . 5 6 4 1 8 4 . 2 2 6 2 9 6 . 3 6 6 2 6 9 . 7 8 8 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 3 d 7 d 1 4 d 2 1 d
2.4大鼠肺组织p-P E R K蛋白与C H OP表达的相关性分析
模型组大鼠肺组织p-P E R K与C HO P蛋白表达I O D值呈正相关(r=0.937,P=0.000)。
3 讨论
O S A H S是呼吸科常见的睡眠障碍性疾病,有近4%的人受其影响,有着较高的发病率及死亡率。研究证实,O S A H S增加了神经认知性疾病、代谢性疾病及心血管疾病的发生风险[6-7]。关于O S A H S对肺组织影响的研究甚少,CI H为O S A H S独特的病生理改变,通过建立CI H模型,模拟O S A H S患者睡眠过程中的低氧状态,探讨O S A H S对肺组织的影响,实验结果显示,CI H组大鼠肺泡壁间隔增宽,部分肺泡结构破坏、融合,间质充血、水肿,同时伴有少量炎症细胞浸润,说明CI H这种独特的低氧模式可引起大鼠肺组织损伤。
内质网是细胞代谢和蛋白折叠、修饰及转运的中心场所,当细胞遭受缺氧、能量耗竭、钙超载等外界刺激时,可诱导E RS的发生[8-10]。E RS参与多种疾病的发生、发展过程,如神经退行性疾病、多发性硬化症及糖尿病等[11-12],目前其机制研究认为,E RS状态下,大量未折叠或错误折叠的蛋白质在内质网腔内堆积,激活下游信号通路,引起一系列的偶联反应来应对内质网应激反应,该反应统称为未折叠蛋白反应(u n f old protein response,U P R)[13]。E RS持续存在时,U P R不能缓解内质网应激状态,U P R中一些促凋亡信号通路被激活,分别为P E R K、活化转录因子6、人X盒结合蛋白13条信号通路,该3条信号通路均可激活C HO P蛋白,从而诱导细胞凋亡[14-16]。然而目前关于E RS对CI H大鼠肺组织的影响研究较少。
P E R K通路是U P R中最先被激活也是最主要的信号通路。P E R K可诱导胰岛B细胞凋亡、加重神经元损伤、加重缺血再灌注损伤等[17-18]。免疫组织化学法结果提示随间歇低氧时间的延长,p-P E R K、C HO P蛋白在肺组织的表达均呈现逐渐升高趋势,且两者的升高趋势一致,分别在28 d组和21 d组表达最多,21与 28 d组比较表达无明显变化;同时R T-PC R结果显示C HO P m R N A表达随间歇低氧时间的延长表达逐渐升高,在21 d组表达最高,与28 d组比较表达无明显变化。实验结果说明,CI H这种特殊的低氧模式可能诱导E RS的发生,而p-P E R K、C HO P蛋白的表达趋势呈正相关,进一步说明CI H大鼠肺组织损伤可能与E RS激活P E R K通路,诱导C HO P蛋白高表达,从而介导细胞凋亡有相关性。
综上所述,慢性间歇低氧可以引起肺组织损伤,而内质网应激反应相关因子p-P E R K、C HO P可能参与慢性间歇低氧肺组织的损伤过程,为临床预防及治疗慢性间歇低氧造成的肺损伤提供靶点,同时也为诊治O S A H S患者继发的肺部疾病提供实验基础。
[1]JU L I A N G S,O L I V E I R A DE,F A V A R O V M,et al.C hronic intermittent hypo x ia increases encodin g pi g ment epitheli u m-deri v ed f actor g ene e x pression,altho u g h not that o f the protein itsel f,in the temporal corte x o f rats[J].J B ras P ne u mol,2015,41(1):39-47.
[2]王玲,张盼盼,王红阳,等.线粒体自噬对间歇低氧早期大鼠认知功能影响的初探[J].中华结核和呼吸杂志,2014,37(11):840-844.
[3]刘志娟,郝青林.氧化应激在O S A H S合并代谢综合征作用机制研究进展[J].临床肺科杂志,2011,16:1437.
[4]王琪,段冷昕.内质网应激中G R P78和A T F4-C HO P-P u ma信号通路与帕金森病的关系及其治疗靶点的研究进展[J].神经药理学报,2013,3(3):20.
[5]K A P OO R A,S A N Y A L A J.Endoplasmic retic u l u m stress and the u n f olded protein response[J].C lin L i v er Dis,2009,13(4):581-590.
[6]P A S C H ETT A E,B E L IC P,A L I S I A,et al.O S A S-related inf lammatory mechanisms o f li v er in j u ry in nonalcoholic f atty li v er disease[J].M sdiators I n f lamm,2015,2015:1-10.
[7]DE W A N N A,N I ET O F J,S O M E RS V K.I ntermittent hypo x emia and O S A:implicationa f or comorbidities[J].C hest,2015,147(1): 266-274.
[8]L UO K,C A O S S.Endoplasmic retic u l u m stress in intestional epithelial cell fu nction and in f lammatory bo w el disease[J].G as troenterol R es P ract,2015,2015:328791.D O I:10.1155/2015/ 328791.
[9]U L I A N IC H L,I N S A B A T O L.Endoplasmic retic u l u m stress in endometrial cancer[J].F ront M ed(L a u sanne),2014,1:55.
[10]刘蜜,刘秀华.内质网应激与心血管疾病[J].国际病理科学与临床杂志,2011,31(4):305-309.
[11]Y A N G E S,B A E J Y,K IM T H,et al.I n v ol v ement o f endoplasmic retic u l u m stress response in oro f acial in f lammatory pain [J].E x p Ne u robiol,2014,23(4):372-380.
[12]HU A N G L,X I E H,L I U H.Endoplasmic retic u l u m stress,diabetes mellit u s,and tiss u e in j u ry[J].C u rr P rotein P ept S ci,2014,15(8):812-818.
[13]JU N G E J,A V L I Y A KU L OV N K,BOO NT H E U N G P,et al. P ro-o x idati v e DE P chemicals ind u ce heat shoc k proteins and an u n f oldin g protein response in a bronchial epithelial cell line as determined by D IG E analysis[J].P roteomics,2007,7(21):3906-3918.
[14]刘宝琴,王华芹.内质网应激与未折叠蛋白反应的研究进展[J].中华肿瘤防治杂志,2010,17(11):869-872.
[15]U Z I D,B A R D A L,S C A I E W IC Z V,et al.Endoplasmic retic ul u m(Er)stress and the u n f olded protein response(U pr)are ma j or re g u lators o f acetaminophen(A pap)-ind u ced hepato x icity[J]. H epatolo g y,2011,59(3):495-503.
[16]L I G,M O N GI LL OM,T HO R PE,et al.U P R-ind u ced macropha g e apoptosis in v ol v es a no v el C HO P-E R o x idase-calciu m/C a M KⅡ-R O S path w ay.A rteriosclerosis Thrombosis and-V asc u lar B iolo g y,2008.28(6):E52-E53.
[17]W A N G C,C U A N Y,Y A N G J.C yto k ines in the propression o f pancreatic-cell dys fu nction[J].I nt J Endocriol,2010,10:136.
[18]宋洋,袁宜勤,郁洁.内质网应激P E R K凋亡通路研究进展[J].中华中医药学刊,2013,31(5):1009-1011.
(申海菊 编辑)
Expression and significance of p-PERK and CHOP protein in lung tissue of rats in chronic interm ittent hypoxia*
Jia-bin Zhang,Pan-pan Zhang,Hong-yang Wang,Yu-le Kou,Ling Wang
(Department of Respiratory Diseases,the Affiliated Hospital,North China University of Science and Technology,Tangshan,Hebei 063000,China)
Objective To investigate the changes of RNA-dependent protein kinase-like endoplasmic reticulum kinase(p-PERK)and CCAAT enhancer binding protein(C/EBP)homology protein(CHOP)expression in lung tissue of rats with chronic intermittent hypoxia(CIH).Methods Wistar rats were selected to produce a sleep rat model with chronic intermittent hypoxia.Sixty rats were randomly divided into normal group (UC)and CIH group;and each group was separated into 3-d,7-d,14-d and 21-d and 28-d five subgroups. HE method was used to observe the pathological changes of the rat lung tissue in the control and model groups.Immunohistochemical method was used to detect the p-PERK and CHOP expressions and their correlation was analyzed.RT-PCR was adopted for detection of CHOP mRNA expression in the rat lung tissue of the two groups.Results In the CIH group,there were mild edema and a small amount of inflammatory cell infiltration in the alveolar walls and interstitium,alveolar structure disorder,and partial alveolar fusion;while there were no obvious pathological changes of rat lung tissue in the UC group.The expressions of p-PERK and CHOP in the CIH group was higher than those in the UC group,the expression levels on the 21st d were the highest.The expression of CHOP mRNA in the lung tissue of the CIH group was higher than thatin the lung tissue of the UC group,which was the highest on the 21st d.The up-regulated p-PERK and CHOP expressions were in a positive correlation.Conclusions Chronic intermittent hypoxia can cause lung injury;and the up-regulated expressions of p-PERK and CHOP may play certain roles in the injury of lung tissue in rats with chronic intermittent hypoxia.
obstructive sleep apnea-hypopnea syndrome;chronic intermittent hypoxia;phosphorylated protein kinase-like ER kinase;CCAAT enhancer binding protein(C/EBP);lung tissue
R 563.9
A
10.3969/j.issn.1005-8982.2016.15.007
1005-8982(2016)15-0038-06
2015-08-12
河北省自然科学基金(No:H2014209231)
王红阳,E-mail:tsmy w hy@163.com;Tel:15383056835

