HPLC-MS/MS测定唾液中华法林浓度及其与血药浓度关系的探讨
王 政,李 哲,李 靖,杨春秀,张 健,沈 素,余俊先,王汝龙(.首都医科大学附属北京友谊医院药学部,北京 00050;.首都医科大学附属北京友谊医院医疗保健中心,北京 00050)
HPLC-MS/MS测定唾液中华法林浓度及其与血药浓度关系的探讨
王政1,李哲1,李靖2,杨春秀1,张健2,沈素1,余俊先1,王汝龙1(1.首都医科大学附属北京友谊医院药学部,
北京 100050;2.首都医科大学附属北京友谊医院医疗保健中心,北京 100050)
目的:建立唾液中华法林浓度的HPLC-MS/MS分析方法,并探讨其与血药浓度的关系。方法:采用HPLC法,色谱柱为SB-C18柱(2.1 mm×50 mm,1.8 µm),流动相为乙腈(A)/0.1%甲酸水溶液(B),流速0.4 mL·min-1,梯度洗脱;质谱采用ESI正离子模式。待测样本为服用华法林患者的唾液及血浆(均于服药后12 h采集)。结果:目标化合物华法林与内标BA-TPQ的离子质荷比(m/z)分别为309.1→163和278→91.1,二者洗脱分离完全,保留时间分别为1.828 min和1.566 min。华法林的提取回收率稳定,日内、日间精密度RSD < 15%。待测样本的唾液华法林浓度为5.44 ng·mL-1,5.70 ng·mL-1和8.79 ng·mL-1,与其对应的血浆样品浓度为626.04 ng·mL-1、735.51 ng·mL-1、1 206.79 ng·mL-1。结论:本文建立的HPLC-MS/MS检测方法,可用于临床华法林的药物浓度监测,探索性的结果表明华法林的唾液浓度与血浆浓度的消除成平行关系,可考虑作为替代监测指标之一。
华法林;HPLC-MS/MS;唾液;血浆;血药浓度
华法林是目前应用最广泛的香豆素类口服抗凝药,通过抑制肝脏中依赖维生素K的凝血因子来发挥作用,用于预防和治疗深静脉血栓、肺栓塞、心脏瓣膜置换术及心房颤动导致的血栓形成,降低心肌梗死复发及心肌梗死后血栓栓塞死亡的危险性[1-2]。华法林的治疗窗窄、个体差异大,影响因素多,遗传变异和种族差异是剂量个体化的最主要原因[3-4]。华法林抗凝疗效与患者术后出血或栓塞并发症、远期生存质量及生存率密切相关[5],因此服药患者的抗凝监测十分重要,监测不当可导致出血或栓塞等并发症, 严重者可危及患者生命[6]。
国际标准化比值(INR)法因校正了试剂敏感性的差异,使测定结果能相对较准确地反映抗凝强度,在临床上广泛使用。寻求一种无创、快捷、简便、灵敏、准确的分析方法和简便的样品采集装置已日渐引起研究者的关注,唾液为非创伤性采集的体液样本,采集方便,且可避免因抽血带来的身体不适、晕血及感染等[7]。为此我们参考已有的关于华法林血浆药物浓度的测定方法[8],尝试建立唾液中华法林浓度测定方法学,以期为其临床药物监测提供参考。
1 材料与方法
1.1药品和试剂
华法林(分析纯,纯度97.2%,批号45706-250MG-R, Sigma-Aldrich公司);内标物:BA-TPQ(纯度98%)[8];乙腈、甲醇、甲酸均为色谱纯,乙酸乙酯为分析纯,其他试剂均为市售分析纯。
1.2仪器和分析参数
1.2.1主要仪器 HPLC-MS/MS系统,包括1200液相色谱(二元泵、脱气机、自动进样器、柱温箱等)和6460三重四级杆质谱(美国Agilent公司);BS 124S分析天平(德国Sartorius公司);MS-3涡旋器(德国IKA公司);Sigma 3-18K低温离心机(德国Sartorius公司)。
1.2.2HPLC-MS/MS参数设置 色谱柱为SB-C18柱(2.1 mm × 50 mm,1.8 μm,美国Agilent公司);流动相:乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱:0 ~ 1 min 50% A,1 ~ 2 min 90% A,2 ~ 3 min 50% A;流速:0.4 mL·min-1;柱温:40 ℃。离子源为电喷雾离子源ESI,正离子模式;毛细管电压5 kV;干燥气流速8 L·min-1;干燥气温度350 ℃;雾化气压力30 psi;碎裂电压50 V,详见表1。选择的检测离子质荷比(m/z):华法林:309.1→163;BA-TPQ:278→91.1。
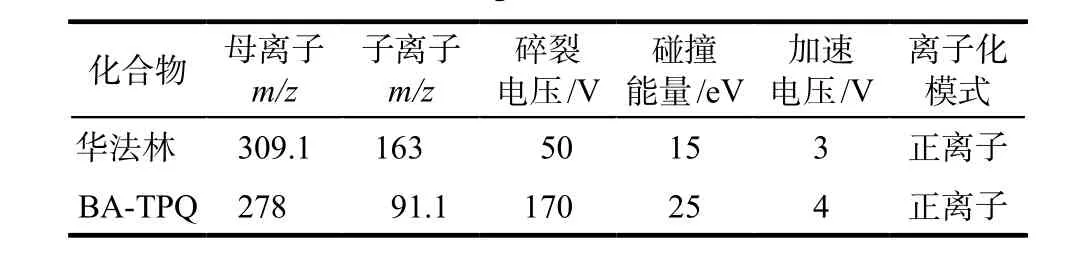
表1 华法林和内标的HPLC-MS/MS参数Tab 1 HPLC-MS/MS parameters of warfarin and IS
1.3方法学考察
1.3.1工作液、标准曲线及质控样品的配制 工作液:精密称取华法林10 mg和内标BA-TPQ 5 mg,以甲醇为溶剂配制成1 mg·mL-1的储备液及1 μg·mL-1的内标液。以甲醇为溶媒,将储备液分别稀释成50 ng·mL-1、100 ng·mL-1、250 ng·mL-1、500 ng·mL-1、2.5 μg·mL-1、5 μg·mL-1、10 μg·mL-1、30 μg·mL-1的工作液。取工作液5 μL,分别用空白唾液和空白血浆稀释配制标准曲线,唾液L1-L8为1、2、5、10、50、100、200、600 ng·mL-1,低、中、高三个质控样品的浓度为2、40、500 ng·mL-1,血浆的L1-L8为10、20、50、100、200、500、1000、3000 ng·mL-1。
1.3.2样品的预处理 取含药唾液500 μL,加入5 μL内标液以及500 μL乙酸乙酯,涡旋60 s使样品充分混匀,低温离心机在4℃的条件下高速离心20 min (18 000 g),上层有机相用氮气吹干,用100 μL流动相复溶,取2 μL进样HPLC-MS/MS分析。取含药血浆50 μL,加入5 μL内标液以及500 μL乙酸乙酯,其余步骤同上,氮气吹干后以100 μL流动相复溶,取2 μL定量分析。
1.3.3回收率、准确度、精密度和基质效应 取浓度为2、40、500 ng·mL-1的质控样品,每个浓度平行处理3份,预处理方法同“1.3.2”项下操作,考察提取回收率。每个浓度平行处理5份,考察日内和日间精密度。用流动相配制低、中、高3个浓度样品,加入内标,测得响应值A;在空白唾液提取后加入相同质控和内标,测响应值B,基质效应ME% = 响应值B/响应值A×100%。
1.3.4稳定性考察 三个浓度的质控样品按“1.3.2”项下方法预处理,考察进样器中放置24 h的稳定性,以及样品经3次冻融循环于室温放置24 h和低温(- 20 ℃)储存2周的稳定性。
1.4受试者样品检测
临床试验经北京友谊医院伦理委员会批准。纳入3例冠心病患者,2男1女,年龄75 ~ 81岁,华法林服药方法均为3 mg,qd。服药后12 h采取唾液2.0 mL,同时取静脉血2.0 mL置于EDTA离心管中,3000 r·min-1,离心10 min,分离血浆备用。唾液和血浆样品按“1.3.2”项下方法预处理,分别测定唾液和血浆中华法林的浓度。
2 结果
2.1方法学专属性
在上述条件下进行检测,华法林和BA-TPQ的保留时间分别为1.828 min和1.566 min,空白唾液和血液中内源性物质无干扰,具有较好的专属性。详见图1。
2.2线性范围、回收率和基质效应
唾液中华法林浓度在1 ~ 600 ng·mL-1范围内线性关系良好,线性方程为y = 15.713 1 x + 0.001 9(r = 0.999 7)。空白血浆中华法林浓度在10 ~ 3000 ng·mL-1范围内线性关系良好,线性方程为y = 0.876 x + 0.017 8 (r = 0.994 2)。相对标准偏差RSD可评估回收率及基质效应。结果表明华法林在唾液中的回收率稳定在83.19% ~ 102.29%,RSD在±15%以内。基质效应在83.41% ~ 102.71%,RSD在±15%以内,对MS信号不产生干扰。
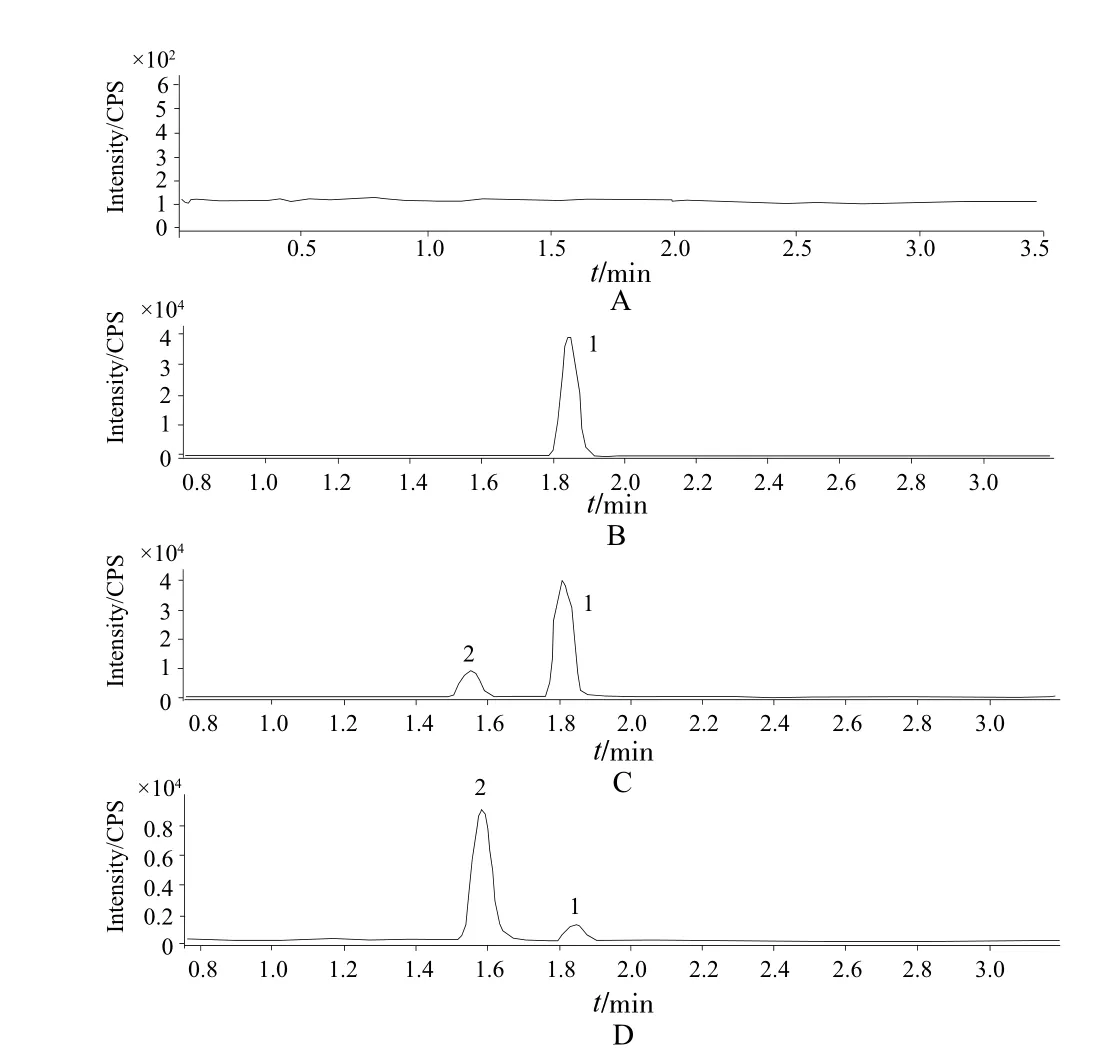
图1 HPLC-MS/MS色谱图A - 空白唾液,B - 空白唾液+华法林(200 ng·mL-1),C - 空白唾液+华法林(200 ng·mL-1) +内标物BA-TPQ( 1 μg·mL-1),D - 受试者唾液样品;1 - 华法林,2 - 内标(BA-TPQ)Fig 1 Chromatograms of HPLC-MS/MS A - blank saliva, B - blank saliva + warfarin (200 ng·mL-1), C - blank saliva + warfarin (200 ng·mL-1) + BA-TPQ (1 μg·mL-1), D - saliva sample of patient; 1 - warfarin, 2 - internal standard( BA-TPQ)
2.3准确度和精密度考察
对高中低三种浓度的质控样本在连续3 d内进行准确度和精密度的验证(n = 5,3,3)。RSD可用于评估精密度,准确度是实际浓度平均值与理论浓度的比值,准确度和精密度需要保持在±15%,详见表2。
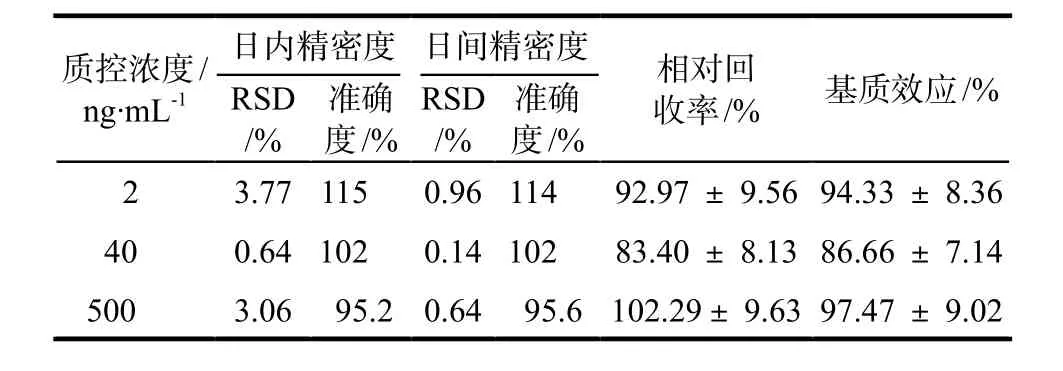
表2 精密度、回收率和基质效应Tab 2 The precision, recovery and matrix effect
2.4稳定性
反复冻融稳定性和短期稳定性实验结果表明,华法林在反复冻融的条件下以及在进样器中放置24 h稳定,详见表3。
2.5受试者唾液及血液中华法林浓度测定
收集3例长期服用华法林患者(编号Sample A、 Sample B、Sample C)唾液及血液,按“1.3.2”项下方法处理样品并检测浓度。结果如下,3例患者唾液中华法林浓度分别为5.44、5.70、8.79 ng·mL-1,与其对应的血液中华法林浓度分别为626.04、735.51、1 206.79 ng·mL-1。将唾液中华法林浓度与其血药浓度进行对比,结果详见图2。
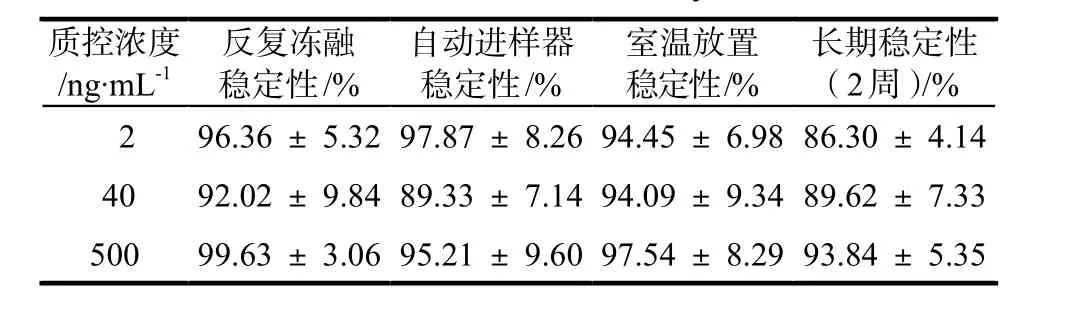
表3 稳定性实验结果Tab 3 The results of stability tests
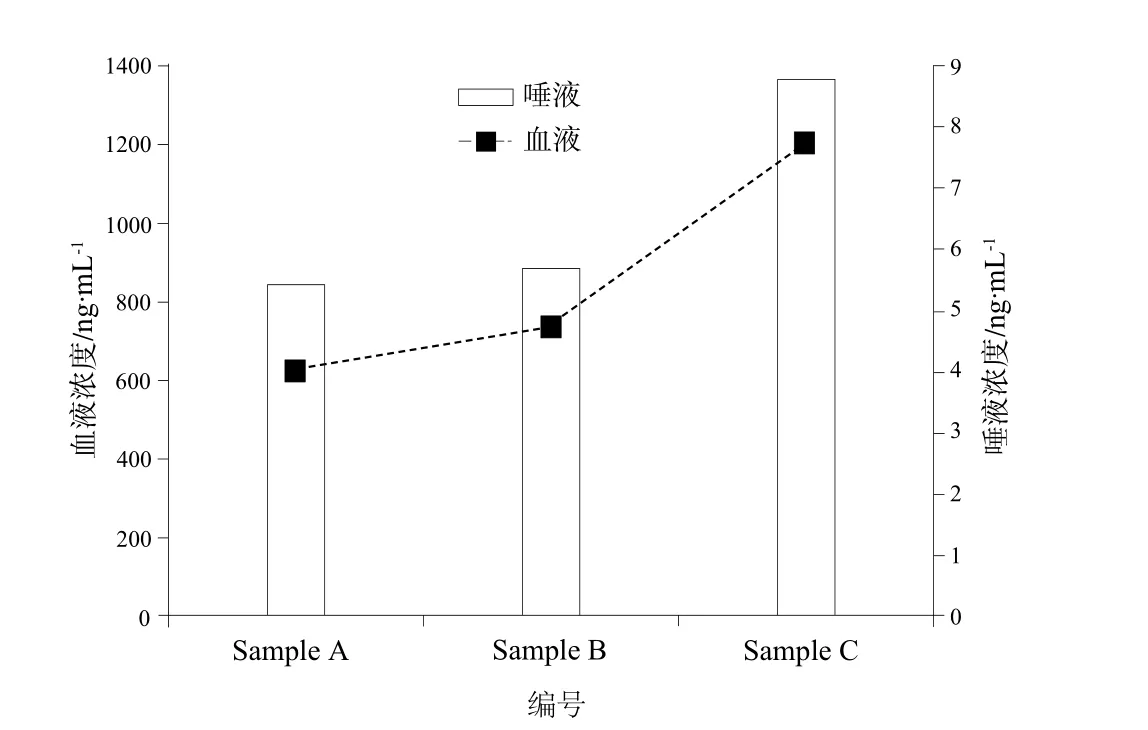
图2 受试者唾液和血浆中华法林的浓度分布Fig 2 Distribution of warfarin concentration in patients' saliva and plasma
3 讨论
3.1INR监测的特点
华法林临床应用特点是治疗窗窄、不良反应严重、个体差异大,因此服药患者的抗凝监测十分重要。许多服用华法林的患者年龄较大,更有脑梗后偏瘫卧床者,定期到医院抽血监测INR及血药浓度对患者而言较为麻烦。然而,未按指南推荐时间测定INR有可能导致抗凝强度不足或发生出血等不良反应[9]。因此,本课题组利用唾液这个取材简便且又无创的体液,借助HPLC-MS/MS等多种大型仪器建立新的方法学,以期为治疗药物监测提供新思路。
3.2唾液中华法林浓度测定的可行性
本研究结果显示,唾液中华法林在1 ~ 600 ng·mL-1浓度范围内线性关系良好,r = 0.999 7,且日间精密度、日内精密度及冻融稳定性均符合要求,故本实验方法学准确、可靠、稳定。我们测定所收集的三个样本,将华法林在患者唾液中的浓度和血浆中的浓度进行对比,二者具有相关性,与预测结果相符合。即血浆中华法林浓度较高者其唾液中含药量也较高,这为日后建立成熟的唾液法监测华法林浓度提供了理论基础。
本次试验在方法学设计上主要有以下几点优势:1)采用乙酸乙酯液-液萃取法除蛋白,与蛋白沉淀法相比更为彻底[9],使基质对测试的影响更小;2)采用梯度洗脱可保证在前1分钟内洗脱出大量生物样本中的水溶性杂质,又可在尽可能短的时间内(4 min)完成全部洗脱,节省试验时间;3)质谱条件调试合理,既有较高分离度,又满足了唾液中微量华法林的测定要求,定量下限(LLOQ)可达到1 ng·mL-1,并可保证其准确度,为此次试验提供了良好的灵敏性。
3.3唾液中华法林浓度测定的局限性
唾液中药物检测受到采集技术与方法、药物特性、给药途径、个体差异(年龄、机体生理疾病、情绪状态)等因素的影响较大[10-12],因此仍需逐步建立唾液采集标准方法和检测标准。在未来的治疗药物监测中,唾液所具有的采集方便、操作简单的突出优势必将使其受到更多的重视,检测技术日臻得到完善,最终更好地为临床服务。
[1] Ansell J, Hirsh J, Poller L, et al. The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy[J]. Chest, 2004, 126(3 Suppl): 204S-233S.
[2] 宁红,杨敏,周捷.62例深静脉血栓患者华法林用药分析[J].药物流行病学杂志,2015,24(9):547-550.
[3] 刘俊,栾家杰,徐文科,等.中国汉族人群基于临床特征和基因型华法林个体化给药模型的研究[J].中国临床药理学与治疗学,2014,19(3):284-289.
[4] 彭娟,谭胜蓝,周宏灏,等.华法林药物基因组学和个体化用药[J].中国药理学通报,2013,29(2):169-172.
[5] Tan SL, Li Z, Zhang W, et al. Cytochrome P450 oxidoreductase genetic polymorphisms A503V and rs2868177 do not signifcantly affect warfarin stable dosage in Han-Chinese patients with mechanical heart valve replacement[J]. Eur J Clin Pharmacol,2013, 69(10): 1769-1775.
[6] 张晋萍,徐虹.1例房颤患者服用华法林期间INR值异常波动的药学监护[J].中国药物应用与监测,2013,10(5):271-273.
[7] 李秋红,刘杰,鞠爱霞,等.HPLC法测定大鼠血浆和唾液中盐酸川穹嗪的浓度[J].世界科学技术-中医药现代化,2011,13 (3):528-532.
[8] 金舒,张逸凡,陈笑艳,等.对映体选择性LC-MS/MS法测定人血浆中R/S-华法林及其在药物相互作用研究中的应用[J].药学学报,2012,47(1):105-109.
[9] 李鹏旺,王玉瑾,刘俊芳.唾液中滥用药物分析及其与血液中药物浓度的相关性[J].法医学杂志,2007,23(4):309-315.
[10] Yu JX, Voruganti S, Li DD, et al. Development and validation of an HPLC-MS/MS analytical method for quantitative analysis of TCBA-TPQ, a novel anticancer makaluvamine analog, and application in a pharmacokinetic study in rats[J]. Chin J Nat Med,2015, 13(7): 554-560.
[11] 袁冬冬,向倩,周颖.临床药师对1例下肢深静脉血栓患者应用华法林抗凝的药学监护[J].中国药房,2014,25(2):180-182.
[12] 郑策,李锦,毛璐,等.药物相互作用致华法林抗凝作用增强引起出血的病例分析[J].中国药物应用与监测,2011,8(6):356-358.
Quantitative determination of warfarin in human saliva and plasma by HPLC-MS/MS and the analysis of their correlation
WANG Zheng1, LI Zhe1, LI Jing2, YANG Chun-xiu1, ZHANG Jian2, SHEN Su1, YU Jun-xian1, WANG Ru-long1
(1. Department of Pharmacy, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China; 2. Medical and Health Center, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China)
Objective: To determine the concentration of warfarin in human saliva and plasma by HPLC-MS/MS, and the correlation between saliva and plasma warfarin concentration was discussed. Methods: The separation was performed on a SB-C18column with an gradient mobile phase consisting of acetonitrile (A) / 0.1% formic acid aqueous solution (B) at the fow rate of 0.4 mL·min-1. Detection was carried out on a mass spectrometer by positive electrospray ionization (ESI) in multiple reaction monitoring (MRM) mode. All samples were collected 12 h after warfarin therapy. Results: Warfarin and the internal standard (IS) were detected at m/z 309.1→163 and 278→91.1, respectively. Two compounds were eluted completely and their retention time were 1.828 min and 1.566 min, respectively. The intra-day and inter-day precision relative standard deviations (RSD) were less than 15%. The warfarin concentrations in saliva samples were 5.44 ng·mL-1, 5.70 ng·mL-1and 8.79 ng·mL-1, respectively. Meanwhile, the warfarin concentration in plasma were 626.04 ng·mL-1, 735.51 ng·mL-1and 1 206.79 ng·mL-1. Conclusion: The HPLC-MS/MS method can be applied to the concentration monitoring about warfarin. There is a correlation between warfarin concentration in saliva and plasma, and the warfarin concentration in saliva can be potentially considered as monitoring surrogate marker.
Warfarin; HPLC-MS/MS; Saliva; Plasma; Blood drug concentration
R917
A
1672 - 8157(2016)03 - 0144 - 04
余俊先,男,副主任药师,主要从事临床药学工作。E-mail:junxianyu@ccmu.edu.cn
王政,女,在读硕士研究生,研究方向:临床药学。E-mail:zhengwangccmu@hotmail.com
(2015-11-15
2016-02-01)

