注射用黄芪多糖在弥漫大B细胞淋巴瘤化疗中的辅助作用
石岳坚,周文锦,郑翠苹,蔡小平(温州市中心医院血液化疗科,浙江 温州 325000)
注射用黄芪多糖在弥漫大B细胞淋巴瘤化疗中的辅助作用
石岳坚,周文锦,郑翠苹,蔡小平(温州市中心医院血液化疗科,浙江 温州 325000)
目的:观察注射用黄芪多糖在弥漫大B细胞淋巴瘤(DLBCL)治疗中的辅助作用。方法:采用病例对照的研究方法,将76例DLBCL患者随机分为2组,治疗组(黄芪多糖联合化疗组)40例,对照组(单纯化疗组)36例,比较4个疗程化疗结束后患者的不良反应、免疫功能及生活质量情况。结果:治疗组不良反应包括白细胞减少、血红蛋白下降、血小板减少、肝功能损害、神经毒性、心功能损害、乏力的发生例数均小于对照组(P < 0.05);治疗组治疗后T细胞亚群中NK细胞明显增高,CD4+/CD8+比值增大,免疫功能明显好于对照组(P < 0.05);治疗组生活质量优于对照组(P < 0.05)。结论:注射用黄芪多糖辅助DLBCL化疗可减轻不良反应的发生,增强患者免疫功能并提高其生活质量。
黄芪多糖;弥漫大B细胞淋巴瘤;化疗;不良反应
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是最常见的恶性淋巴瘤,占非霍奇金淋巴瘤的30% ~ 40%[1],联合利妥昔单抗的RCHOP化疗方案使得DLBCL的预后较好,然而化疗的毒副作用限制了化疗的顺利进行,从而影响DLBCL的疗效,临床上迫切需要一种能提高化疗耐受性并减轻化疗毒副作用的药物。黄芪多糖是中药黄芪的主要生物活性成分,近年来研究表明其具有抗肿瘤、减轻骨髓抑制、增强免疫、改善心脏功能等功效[2-4]。笔者对采用注射用黄芪多糖联合RCHOP方案化疗的DLBCL患者进行观察,现报告如下。
1 资料与方法
1.1临床资料
病例纳入标准:温州市中心医院2011年1月 -2014年12月期间收治的初诊DLBCL病例;既往未接受任何化学治疗、放疗或其他生物学治疗。排除标准:原发性或继发性中枢神经系统淋巴瘤;由其他惰性淋巴瘤转化的DLBCL;合并HIV感染及其他肿瘤性疾病的病例。根据上述标准筛选出78例DLBCL患者,其中2例因黄芪多糖皮试阳性被剔除。76例DLBCL患者样本中:男性42例(55.3%),女性34例(44.7%);年龄分布在35 ~ 77岁,中位年龄62岁;Ann Arbor分期:Ⅰ~Ⅱ期30例,Ⅲ~Ⅳ期46例。治疗前患者体能状态评分≥60分,无心肺功能及肝肾功能严重损害或异常。将76例患者采用随机数字表示法分为治疗组40例,对照组36例。对两组患者在性别、年龄、Ann Arbor分期、IPI(国际预后指数)评分、白细胞计数及肝肾功能等方面进行比较,差异无统计学意义(P > 0.05)。
1.2治疗方法
对照组采用RCHOP方案化疗,每21天为一个疗程,具体方案为:利妥昔单抗375 mg·m-2,ivgtt,d1;环磷酰胺750 mg·m-2,iv,d2;吡柔比星50 mg·m-2,iv,d2;长春新碱1.4 mg·m-2,iv,d2;强的松片100 mg,分2次口服,d2-d6。治疗组是在RCHOP化疗方案的基础上加用注射用黄芪多糖(天津赛诺制药有限公司,规格250 mg)250 mg加入5%葡萄糖注射液或0.9%氯化钠注射液500 mL,ivgtt,qd,连续21 d,共4个疗程。治疗组患者使用注射用黄芪多糖前均进行皮试,皮试结果阴性者方能入组。两组患者在治疗过程中不再使用可能影响免疫功能的其他药物。
1.3观察指标
1.3.1化疗不良反应 观察指标包括白细胞减少、贫血、血小板减少、肝肾功能损害、胃肠道反应、黏膜炎、神经毒性、脱发及乏力。按WHO《抗肿瘤药物急性及亚急性分度评价标准》进行评价,其中,白细胞减少、贫血及血小板减少以化疗后第4、8、11、15天所测血常规的最低值作为评价指标。
1.3.2心脏毒性 根据WHO《抗肿瘤药物急性及亚急性分度评价标准》,化疗前后常规12导联心电图检查、心脏超声检查测定左室射血分数(LVEF)及测定肌钙蛋白T(cTnT)及脑钠肽(BNP)。
1.3.3免疫功能测定 治疗前及4个疗程化疗结束后第10天,通过流式细胞学检查测定患者外周血的淋巴细胞亚群。
1.3.4生活质量 按KPS功能状态评分标准对患者的生活质量进行评价,分别在准备化疗前及4个疗程化疗结束后第14天进行KPS评分,治疗后KPS评分增加10分以上为改善,减少多于10分为降低,介于两者之间为稳定。改善率(%)=改善例数/总例数×100%。
1.4统计学方法
2 结果
2.1化疗不良反应比较
治疗组患者白细胞减少、贫血、血小板降低、肝功能异常、神经毒性、乏力的不良反应发生率及严重程度均低于对照组,心功能评估更优,差异有统计学意义(P < 0.05);其余指标组间对比无明显差异,详见表1。
2.2心功能比较
治疗前,两组心功能指标相近。化疗后,两组LVEF均有不同程度下降,且对照组下降更为明显(P <0.05)。治疗前后两组cTnT及BNP均未见明显改变。详见表2。
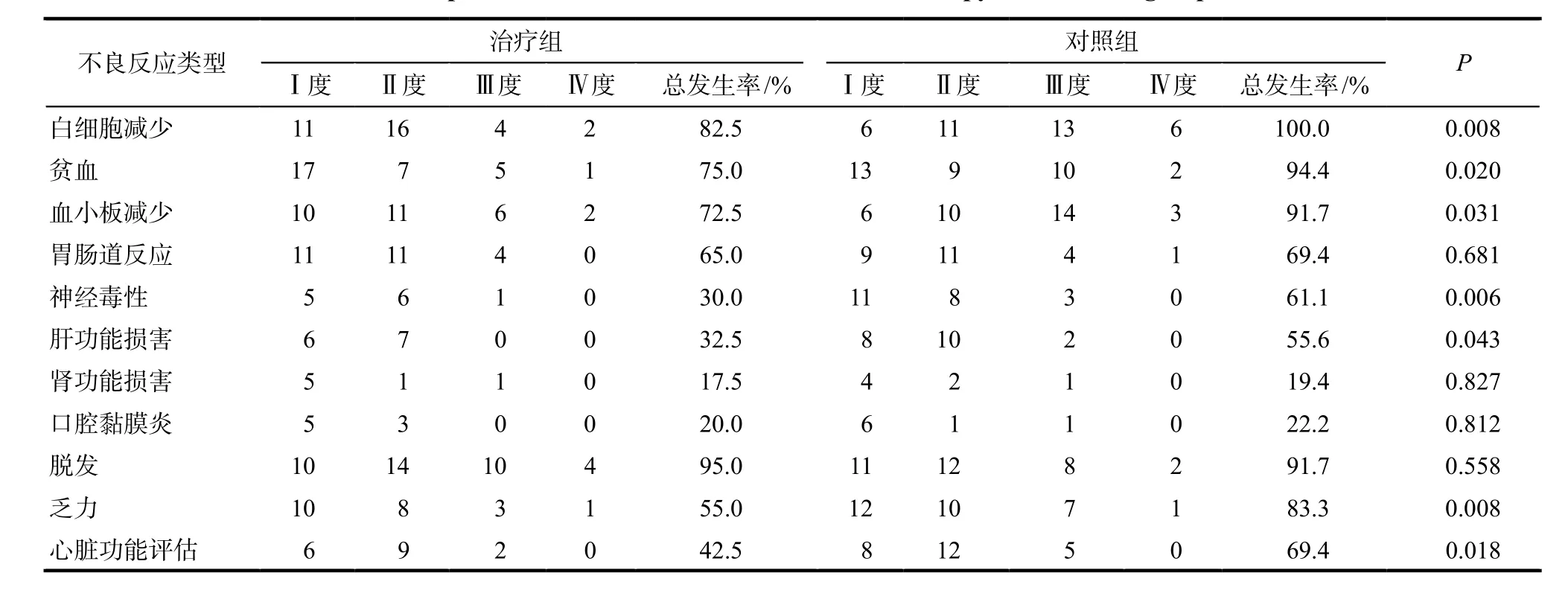
表1 两组化疗后不良反应比较.例Tab 1 Comparison of adverse reactions after chemotherapy between two groups. case
表2 两组心功能比较.± sTab 2 Comparison of heart function between two groups. x± s
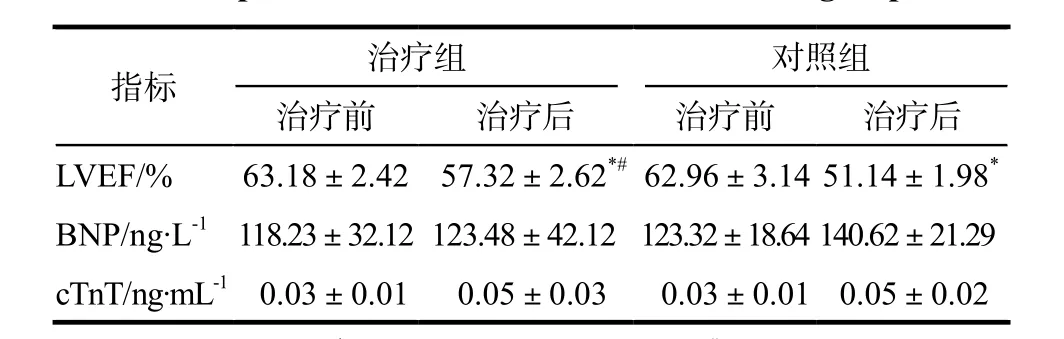
表2 两组心功能比较.± sTab 2 Comparison of heart function between two groups. x± s
注:与治疗前比较,*P < 0.05;与对照组比较,#P < 0.05Note: compared with pre-treatment,*P < 0.05; compared with control group,#P < 0.05
指标治疗组 对照组治疗前治疗后治疗前治疗后LVEF/% 63.18±2.42 057.32±2.62*#62.96±3.14 51.14±1.98*BNP/ng·L-1118.23±32.12 123.48±42.12 123.32±18.64 140.62±21.29 cTnT/ng·mL-100.03±0.01 000.05±0.03 0.03±0.01 00.05±0.02
2.3免疫功能比较
治疗前,两组患者免疫功能相近。治疗后对照组无明显改变,治疗组CD4+/CD8+及NK细胞活性均明显增高,组间差异有统计学意义(P < 0.05)。见表3。
表3 两组治疗前后CD4+/CD8+、NK细胞活性变化比较.± sTab 3 Comparison of CD4+/CD8+and NK cell activity before and after treatment. x± s

表3 两组治疗前后CD4+/CD8+、NK细胞活性变化比较.± sTab 3 Comparison of CD4+/CD8+and NK cell activity before and after treatment. x± s
注:与治疗前比较,*P < 0.05;与对照组比较,#P < 0.05Note: compared with pre-treatment,*P < 0.05; compared with control group,#P < 0.05
指标治疗组 对照组治疗前治疗后治疗前治疗后CD4+/CD8+0.71±0.10 1.12±0.09*#0.69± 0.09 00.72±0.11NK细胞活性/% 20.91±3.98 35.51±5.21*#21.12±3.11 23.54±3.46
2.4生活质量比较
对照组生活质量改善19例,稳定9例,降低8例,改善率为52.8%(19/36);治疗组改善32例,稳定6例,降低2例,改善率达80.0%(32/40),差异有统计学意义(χ2= 6.360 8,P = 0.012)。
3 讨论
目前以CHOP方案为主的常规根治性化疗是DLBCL的标准治疗方案,加用利妥昔单抗的RCHOP方案,其完全缓解率达75% ~ 80%,3 ~ 5年的无复发生存率为50% ~ 60%[5-6]。然而无论化疗药物如何更新换代,其对机体的不良反应依然存在,RCHOP方案中的环磷酰胺、吡柔比星有骨髓抑制作用,长春新碱有神经毒性,吡柔比星有心脏毒性,且3种药物均会降低患者的免疫功能,使得化疗不能足剂量按时完成。中药可作用于机体的免疫系统,促进细胞因子的分泌和免疫细胞的生成,从而提高细胞抗肿瘤等免疫功能[7-8]。
注射用黄芪多糖是将中药黄芪采用现代提取分离技术所得有效成分进行精制而成的中药注射液。补气药物黄芪功能益气摄血,能有效提高患者白细胞数量,并持续改善贫血和提升血小板。研究发现,黄芪多糖是作用在骨髓细胞增殖和释放这两个阶段,来达到提升化疗后外周血血细胞数量的目的,效果缓和,不会造成骨髓内造血细胞的过度增殖及幼稚细胞释放到外周血而引发白血病,该研究还推测黄芪多糖调节骨髓粒细胞释放可能与内源性蛋白水解酶的激活及其信号传导过程有关[9]。本研究中,治疗组的骨髓抑制发生率和严重程度明显低于对照组,支持了黄芪多糖具有保护和刺激骨髓造血的作用。
心脏毒性是DLBCL患者化疗时需面对的又一问题,蒽环类药物的心脏毒性与其在体内形成大量自由基密切相关,螯合铁离子的蒽环类药物会触发氧自由基,含蒽环类药物-三价铁复合物的自由基使氧分子变为过氧化氢和超氧离子,导致心肌细胞膜脂质过氧化并引起心肌线粒体DNA的损伤[10]。近年来通过动物实验研究发现,黄芪多糖能改善心脏舒缩及泵血等心血管方面的作用,能明显增强阿霉素致心力衰竭大鼠的心肌收缩力,从而提高大鼠的存活率[11]。另有实验研究发现黄芪注射液可以使阿霉素的心脏毒性明显降低,并有效地清除体内的氧自由基,从而保护心脏[12]。在本研究中,治疗组的心脏毒性明显低于对照组,证明黄芪多糖能有效的保护心脏,减少化疗药物对心肌的损伤。
T淋巴细胞亚群是临床常用的表示人体免疫状态的重要指标,CD4+/CD8+比值降低说明机体免疫处于抑制状态,NK细胞系自然杀伤细胞,是人体重要的抗肿瘤免疫淋巴细胞。黄芪多糖能够提升CD4+/CD8+的比值并增强NK细胞活性,诱导白细胞介素、肿瘤坏死因子和干扰素等免疫因子的产生,抑制肿瘤细胞的增殖和生长,促进肿瘤细胞凋亡[13]。本研究结果显示,注射用黄芪多糖联合RCHOP治疗DLBCL,患者的CD4+/CD8+、NK细胞活性较治疗前升高,组间差异有统计学意义(P < 0.05),表明黄芪多糖有增强患者免疫功能的作用。此外,治疗组的肝功能损害、神经毒性的不良反应发生率及发生程度低于对照组,提示黄芪多糖还具有保护肝脏、减轻化疗神经毒性等多重作用。按KPS评分标准,治疗组生活质量优于对照组,提示黄芪多糖可明显提高DLBCL化疗患者的生活质量。
综上所述,注射用黄芪多糖辅助DLBCL化疗可以减轻化疗所致的不良反应,增强患者免疫功能并改善生活质量,使患者的化疗耐受性提高,值得临床推广使用。
[1] Yıldırım M, Kaya V, Demirpençe Ö, et al. The role of gender in patients with diffuse large B cell lymphoma treated with rituximab-containing regimens: a meta-analysis[J]. Arch Med Sci,2015, 11(4): 708-714.
[2] 吕玲,张立,李能莲,等.黄芪的抗肿瘤作用[J].世界临床药物,2014,35(5):20-24.
[3] 柏冬志,东方,唐文婷,等.黄芪多糖药理作用的研究进展[J].黑龙江医药,2014,27(1):103-106.
[4] 卢炜,顾蓓蓓,卢劲晔,等.黄芪多糖对小鼠免疫功能影响的研究[J].中国畜牧兽医文摘,2014,30(11):202-203.
[5] 林明琼,杨菁.1例弥漫大B细胞淋巴瘤合并乙肝病毒感染患者的药学监护[J].中国药物应用与监测,2012,9(1):37-39.
[6] Coleman M, Lammers PE, Ciceri F, et al. Role of rituximab and rituximab biosimilars in diffuse large B-cell lymphoma[J]. Clin Lymphoma Myeloma Leuk, 2016, 16(4): 175-181.
[7] 刘印华,李树义,赵志强,等.黄芪多糖对免疫功能影响的体外实验研究[J].河北医药,2014,36(18):2731-2733.
[8] 龚蕾,周正宏,周俊萍,等.天然免疫调节药物在肿瘤辅助治疗中的研究进展[J].中国畜牧兽医,2014,41(7):247-251.
[9] 王柳春,孙慧,李凯.黄芪多糖与粒细胞集落刺激因子对化疗后骨髓功能的影响[J].中国肿瘤临床,2008,35(23):1373-1376.
[10] 张友计,李华,莫余波.阿霉素心肌病大鼠心钠素与丙二醛和超氧化物歧化酶及心室重构的关系[J].现代医药卫生,2012,28(23):3528-3530.
[11] 王玉敏,马琰岩,高俊虹,等.黄芪总提物及其有效成分改善阿霉素致心衰的研究[J].中国实验方剂学杂志,2012,18(7):208-212.
[12] 罗仁峰,刘敏,张苏州.黄芪注射液/华蟾素注射液联合右丙亚胺对阿霉素相关性心脏毒性的保护作用[J].中国医院药学杂志,2015,35(7):629-632.
[13] 赵镕,高永翔.黄芪多糖的免疫调节作用研究进展[J].中医临床研究,2012,4(5):4-6.
The supporting role of astragalus polysaccharide injection in chemotherapy for diffuse large B-cell lymphoma
SHI Yue-jian, ZHOU Wen-jin, ZHENG Cui-ping, CAI Xiao-ping(Blood Chemotherapy Department of Wenzhou Central Hospital,Wenzhou 325000, China)
Objective: To observe the supporting effects of astragalus polysaccharide injection in chemotherapy for diffuse large B-cell lymphoma (DLBCL). Methods: Case-control study method was adopted. A total of 76 DLBCL patients were randomly divided into the treatment group (chemotherapy combined with astragalus polysaccharide, 40 patients) and the control group (chemotherapy, 36 patients). After four cycles of chemotherapy, adverse reactions, immunologic function and quality of life situation of two groups were assessed. Results: The number of cases of occurring adverse reactions in respect of leucopenia, decreased hemoglobin, thrombocytopenia, hepatic dysfunction, neurotoxicity, cardiac dysfunction, fatigue in treatment group were signifcantly less than those in the control group (P < 0.05). After treatment, NK cells and CD4+/CD8+were signifcantly increased (P < 0.05), and the quality of life in the treatment group was better than that in control group (P < 0.05). Conclusion: Astragalus polysaccharide combined with chemotherapy can reduce adverse reactions, enhance immunologic function and improve the quality of life in DLBCL patients.
Astragalus polysaccharide; Diffuse large B-cell lymphoma; Chemotherapy; Adverse reaction
R969.4
A
1672 - 8157(2016)03 - 0137 - 04
(2015-11-20
2016-02-05)

