趣味实验 玩转铜丝
河北省承德市营子区教育局中学教研室 张学军
趣味实验 玩转铜丝
河北省承德市营子区教育局中学教研室张学军
常温下铜为紫红色固体,它的硬度、密度、熔点适中,且具有良好的导电性、导热性和延展性。基于以上原因,铜作为金属材料在生产生活中有着广泛的应用。下面就让我们用铜丝来完成几个趣味实验吧。
实验一:铜丝“助燃”
如图1所示,在酒精灯灯芯管内插入一节粗铜丝,点燃酒精灯,酒精灯燃烧得比未插铜丝时更旺。
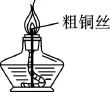
图1
原理解释:铜具有良好的导热性,使灯内酒精更易气化,因而酒精灯燃烧更旺。
实验二:铜丝“切割”火焰
如图2所示,用铜丝编织一个铜网,将铜网放在蜡烛烛焰上半部分位置,铜网上方火焰熄灭,下方继续燃烧,烛焰被“削去”一部分。
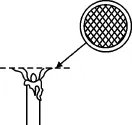
图2
原理解释:铜具有良好的导热性,将铜网放到烛焰上方时,铜网吸收了烛火上半部分的热量,并向四周散热,使铜网上方的石蜡蒸气温度降低至着火点以下,所以铜网上方烛火熄灭;铜网下方的石蜡蒸气,有持续的烛火提供热量,其温度不会降低至着火点以下,所以会继续燃烧。
实验三:铜丝“灭火”
如图3所示,用粗铜丝或多股铜丝绕成一个内径比蜡烛直径稍大点的线圈,圈与圈之间有一定的空隙。点燃蜡烛,把铜丝制成的线圈从烛焰上罩下去,正好将烛焰罩在线圈里面,这时空气并没有被隔绝,可是铜丝里的烛焰却自上而下熄灭了。

图3
原理解释:铜具有良好的导热性,将铜线圈罩在燃着的蜡烛上时,烛焰散发的热量大部分被铜丝带走,结果使石蜡蒸气的温度大大降低,当温度低于石蜡蒸气的着火点时,蜡烛自然会熄灭。
实验四:铜丝“变脸”
取一根光亮的铜丝,在酒精灯外焰上灼烧至表面发黑,再将其伸入酒精灯内焰中,又会逐渐恢复光亮的红色。
原理解释:铜丝在空气中加热生成黑色氧化铜,其化学方程式为:2Cu+O2=2CuO;氧化铜与内焰中的酒精蒸气发生还原反应,重新生成铜,其化学方程式为:C2H5OH+CuO=Cu+H2O+CH3CHO。
实验五:巧测空气中氧气的含量
如图4所示,在由两个注射器组成的密闭装置中留有50 mL空气,给装有细铜丝的玻璃管加热,同时缓慢交替推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热;待装置冷却至室温,将气体全部推至一个注射器内;依据密闭装置内减少的气体体积与空气总体积(50 mL)之比,计算出空气中氧气的含量。
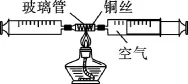
图4
原理解释:铜丝在加热并充分反应的情况下,能将密闭系统中的氧气全部消耗,该化学反应方程式为:2Cu+O2=2CuO。当装置冷却至室温时,减少的气体体积,即为50 mL空气中氧气的体积。
实验六:番茄电池
在半熟的番茄中,相隔一定距离,插上一根铜棒和一根铁棒,再用一根导线把铜棒和铁棒与一个电流表串联起来,可以看到电流表的指针发生偏转,说明电路中产生了电流。
原理解释:番茄汁中含有有机酸,按照金属活动性顺序有:Fe>H>Cu,所以该酸能与铁反应,而不能与铜反应,于是铁棒、铜棒、导线和番茄形成一个电路,用电流表可以检测到电路中电流的存在。

