两种低聚糖对烟草种子萌发及幼苗生长的影响
余 钱,尹显慧*,陈 雪,黄化刚,代园凤,喻会平
(1.贵州大学 作物保护研究所,贵州 贵阳 550025;2.贵州省烟草公司毕节市公司,贵州 毕节 551700)
两种低聚糖对烟草种子萌发及幼苗生长的影响
余钱1,尹显慧1*,陈雪2,黄化刚2,代园凤2,喻会平2
(1.贵州大学 作物保护研究所,贵州 贵阳 550025;2.贵州省烟草公司毕节市公司,贵州 毕节 551700)
为研究低聚糖对烟草种子萌发、早期幼苗生长及生理生化指标的影响,通过不同浓度浸种,记录种子萌发情况,30 d后观察早期幼苗形态特征,并分别测定了幼苗叶片的叶绿素、MDA、可溶性蛋白含量、脯氨酸含量、细胞膜透性和SOD、POD、CAT等保护酶活性等生理生化指标。结果表明,两种低聚糖处理对烟草的萌发都有一定的抑制作用,但在其生长期可以补充营养,促进幼苗生长发育。
烟草;低聚糖;种子萌发;幼苗生长;生理生化指标
烟草属于茄科(Salanaceae) 烟属(Nitotiana),是我国广泛栽培的一种经济作物[1]。虽随着烟草行业“合作社种植经营模式”的推广及烟草种植产业化发展,高质量的烟草种子成为保障烟叶产量和质量的基础。目前中国烟草行业生产用种已全部使用包衣种子,通过包衣处理的种子极大地提高了播种操作的方便性,同时对种子的萌发和壮苗有显著的促进作用[2-3]。但为了更大的经济效益,科研人员开展了大量的研究工作。目前,天达-2116对葡萄[4]、小麦[5]、玉米[6]、马铃薯[7]和寡聚糖对黄瓜[8]、番茄[9]等作物都有明显的促进作用。田香华等研究报道了低聚糖对烟草黑胫病菌菌丝生长具有较好抑菌活性[10];商文静报道了低聚糖可以诱导烟草对TMV的侵染产生系统诱导抗病性,减轻病毒侵染引起的系统症状[11],这样产量就会更高。而采用低聚糖浸泡烟草种子,使更多的低聚糖融入烟草种子中,这样的方法在国内外还鲜有报道。
本文研究不同浓度低聚糖浸种处理对烟草种子萌发、发芽30 d早期幼苗生长及生理生化特性的影响,旨在筛选合适的低聚糖浓度,为提高烟草种子萌发率、缩短发芽时间及生产中培育烟草壮苗和高产优质栽培提供参考。
1 材料与方法
1.1试验时间、地点
研究于2014年5月~7月在贵州大学农学院农药和农安实验室进行。
1.2试验材料
供试材料烟草种子毕纳1号由贵州省烤烟良种繁育基地提供。
供试药剂:
天达-2116为山东天达生物股份有限公司提供,蓝甲寡聚糖为山东嘉丰海洋生物科技有限公司提供。
1.3试验方法
1.3.1低聚糖对烟草种子萌发的影响
试验设2种药剂各5个浓度,清水为对照,共11个处理,见表1。选取大小均匀一致的烟草种子,分别放于上述稀释溶液中浸种2 h,清水为对照CK。在直径为90 mm的培养皿中放置约1 cm厚的高温蛭石,其上再垫一张滤纸做发芽床,在其内均匀地放置浸泡过的种子,每个处理90粒种子,排列整齐,分为3个培养皿,每个培养皿30粒种子,重复3次。在25℃,光照16 h/d,光强2000 lx条件下的恒温培养箱内萌发。从置床之日起每天定时起盖通气2次,加入清水,以保证发芽床湿润。萌发指标以胚根长度为种子长度的1/2时为准,萌发时间从播种日算起。种子萌发后逐日记录发芽数量,记录12 d,测定并计算种子萌发指标。

表1 供试低聚糖及处理浓度
(1)发芽率:从放入种子起至第12天终止,统计正常发芽种子粒数占供试种子总数的百分率。即发芽率(%)=(发芽种子数/种子总数)×100
(2)发芽势:从放入种子起至第6天,统计发芽种子粒数占供试种子总数的百分率。即发芽势(%)=(播种后6 d发芽数/种子总数)×100
(3)发芽指数=Σ(逐日发芽数/发芽试验天数)
1.3.2低聚糖对烟草幼苗形态指标的影响
将药剂浸泡后,每个处理90粒种子,播种于盛有蛭石的沙盘内,每个沙盘里30粒种子,排列整齐,重复3次。置于人工气候室培养,培养环境设为温度25℃/18℃(昼/夜),光周期昼夜各16 h/d,相对湿度75%。从置床之日起每天定时加入清水,定期加入天达-2116和蓝甲寡聚糖各自不同浓度的稀释液,培育30 d后,测定鲜重、根上重、根鲜重以及根长、株高等农艺性状指标。
1.3.3低聚糖对烟草早期幼苗生理生化指标的影响
待沙盘内幼苗长到5片叶时,采用烟草营养土移栽到花盆中,用上述处理液进行灌浇,清水为对照,放置在25℃,光周期昼夜为16 h/d的温室中进行培养,间隔3~5天用处理药液浇灌,2个月后采集第三到第四片叶片,进行生理生化指标检测。其中,叶绿素含量采用李合生等[12]改进的丙酮法进行测定;MDA含量采用硫代巴比妥酸法[13]进行测定;抗氧化酶液提取参照Moerschbacher等[13]的方法,SOD活性采用氮蓝四唑(NBT)光还原法[14]测定;POD活性采用Kochba等[15]方法测定;CAT活性采用Dhindsa等[14]的方法测定。可溶性蛋白含量测定采用考马斯亮蓝G-250染色法[16];细胞膜透性测定采用电导仪测定法[17];脯氨酸含量采用茚三酮法[18]。
1.4统计方法
利用SPSS 16.0软件对试验数据进行单因素方差分析(ANOVA)和LSD检验。
2 结果与分析
2.1低聚糖浸种对烟草萌发的影响
2.1.1发芽动态
从着床开始,所有处理均在第四天开始萌发,第十天萌发完毕,但对照(ck) 在发芽的第8天就达到了最高峰,而天达-2116和蓝甲寡聚糖各处理达到发芽高峰的时间均为第10 天,表明这两种低聚糖的不同浓度处理都延迟了烟草种子的萌发高峰期,对烟草的萌发都有一定的抑制作用。
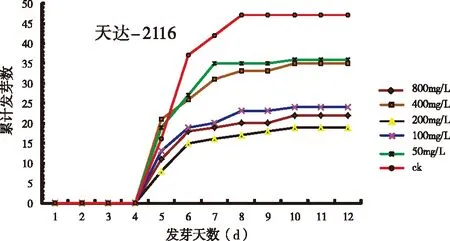
图1(a)

图1(b)
2.1.2发芽率与发芽势
如图2所示,经天达-2116和蓝甲寡聚糖浸泡处理过的种子,发芽率与发芽势均明显呈现出“低高低高”的趋势。两者的发芽率与发芽势与对照(CK)相比都偏低,差异显著,天达-2116 200 mg/L

图2(a)
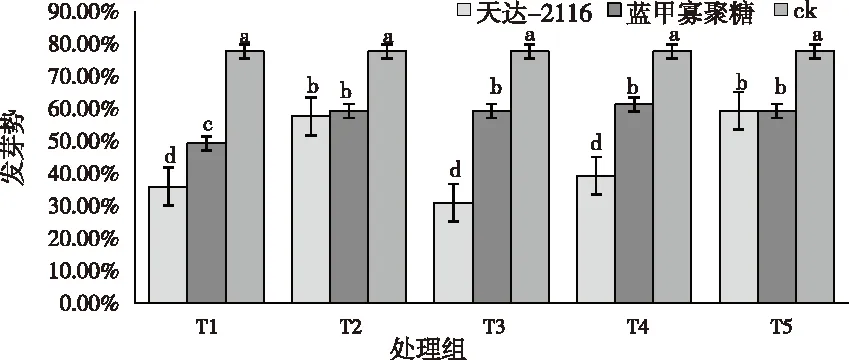
图2(b)
和蓝甲寡聚糖10000 mg/L时的发芽率、发芽势最低。天达-2116 50 mg/L的发芽率、发芽势最高,为44.33%、59.33%,与ck相比下降了16.67%、17.84%;蓝甲寡聚糖1250 mg/L的发芽率、发芽势最高,为49.33%、61.33%,与ck相比降低11.67%、6.34%。由天达-2116和蓝甲寡聚糖的发芽势与发芽率的降低可看出,经过这两种低聚糖浸泡处理,对烟草萌发都具有抑制作用。
2.1.3发芽指数
如图3所示,虽然天达-2116和蓝甲寡聚糖对种子发芽指数的影响各异,但其趋势与发芽率和发芽势相同,两种低聚糖的发芽指数都显著偏低于ck,且天达-2116处理组的发芽指数普遍低于蓝甲寡聚糖处理组。天达-2116 50 mg/L的发芽指数最高,为7.78,与ck相比降低1.05;寡聚糖各个处理之间的发芽指数无显著性差异,但都显著低于ck。发芽指数是测定种子发芽全过程快慢程度的指标。天达-2116和蓝甲寡聚糖均降低了烟草种子的活力,延缓了种子萌发速度。
2.2低聚糖浸种对烟草幼苗形态特征的影响
从表2和表3可以看出,各处理对早期幼苗农艺性状的影响各不相同。天达-2116 处理组的主根都极显著长于ck,而株高普遍低于ck,且浓度为800 mg/L的株高最矮。蓝甲寡聚糖处理组的主根也都显著长于ck, 且浓度为625 mg/L的主根最长。蓝甲寡聚糖处理组的株高呈“低高低高”的趋势,与ck差异不显著。天达-2116处理组的总鲜重随着浓度的增大而增大,蓝甲寡聚糖处理组随着浓度的增大,总鲜重、地上部重呈“高低高低”的趋势。表明经不同浓度低聚糖浸种后对烟草早期幼苗总鲜重的影响不同,在一定浓度下可以有效提高总鲜重。天达-2116处理组和蓝甲寡聚糖处理组的地上部重与ck无显著差异。在试验中,天达-2116

图3 低聚糖不同浓度处理下烟草种子的发芽指数Fig.3 Germination index of tobacco seed treatingwith oligosaccharides
处理组和蓝甲寡聚糖处理组都有侧根的生长,而ck未有侧根生长。所以,经天达-2116和蓝甲寡聚糖浸泡过的烟草种子有利于主根和侧根的生长,表明经这两种低聚糖浸种后对烟草早期幼苗生长有积极的影响。
2.3低聚糖浸种对烟草幼苗叶片叶绿素含量的影响
从表4可知,蓝甲寡聚糖组的叶绿素a和叶绿素(a+b)含量随浓度的增大逐渐降低,但当达到5000 mg/L时,叶绿素a和叶绿素(a+b)含量又开始增加;叶绿素b含量随浓度的降低呈“升降升降”的趋势;蓝甲寡聚糖 625 mg/L叶绿素a和叶绿素(a+b)含量均显著高于ck。在表5中,天达-2116 100 mg/L的叶绿素a、叶绿素b和叶绿素(a+b)含量极显著低于ck;天达-2116 50 mg/L的叶绿素a、叶绿素b和叶绿素(a+b)含量显著高于ck。说明蓝甲寡聚糖 625 mg/L和天达-2116 50 mg/L 处理能有效提高叶绿素中的各种含量,促进烟草幼苗的生长发育。

表2 低聚糖不同浓度处理对早期幼苗农艺性状的影响

表3 低聚糖不同浓度处理对早期幼苗农艺性状的影响
注:数据后的小写字母表示不同处理间的显著性差异(P<0.05),大写字母表示不同处理间的极显著差异(P<0.01),下同。
表4低聚糖不同浓度处理早期幼苗叶片叶绿素含量的影响
Tab.4Effects of oligosaccharides on the content of photosynthetic pigments in tobacco leaves at early-stage seedlings

处理组(mg/L)叶绿素a(mg/g·FW)叶绿素b(mg/g·FW)叶绿素(a+b)(mg/g·FW)ck—14.93±0.34bcABC5.16±0.19bcdBCD20.08±0.30cdBCD蓝甲寡聚糖1000013.43±0.02dDE5.08±0.02bcdBCD18.51±0.15eEF500011.82±0.06eF5.18±0.75bcBCD17.00±0.73fG250012.45±0.64eEF4.76±0.26cdCD17.21±0.43fFG125014.08±0.31cdCD4.56±0.12dD18.64±0.42eDEF62515.54±0.30abAB5.04±0.27bcdBCD20.58±0.56bcBC
表5低聚糖不同浓度处理早期幼苗叶片叶绿素含量的影响
Tab.5Effects of oligosaccharides on the content of photosynthetic pigments in tobacco leaves at early-stage seedlings

处理组(mg/L)叶绿素a(mg/g·FW)叶绿素b(mg/g·FW)叶绿素(a+b)(mg/g·FW)ck—14.93±0.34bcABC5.16±0.19bcdBCD20.08±0.30cdBCD天达 211680014.54±0.25cBCD4.74±0.07cdD19.27±0.26deCDE40016.06±0.65aA5.54±0.36bABC21.61±0.87abAB20014.98±0.55bcABC5.63±0.24bAB20.60±0.52bcBC1006.41±0.45fG2.25±0.07eE8.66±0.50gH5016.19±0.94aA6.28±0.36aA22.47±1.11aA
2.4低聚糖浸种对烟草幼苗叶片MDA含量的影响
从图4可看出,天达-2116处理组和蓝甲寡聚糖处理组的MDA含量随着浓度的降低呈“降升降升”的趋势,天达-2116处理组各个浓度的MDA含量与ck无显著性差异。蓝甲寡聚糖10000 mg/L的MDA含量最高且极显著高于ck,为2.566 mg/g,可能是浓度设置过高,使其烟草幼苗中的MDA过高,烟草叶片细胞膜脂过氧化程度加剧;2500 mg/L的MDA含量最低且明显低于ck,为0.833 mg/g,这可能是因为在试验中此浓度更容易受环境等因素的影响,寡聚糖其它各处理的MDA含量与ck相比差异不明显。

图4 低聚糖不同浓度浸种对烟草早期幼苗叶片MDA含量的影响
2.5低聚糖浸种对烟草幼苗叶片抗氧化酶活性的影响
在图5(a)中,天达-2116处理组和蓝甲寡聚糖处理组的SOD活性随浓度的降低均呈“升降升降”的趋势,只是SOD活性达到最高点的处理不一样,天达-2116处理组的SOD活性在T3(200 mg/L)时达到最高点,蓝甲寡聚糖处理组的SOD活性在T4(1250 mg/L)时达到最高点。虽然两个处理组的SOD活性都达到过最高点,但均显著低于ck。在图5(b)中,天达-2116处理组和蓝甲寡聚糖处理组的POD活性均高于ck。在图5(c)中,天达-2116处理组的CAT活性在一定范围内随浓度降低而逐渐

图5(a)

图5(b)

图5(c)
升高,50 mg/L时含量最高,但也显著低于ck,表明使用天达 -2116浸泡时高浓度对CAT活性有抑制作用;蓝甲寡聚糖处理组的CAT活性随浓度降低呈“先降后升”的趋势,在T3(625 mg/L)时CAT活性达到最高,在此浓度下显著高于ck。总体来说,经过浸泡处理,两种低聚糖均降低了烟草早期幼苗叶片的SOD活性,显著提高POD活性。
2.6低聚糖浸种对烟草幼苗叶片可溶性蛋白含量的影响
从图6可以看出,在一定范围内,天达-2116组的可溶性蛋白含量随浓度降低逐渐升高,在50 mg/L时可溶性蛋白含量达到最高,但也极显著低于ck,表明经过天达-2116浸泡处理,明显降低烟草幼苗叶片的可溶性蛋白含量。蓝甲寡聚糖组的可溶性蛋

图6 低聚糖不同浓度浸种对烟草早期幼苗叶片可溶性蛋白含量的影响
白含量随浓度的降低呈“先降后升”的趋势,在T3(2500 mg/L)时可溶性蛋白含量最低,为20.74 μg/g,比ck降低49.57 μg/g;在5个处理浓度中,T5(625 mg/L)时可溶性蛋白含量最高,为77.49 μg/g,比ck提高7.18 μg/g。结果表明只有合适的低聚糖浓度才能有效提高烟草幼苗叶片的可溶性蛋白含量。2.7低聚糖浸种对烟草幼苗叶片细胞膜透性的影响
由图7可得,天达-2116组和蓝甲寡聚糖组的相对电导率都随着浓度的降低而成“减增减增” 的趋势。天达-2116组的相对电导率在T1时达到最大,与ck无显著性差异。蓝甲寡聚糖组的相对电导率在T4时达到最大,为52.44%,显著高于ck;蓝甲寡聚糖在T1、T2、T5时的相对电导率与对照相比,都表现出差异不明显。说明不同浓度低聚糖处理在一定程度上,不会造成细胞内的电解质外渗。

图7 低聚糖不同浓度浸种对烟草早期幼苗叶片细胞膜透性的影响
2.8低聚糖浸种对烟草幼苗叶片脯氨酸含量的影响
脯氨酸含量的多少是衡量植物在逆境下抗逆性强弱的一种指标,脯氨酸含量越多,作物抗逆性越强。由图8可得,两个处理组的脯氨酸含量都显

图8 低聚糖不同浓度浸种对烟草早期幼苗叶片脯氨酸含量的影响
著高于ck。表明烟草种子通过天达-2116和蓝甲寡聚糖浸泡均能有效提高早期幼苗叶片中脯氨酸的含量,对烟草的抗逆性有积极的影响。
3 讨论
低聚糖是指聚合度(多糖的糖基数)在20以下的壳聚糖[19]。低聚糖素是一类生物活性分子,具有调节植物的生长发育、形态发生、果实成熟以及抗逆性等功能[20-21]。壳聚糖对植物病原菌的抗菌活性会产生诱导效果[22]。在本实验中所使用的两种低聚糖:天达-2116(含复合氨基低聚糖、抗病诱导物质、多种维生素、多种氨基酸、水杨酸等)和蓝甲寡聚糖(含有机质、壳聚物以及多种微量元素),这两种低聚糖都含有作物生长所需的大量物质。在杨文平[23]等人的研究中天达-2116 拌种对小麦种子萌发具有促进作用,而在本实验中,经过天达-2116和蓝甲寡聚糖浸泡过的烟草种子,却延迟了种子的萌发时间,降低了烟草种子的发芽率、发芽势和发芽指数。这可能是因为这两种低聚糖在浸种时抑制了烟草种子中催化萌发的某些酶的活性,在后期进行对烟草幼苗叶片抗氧化酶活性的影响实验测定中也发现超氧化歧化酶(SOD)显著降低,这与孙群[24]等人的研究中SOD等保护性酶的活性降低会造成种子活力下降一致。在后期测定中两个处理组均增加了过氧化物酶(POD)活性,这可使植物体为了抵抗活性氧对自身的毒害作用,就利用自身的POD,清除过多的活性氧,避免自身受到活性氧的损伤[25]。两种低聚糖都促进了烟草早期幼苗的生长,使烟草幼苗有较高的主根长、鲜重和茎粗以及增加侧根的生长。这可能是因为两种低聚糖内都含有壳聚糖物质,这是一种氨基多糖类聚合物,含有丰富的C、N,可被微生物分解利用并作为植物生长的养分,同时,土壤中使用壳聚糖或其他甲壳素衍生物可改变土壤微生物区系,促进有益微生物的生长而抑制一些植物病原菌[26],这样使烟草在早期幼苗生长中能够促进根系正常生长,快速生根,使生长均衡健壮。叶片中叶绿素是植物光合作用中能量转化的物质基础,其含量影响着植株的生长和营养物质的含量[27]。若叶绿素含量降低,叶绿体发育受到抑制,叶色表现出黄化、白化、苍绿色等症状,光合效率降低,生长迟缓,有的甚至会导致植株死亡[28-32]。与对照相比,天达-2116 50 mg/L和蓝甲寡聚糖 625 mg/L浸种时能有效增加叶绿素含量,促进烟草生长,增加叶片光合效率。天达-2116组的MDA 含量和相对电导率明显降低,在一定程度上抑制了叶片MDA 的积累和膜质过氧化作用的发生[33],维持了细胞质膜的完整性,保证了植物体各种代谢的正常进行[34]。而脯氨酸在植物组织内是一种理想的渗调物质[33],脯氨酸含量的明显增加,有利于烟草幼苗叶片的渗透调节。天达-2116和蓝甲寡聚糖都是新型低聚糖,都含有作物生长所需的多种物质,在农业上已经得到了大量应用,但在烟草上尚处于尝试阶段[35]。在此次研究中,虽然两者都延迟了烟草种子的萌发时间,但为烟草幼苗的生长提供了充分的营养。总体来说,采用天达-2116 50 mg/L和蓝甲寡聚糖625 mg/L浸种效果最佳,能有效增加烟草的主根长、叶绿素含量、脯氨酸含量、POD活性等,对烟草幼苗的生长有积极作用。这对低聚糖在烟草上的研究应用提供了一定的参考资料。本研究为室内结果,为实际应用仅提供参考,还需进一步开展田间试验,为获得更大的烟草经济收益提供更为具体和科学的指导。
[1]马文广,韩瑞,李永平,等. 不同药剂浸种处理对烟草种子活力和幼苗生长的影响[J]. 种子,2011,30(9): 48-51.
[2]薛晓兵.中国烤烟种子引发包衣技术研究进展[J]. 种子,2012,31(2): 60- 63.[3]坎平,王莎莎,马文广,等. 赤霉素引发同时提高烟草种子及幼苗抗旱性和抗冷性[J]. 种子,2014,33(2): 30-38.
[4]韦青侠. 天达-2116对葡萄生长发育的影响[D]. 西北农林科技大学,2002.
[5]杨文平. 天达-2116对冬小麦生长发育调控效应的研究[D]. 西安:西北农林科技大学,2002.
[6]龙友华,李华,何腾兵. 天达-2116 对玉米生长、产量及品质的调节效应[J]. 广东农业科学,2012,(23):1-3.
[7]龙友华,夏锦慧. 天达-2116 浸种对马铃薯的调节效应[J]. 湖北农业科学,2009,48(5):1084-1085.
[8]于仁竹,于贤昌,王桂红. 壳聚糖对黄瓜幼苗生长和生理特性的影响[J]. 西北农业学报,2003,12(4):102-104.
[9]刘伟,杨广玲,王金信,等. 0.3%壳聚糖水剂对番茄产量和病害发生的影响[J]. 现代农药,2004,3(2):30-32.
[10]田香华,杨军,侯明生. 几丁低聚糖对烟草黑胫病菌及寄主防御酶的影响[C]. 中国植物病理学会,2006.
[11]商文静. 壳寡糖对烟草花叶病毒的诱导抗病作用和体外抑制作用[D]. 西安:西北农林科技大学,2006.
[12]李合生,陈崔莲,洪玉枝. 植物生理生化试验原理和技术[M]. 北京:高等教育出版社,2000: 153-156.
[13]Moerschbacher B M,Noll U M,Flott B E,etal. Lignin biosynthetic enzymes in stem rust infected,resistant and susceptible near-isogenic wheat lines[J].PhysiologicalandMolecularPlantPathology,1988,33(1): 33-46.[14]Dhindsa R S,Plumb P,Thorpe T A. Leaf senescence: correlated with increased levels of membrane permeability and lipid-peroxidation and decreased levels of superoxide dismutase and catalase[J].JournalofExperimentalBotany,1981(32): 93-101
[15]Kochba J,Lavee S,Spiegel P. Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic ‘Shamouti’ orange ovular callus lines[J].PlantandCellPhysiology,1977(18):463-467.
[16]Bradford W W. A rapid and sensitive method for the quantization of microgram quantities of protein utilization the principle of protein-dye binding[J].Analyticalbiochemistry,1976(72): 248-254.
[17]张志良,瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社,2002.
[18]杜娟,申磊,孙艳香. 氨基酸对NaCI胁迫下棉苗生理性状及脯氨酸含量的影响[J]. 江苏农业科学,2014,42(7): 99-102.
[19]严金龙,许琦,蔡照盛,等. 甲壳低聚糖的制备、特性与应用研究进展[J]. 安徽化工,2005(1): 24-27.
[20]李落叶.低聚糖诱导小麦抗病性的研究[D]. 西安:西北农林科技大学,2002.
[21]周自云.低聚糖激发子诱导杨树细胞抗病机制的研究[D]. 西安:西北农林科技大学,2004.
[22]郑连英.甲壳低聚糖的研究进展[J]. 材料科学与工程,1999,17(3): 97-100.[23]杨文平,胡喜巧.天达-2116 拌种对冬小麦18种子萌发和幼苗生长特性的影响[J]. 广东农业科学,2010(8):28-29.
[24]孙群,王建华,孙宝启.种子活力的生理和遗传机理研究进展[J].中国农业科学,2007,40(1):48-53.
[25]杜世章,刘婷婷,代其林,等. 辐照对烟草抗氧化酶活性的影响[J]. 中国农业科技导报,2012,14(1): 72-75.
[26]于汉寿,吴汉章,杨冰.壳聚糖抑制植物病害的研究进展[J]. 天然产物研究与开发,2000,12(3); 94 -96.
[27]刘春阳,郑玉红,陆波,等. 废弃矿山生态复绿常用17种植物叶绿素含量及SOD和POD活力测定[J]. 环境监测管理与技术,2012,24(1): 14-19.
[28]JUNG K H ,H UR J ,RYU C H,etal, Characterization of a rice chlorophyll deficient mutant using the T-DNA gene-trap system[J].PlantCellPhysiol, 2003,44(5): 463 -472.
[29]N AKANISHI H,NOZUE H,SUZUKI K,etal. Characterization of the Arabidopsis thaliana mutant pcb 2 which accumulates diviny l chlorophylls [J].PlantCellPhysiol, 2005,46(3): 467 -473.
[30]ZH ANG H,LI J,YOO J H,etal.Rice Chlorina-l and Chlorina-9 encode ChlD and ChlI subunits of Mg-chelatase,a key enzyme for chlorophyll synthesis and chloroplast development[J] .PlantMol.Biol,2006,62: 325 -337.
[31]HUANG X Q,ZHAO H X,DONG CH L,etal. Chlorophyll-deficit rice mutants and their research advances in biology[J].ActaBot.Boreal.-Occident.Sin, 2005,25(8): 1685 -1691.
[32]王平荣,张帆涛,高家旭,等. 高等植物叶绿素生物合成的研究进展[J]. 西北植物学报,2009,29(3): 629- 636.
[33]王红红,李凯荣,侯华伟. 油菜素内酯提高植物抗逆性的研究进展[J]. 干旱地区农业研究,2005,23(3): 213-218.
[34]尹显慧,简芳,龙友华. 微生物菌剂仙丰168对番茄种子萌发及早期幼苗生长的影响[J]. 广东农业科学,2013,40(17): 28-37.
[35]刘桂智,朱英波,杜金有,等. 壳聚糖在农业上的应用研究进展[J]. 中国农学通报,2007,23(8): 377-381.
Effects of two kinds of oligosaccharidesonthe on seed germination and early seedling growth of Tobacco
YUQian1,YINXian-hui1*,CHENXue2,HUANGHua-gang2,DAIYuan-feng2,YUHui-ping2
(1.InstituteofCropProtection,GuizhouUniversity,Guiyang,Guizhou550025,China; 2.BijieTobaccoCompanyofGuizhouProvince,Bijie,Guizhou551700,China)
Tobacco seeds were soaked in different concentrations of two kinds of oligosaccharides. To study their effects on tobacco seed germination,early-stage seedlings growth and physiological and biochemical property. Seed germination was recorded every day. After 30 days,the morphologicalcharacteristics of early-stage seedling were examined. The physiological and biochemical indicators (chlorophyll contents,MDA contents,soluble protein contents,proline content,cell membrane permeability,SOD activity,POD activity and CAT activity) of early-stage seedling leaves were measured,respectively. The results showed that both oligosaccharide treatments had inhibition on seed germination of tobacco.However,during the growing season,the treatments could supplement seedling nutrition,improve the growth and development.
tobacco;oligosaccharide;seed germination;seedling growth;physiological and biochemical indexes
1008-0457(2016)03-0079-07国际DOI编码:10.15958/j.cnki.sdnyswxb.2016.03.016
2015-11-07;修回日期:2015-12-10
中国烟草总公司贵州省公司科技项目“毕纳1号气候斑和马铃薯Y病毒病流行机理及防控技术研究”(201311);贵州省烟草公司毕节市公司科技项目“毕纳1号气候斑和马铃薯Y病毒病流行机理及防控技术研究”(BJYC-201304);贵州大学大学生“SRT计划”项目“生物制剂对烟草种子萌发及早期幼苗生长的影响”(贵大SRT字(2014)088号)。
尹显慧(1978-),女,博士,副教授,主要研究方向:有害生物绿色治理及农产品质量安全;E-mail:16678192@qq.com。
S572
A

