簇集蛋白在急性脑梗死中的表达及其临床意义
徐 艳,李辉华
(1.江西省宜春市人民医院干部综合病房 336000;2.南昌大学第一附属医院神经内科,南昌 330006)
簇集蛋白在急性脑梗死中的表达及其临床意义
徐艳1,李辉华2△
(1.江西省宜春市人民医院干部综合病房336000;2.南昌大学第一附属医院神经内科,南昌 330006)
目的探讨簇集蛋白(CLU)在急性脑梗死(ACI)中的表达及其临床意义。方法选取2013年5~12月于南昌大学第一附属医院住院(首次发病48 h内)的ACI患者154例作为ACI组,根据神经功能缺损程度、有无斑块进行亚分组,另选取45例同期体检健康者作为对照组,检测血清CLU、补体C3水平,进行美国国立卫生院神经功能缺损评分(NIHSS)及Barthel指数评定,随访康复经过及结局至发病后90 d,比较分析血清CLU水平。结果ACI组患者血清CLU、补体C3水平均较对照组增高,差异均有统计学意义(P<0.01),且ACI患者血清CLU与补体C3水平呈正相关(r=0.430,P=0.000)。有斑块、神经功能缺损程度重的患者血清CLU水平高于无斑块、神经功能缺损程度轻的患者,差异均有统计学意义(P<0.01或P<0.05)。除痊愈与显效患者血清CLU水平比较差异无统计学意义(P>0.05),其余各预后类型患者血清CLU水平比较,差异均有统计学意义(P<0.01或P<0.05),血清CLU水平越低患者康复情况越好。结论CLU在脑梗死发生后可调节补体系统发挥作用,血清CLU水平与ACI患者颈动脉斑块、神经功能缺损程度及预后均相关,可作为ACI患者病情评估及指导预后的生化指标之一。
急性脑梗死;簇集蛋白;神经功能缺损;补体C3;Barthel指数
脑血管疾病是目前导致人类死亡的三大主要疾病之一,其发病率逐年上升,在中低收入国家形势尤其严峻[1]。其中,脑梗死是脑血管病最常见的类型。随着脑缺血的发生,各种信号通路介导的自由基、兴奋性氨基酸、补体系统等激活,引起细胞凋亡、组织损伤等过程,脑内随之发生理化指标的变化[2]。急性脑梗死(acute cerebral infarction,ACI)后损伤的病理过程非常复杂,既往研究较多的是其脑损伤因素,而脑损伤过程中的脑保护因素研究则相对较少[3]。簇集蛋白(clusterin,CLU)是一种急性期反应蛋白,具有多种生物学功能,包括保护细胞、延缓细胞凋亡、调节脂质转运、调节补体系统等,在正常生理状态下其表达水平很低,在应激的病理状态下其表达水平升高[4-5]。CLU在阿尔茨海默病、脑梗死、脑出血、多发性硬化、癫痫等多种神经系统疾病中均呈高表达,且研究已证实CLU在上述疾病的病理过程中主要发挥神经元保护作用[6]。本研究通过检测两组血清CLU、补体C3水平,探讨其在脑梗死中的意义,并随访康复经过及结局至发病后90 d,以对预后情况进行分析。
1 资料与方法
1.1一般资料选取2013年5~12月于南昌大学第一附属医院神经内科住院(首次发病48 h内)的ACI患者154例作为ACI组(动脉粥样硬化型),男99例,女55例;年龄41~88岁,平均(64.16±12.01)岁;其中有高血压病史者101例,糖尿病史者39例,吸烟史者51例,饮酒史者38例;均符合2004年中国脑血管病防治指南的诊断标准,并全部经头颅CT或(和)磁共振成像(MRI)证实为脑梗死,排外房颤、风湿性心脏病、心肌炎等引起的其他类型脑梗死。另选取45例年龄、性别相匹配的同期体检健康者作为对照组,男25例,女20例;年龄39~87岁,平均(62.11±12.57)岁;其中有高血压病史者24例,糖尿病史者7例,吸烟史者13例,饮酒史者8例,均经头颅CT或(和)MRI排除脑梗死。两组在年龄、性别比例、吸烟及饮酒率、高血压及糖尿病患病率方面比较,差异无统计学意义(P>0.05)。
1.2方法入院时进行美国国立卫生院神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS)及Barthel指数评定,并对患者进行分组。(1)采用彩色多普勒超声诊断仪检测颈动脉内膜中层厚度(intima-media thicknes,IMT)以确定是否有动脉粥样硬化斑块形成(IMT>1.5 mm判为斑块形成),根据颈动脉彩色多普勒超声(图1)诊断结果将其分为:无斑块组(37例),无颈动脉粥样斑块;硬斑块组(49例),颈动脉粥样斑块呈高回声;软斑块组(68例),颈动脉粥样斑块呈低回声或混合回声。(2)根据NIHSS评分将其分为:轻度组(61例),0~6分;中度组(68例),7~15分;重度组(25例),大于或等于16分。根据入院时及发病90 d的Barthel指数变化判断患者预后:症状、体征恢复正常,Barthel指数为100分判为痊愈;症状、体征明显好转,Barthel指数增加超过25分判为显效;病情好转但不明显,Barthel指数增加5~25分判为进步;症状、体征无好转甚至加重,Barthel指数无变化或减少判为无效。随访所有患者的康复经过及结局至发病后90 d。
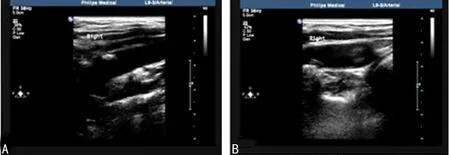
A:颈动脉硬斑;B:颈动脉软斑。
图1颈动脉彩色多普勒超声
1.3观察指标运用酶联免疫吸附试验(ELISA)测定CLU水平,CLU试剂盒购自武汉优尔生科技股份有限公司;运用免疫比浊法检测补体C3水平,补体C3试剂盒购自美国Beckman Coulter公司。
2 结 果
2.1ACI组与对照组颈动脉斑块发生率、CLU及补体C3水平比较与对照组比较,ACI组患者颈动脉斑块发生率、血清CLU及补体C3水平均升高,差异均有统计学意义(P<0.05)。见表1。
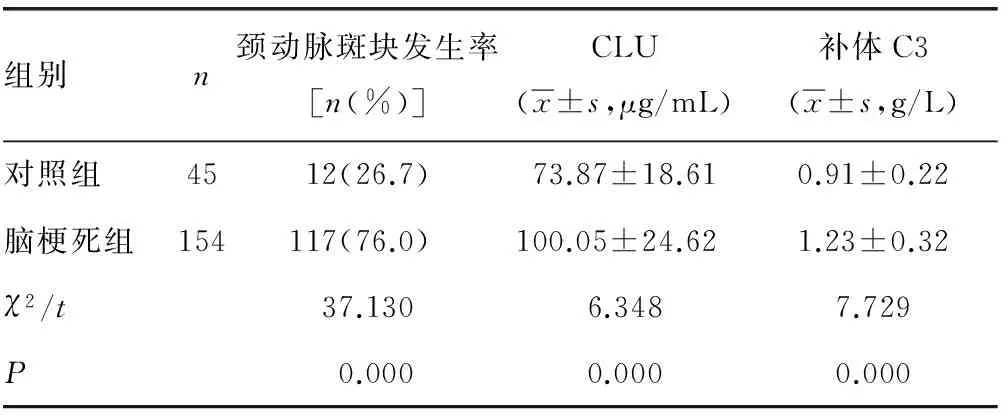
表1 ACI组与对照组颈动脉斑块发生率、CLU及补体C3水平比较
2.2ACI患者血清CLU与补体C3的相关性ACI患者血清CLU水平与C3呈正相关(r=0.430,P=0.000)。
2.3不同ACI亚组血清CLU水平比较
2.3.1不同神经功能缺损程度ACI亚组血清CLU水平比较3个亚组患者血清CLU水平比较,差异有统计学意义(F=7.979,P=0.000);其中,重度组患者血清CLU水平较轻度及中度组增高,差异均有统计学意义(P<0.01或P<0.05);中度组患者血清CLU水平较轻度组增高,差异有统计学意义(P<0.01)。见表2。
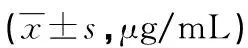
表2 不同神经功能缺损程度ACI亚组血清CLU水平比较
*:P<0.01,与轻度组比较;#:P<0.05,与中度组比较。
2.3.2不同颈动脉斑块ACI亚组血清CLU水平比较3个亚组患者血清CLU水平比较,差异有统计学意义(F=2.843,P=0.003);其中,硬斑块组与软斑块组患者血清CLU水平均较无斑块组升高,差异均有统计学意义(P<0.05或P<0.01);软斑块组患者血清CLU水平较硬斑块组升高,但差异无统计学意义(P=1.000)。见表3。
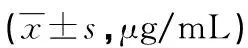
表3 不同颈动脉斑块ACI亚组血清CLU水平比较
*:P<0.05,#:P<0.01,与无斑块组比较。
2.3.3不同预后ACI患者血清CLU水平比较随访观察154例ACI患者,其中死亡7例,进行专业康复锻炼者8例,入院时无日常生活活动能力障碍者35例,失访3例,均予以剔除,剩余的101例患者中痊愈39例、显效25例、进步27例、无效10例。4种预后类型患者血清CLU水平比较,差异有统计学意义(F=2.477,P=0.000),且血清CLU水平从痊愈到无效逐渐升高;除痊愈与显效患者血清CLU水平比较差异无统计学意义(P>0.05),其余各预后类型患者血清CLU水平比较,差异均有统计学意义(P<0.01或P<0.05)。见表4。
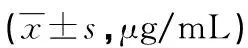
表4 不同预后ACI患者血清CLU水平比较
*:P<0.01,与痊愈患者比较;#:P<0.05,与显效患者比较;△:P<0.05,与进步患者比较。
3 讨 论
de Silva等[7]于1989年通过免疫亲和层析法从人血浆中分离出CLU,其主要存在于人血浆高密度脂蛋白与极高密度脂蛋白中。CLU由CLU基因(OMIM 185430)编码,基因定位于8号染色体的 p21-p12。CLU因选择性剪切的差异及细胞器不同共有3种亚型,分别为细胞内的核型CLU(nCLU)、细胞外的分泌型CLU(sCLU)、亚型11036(也称胞质型CLU),其生物学功能各异。sCLU为主要存在形式,是生理状态下的常见类型,具有抗细胞凋亡的作用,并且是目前研究最为深入的一种亚型,同时也是本研究测定的亚型;其他两种亚型在化学刺激、电离辐射、某些药物等应激条件下产生,nCLU有促细胞凋亡的作用,亚型11036是mRNA变异型[8-9]。目前,CLU的研究多集中在肿瘤方向上,其与脑梗死的研究较少。
本研究发现,CLU与动脉硬化明显相关,斑块组患者血清CLU水平明显高于无斑块组。动脉粥样硬化为脑梗死的基础病变,其基本病变是动脉内膜的脂质沉积,内膜灶状纤维化进而形成粥样斑块。CLU促进胆固醇外流,在一定程度上可对抗早期动脉粥样硬化[7]。CLU-高密度脂蛋白(CLU-HDL)呈双峰密度提示其将胆固醇从外周组织转运到肝脏中的独特机制[10]。Seo等[11]研究发现,CLU通过抑制特异性蛋白1(Sp1)与肝脏X受体(LXR)的活性,从而抑制胆固醇调节结合蛋白-1c(SREBP-1c)的表达,进而抑制脂质的过度积聚。张锦等[12]在研究正常及动脉粥样硬化动脉内膜的CLU表达时发现,正常动脉内膜未见CLU沉积,动脉粥样病变的动脉内膜可见CLU沉积,且动脉粥样病变越严重,CLU沉积越严重,尤其在泡沫细胞,研究认为CLU可促进泡沫细胞的胆固醇外流,并有抗氧化应激损伤的作用,其作为保护因子对抗动脉粥样硬化。但是,近年的研究在CLU的作用是抗动脉粥样硬化,还是促进动脉粥样硬化这一问题上仍存在争议。Shirasawa等[13]报道,CLU表达降低后,可通过p21、p53诱导血管平滑肌细胞(VSMC)停留在G1期,从而抑制血管平滑肌的增殖。Hamada等[14]在采用Apo E敲除小鼠(Apo E-KO组)、CLU敲除小鼠(CLU-KO组)和双基因敲除小鼠(D-KO组)的研究中发现,D-KO组VSMC增殖较ApoE-KO组减少,血管平滑肌的肿瘤坏死因子-α(TNF-α)和早期生长反应基因-1(Egr-1)的表达也下调。该研究表明抑制CLU可能通过下调Egr-1、TNF-α的表达,从而抑制血管平滑肌的增殖及抗动脉粥样硬化。不过现有的基础研究大多数还是倾向于CLU具有抗动脉粥样硬化的作用。
脑缺血发生后补体、炎性因子等产生增多并被激活,其后释放的血管活性物质可介导内皮细胞损伤,诱发平滑肌的增殖、炎性反应和血栓形成[15]。CLU可与补体结合位点相结合,从而影响膜攻击复合物(MAC)的形成[16]。而补体C3的激活在脑缺血发生后继发的各种炎性损伤中是一个关键环节。Mocco等[17]研究发现,脑缺血大鼠补体C3缺乏后可减轻氧化反应,并且补体C3缺乏后梗死面积减少了34%,同时NIHSS也下降。李艳玲等[18]在大鼠永久性局灶性脑梗死实验中发现梗死小鼠手术侧CLU的表达明显增高,与补体C3表达呈明显正相关,认为CLU在脑缺血后随着补体系统激活、活性补体产生增多而代偿性增高抑制补体的活性,从而抑制神经元受损凋亡。并且CLU有利于神经元的形成、生长,增加突触的形成,Wicher等[19]发现CLU干预过的神经元复杂程度较对照组明显增高,提示其有利于神经元的可塑性。本研究发现,脑梗死患者补体C3水平明显升高,提示脑梗死发生后有补体系统的激活,且CLU与补体C3水平呈正相关,这与李艳玲等[18]的实验结果相一致,进一步支持了脑梗死发生后CLU水平代偿性升高以抑制补体活性的观点。
本研究还发现,脑梗死不同亚组患者血清CLU水平均有差异,神经缺损程度越严重,CLU水平越高,提示病情越重,CLU代偿性产生越多以抗细胞凋亡、保护神经元。这也在基础实验中得到证实,Wehrli等[20]用大量表达CLU的转基因小鼠、敲除CLU基因的小鼠、野生型小鼠进行小鼠大脑中动脉栓塞(MCAO)实验,结果发现脑缺血发生后脑缺血区神经胶质细胞和炎性细胞的产生及脑损伤严重程度在CLU敲除小鼠最明显,其次为野生型小鼠,大量表达CLU的小鼠最轻微并且细胞凋亡最少,研究认为CLU在脑缺血区及缺血半暗带区具有抗炎、抗细胞凋亡的作用,可减轻缺血性脑组织的损伤,发挥着神经元保护性作用。本研究中,脑梗死患者的预后情况评定采用Barthel指数,已有研究证实Barthel指数不限种族,适用于各类人群,与其他常用卒中量表,如NIHSS、改良的Rankin量表(MRS)一样具有良好的有效度和适用度[21]。预后研究中观察到从显效、进步到无效,随康复效果的下降,血清CLU水平呈现逐渐升高的趋势,认为血清CLU水平能在一定程度上预测脑梗死患者的预后情况。CLU作为急性时期的一种多功能糖蛋白,随着脑缺血损伤而代偿性增高反映了病情的严重程度,即在一定程度上反映脑缺血损伤时的炎性、神经元受损、补体系统激活程度等,故能在一定程度上评估预后情况。
综上所述,CLU与脑梗死的病情及预后具有相关性,有望成为脑梗死病情评估及判断康复效果的生化指标之一。CLU与既往发现的载脂蛋白相比其生物功能较复杂,现有的研究主要集中在肿瘤方面,与脑血管病相关的研究不多,尤其在国内,其参与神经元保护、抗细胞凋亡等的机制还未完全阐明,在人群中的研究还需要进一步增加样本量,并有待更多及进一步的动物实验、离体实验探讨CLU的生物功能,以及其参与脑梗死损伤后的具体保护机制。此外,还可以深层次地研究其与遗传因素间的关系,在未来可将其作为多种神经系统疾病的治疗靶点进行研究。
[1]Feijin VL,Lawes CM,Bennett DA,et al.Wordwide stroke incidence and early case fatality reported in 56 population-ased studies:a systematic review[J].Lancet Neurol,2009,8(4):355-369.
[2]Imhof A,Charnaya Y,Valleta PG,et al.Sustained astrocytic clusterin expression improves remodeling after brain ischemia[J].Neurobiol Dis,2006,22(2):274-283.
[3]Brouns R,De D.The complexity of neurobiological processes in acute ischemi stroke[J].Clin Neurol Neurosurg,2009,111(6):483-495.
[4]Zoubeidi A,Gleave M.Small heat shock proteins in cancer therapy and prognosis[J].Int J Biochem Cell Biol,2012,44(10):1646-1656.
[5]Sabatte J,Faigle W,Ceballos A,et al.Semen clusterin is a novel DC-SIGN ligand[J].J Immunol,2011,187(10):5299-5309.
[6]Elliott DA,Weickert CS,Garner B.Apolipoproteins in the brain: implications for neurological and psychiatric disorders[J].Clin Lipidol,2010,5(4):555-573.
[7]de Silva HV,Stuart WD,Park YB,et al.Purification and characterization of apolipoprotein J[J].J Biol Chem,1990,265(24):14292-14297.
[8]Rizzi F,Coletta M,Bettuzzi S.Chapter 2: Clusterin(CLU): from ong gene and two transcripts to many proteins[J].Adv Cancer Res,2009(104):9-23.
[9]Rizzi F,Bettuzzi S.The clusterin paradigm in prostate and breast carcinogenesis[J].Endocr Relat Cancer,2010,17(1):R1-17.
[10]De Silva HV,Stuart WD,Duvic CR,et al.A 70-kDa apolipoprotein designated ApoJ is a marker for subclasses of human plasma high density lipoproteins[J].J Biol Chem,1990,265(22):13240-13247.
[11]Seo HY,Kim MK,Jung YA,et al.Clusterin decreases hepatic SREBP-1c expression and lipid accumulation[J].Endocrinology,2013,154(5):1722-1730.
[12]张锦,宇红,王虹.载脂蛋白J与动脉粥样硬化的免疫组织化学研究[J].中华病理学杂志,1999,28(5):369.
[13]Shirasawa T,Miyata M,Eto H,et al.Deficiency of clusterin inhibits neointimal hyperplasia after vascular injury[J].J Atheroscler Thromb,2009,16(6):772-781.
[14]Hamada N,Miyata M,Eto H,et al.Loss of clusterin limits atherosclerosis in apolipoprotein E-deficient mice via reduced expression of Egr-1 and TNF-α[J].J Atheroscler Thromb,2011,18(3):209-216.
[15]Acosta J,Qin X,Halperin J.Complement and complement regulatory proteins as potential molecular targets for vascular disease[J].Curr Pharm Des,2004,10(2):203-211.
[16]Mcdonald JF,Nelsestuen GL.Potent inhibition of terminal complement assembly by clusterin: characterization of its impact on C9 polymerization[J].Biochemistry,1997,36(24):7464-7473.
[17]Mocco J,Mack WJ,Ducruet AF,et al.Complement component C3 mediates inflammatory injury following focal cerebral ischemia[J].Circ Res,2006,99(2):209-217.
[18]李艳玲,何志义.大鼠脑梗死模型中载脂蛋白J mRNA表达的研究[J].辽宁医学院学报,2008,29(4):308-310.
[19]Wicher G,Fex-Svenningsen A,Velsecchi IA,et al.Extracellular clusterin promotes neuronal network complexity in vitro[J].Neuroreport,2008,19(15):1487-1491.
[20]Wehrli P,Charnay Y,Vallet P,et al.Inhibition of post-ischemic brain injury by clusterin overexpression[J].Nat Med,2001,7(9):977-979.
[21]Cincura C,Pontes-Neto OM,Neville IS,et al.Validation of the National institutes of health stroke scale,modified rankin scale and barthel index in Brazil: the role of cultural adaptation and structured interviewing[J].Cerebrovasc Dis,2009,27(2):119-122.
Expression and clinical significance of clusterin in acute cerebral infarction
XuYan1,LiHuihua2△
(1.CadreComprehensiveWard,YichunMunicipalPeople′sHospital,Yichun,Jiangxi336000,China;2.DepartmentofNeurology,FirstAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
ObjectiveTo investigate the expression and clinical significance of clusterin(CLU) in acute cerebral infarction(ACI).MethodsA total of 154 inpatients with ACI within 48 h of the first onset in the First Affiliated Hospital of Nanchang University from May to December 2013 served as the ACI group and divided into subgroups according to the neural function defection degree and whether having plaque.Contemporaneous 45 individuals undergoing the healthy physical examination were selected as the control group.The serum CLU and complement C3 levels were detected.The National Institutes of Health Stroke Scale (NIHSS) and Barthel index scores were conducted,the rehabilitation course and outcome until 90 d after onset were followed up,and the comparative analysis on serum CLU level was performed.ResultsThe serum CLU and complement C3 levels in the ACI group were significantly higher than those in the control group,the differences were statistically significant(P<0.01),moreover serum CLU was positively correlated with the complement C3 level in ACI patients(r=0.430,P=0.000).The CLU level in the patients with plaque and severe neural function defection was higher than that in the patients without plaque and mild neural function defection,the differences were statistically significant(P<0.01 orP<0.05).Except serum CLU level had no statistical difference between the recovery group and significantly effective group (P>0.05),the serum CLU level had statistically significant differences among other prognosis types of the patients groups (P<0.01 orP<0.05).The lower the serum CLU level,the rehabilitation the better.ConclusionCLU play a role by regulating the complement system after cerebral infarction occurrence,serum CLU level is correlated with carotid arterial plaque,neurological function defection degree and prognosis in ACI patients,which can serve as one of biochemical indicators for evaluating the disease condition and guiding prognosis in ACI patients.
acute cerebral infarction;clusterin;neural function impairment;complement C3;Barthel index
徐艳(1984-),主治医师,硕士,主要从事脑血管疾病研究。△
,E-mail:huihua2009@163.com。
R743.3
A
1671-8348(2016)21-2942-04
2016-01-18
2016-04-05)
论著·临床研究doi:10.3969/j.issn.1671-8348.2016.21.019

