常压室温等离子诱变选育L-天冬酰胺酶高产重组菌
陈 璇,刘 松,冯 岳,堵国成*,陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
常压室温等离子诱变选育L-天冬酰胺酶高产重组菌
陈璇1,2,刘松1,2,冯岳1,2,堵国成1,2*,陈坚1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
以Bacillus subtilis WB600为宿主,构建了能分泌表达L-ASNase的重组菌,并通过常压室温等离子体诱变进一步提高了重组菌的产酶量。重组Bacillus subtilis WB600(pMA5-wapA-ansZ)发酵30 h,胞外酶活达到37.2 U/mL,表明L-ASNase在信号肽wapA介导下能分泌至胞外。在功率120 W、气流量10 L/min、诱变时间40 s的诱变操作条件下,对重组菌进行了等离子体诱变。突变株的酶活最高达48.4 U/mL,较诱变前提高30%。上述结果表明,常压室温等离子体诱变能有效提高重组菌产L-ASNase的酶活.研究结果为L-ASNase的工业化生产提供了高效的生产菌株。
L-天冬酰胺酶;枯草芽孢杆菌;异源表达;常压室温等离子体诱变
L-ASNase(Asparaginase,EC3.5.1.1),是一种酰胺基水解酶,能催化天冬酰胺水解生成天冬氨酸和氨。在临床上,L-ASNase常与其他药物联合用于治疗急性淋巴细胞白血病(ALL)及某些淋巴瘤与肥大细胞瘤等癌症[1-4]。此外,L-ASNase能有效分解致癌物质丙烯酰的前体天冬酰胺,使之成为欧美国家在食品安领域中近期关注的热点酶种之一。Jia等[5]人的研究中,添加L-ASNase处理的土豆切片高温油炸后丙烯酰胺的含量减少了82%。Kukurova等[6]人在小麦面粉中添加L-ASNase,丙烯酰胺的含量减少了90%。因此,实现L-ASNase的高效生产是国内外研究的热点。
ASNase广泛存在于微生物中,包括欧文氏杆菌(Erwinia carotovora),产气肠杆菌(Enterobacter aerogenes),嗜热细菌(Thermus thermophilus),灰色链霉菌(Streptomycesgriseus),大肠杆菌(Escherichia coli),绿脓假单胞菌(Pseudomonas aeruginosa)等[7-10]。Baskar等[11]运用响应面法优化野生菌Enterobacter aerogenes的L-ASNase发酵,酶活为19.13 U/mL。关于L-ASNase重组表达研究亦有 报 道 。来源于 Streptomyces和Flammulina velutipes的L-ASNase在E.coli中表达后,酶活分别达到23.02 U/mL和16 U/mL[12-13]。Gilbert等人[14]在Escherichia coli和 Erwinia Carotovor表达了来源于Erwinia chrysanthemi的L-ASNase,酶活提高至49 U/mL。总体而言,微生物发酵法产L-ASNase的产量较低,且重组表达的宿主仅限于非食品安全的大肠杆菌。
以氦气为气源的大气压射频辉光放电等离子体能引起DNA分子的断裂,研究者基于此开发了常压室温等离子体(Atmospheric and Room Tempera-ture Plasma,ARTP)诱变育种仪[15]。相较于紫外诱变等传统诱变技术,ARTP诱变具有诸多优点:离子体的温度低,活性离子的浓度高且种类多样,操作简单,成本低,对环境无污染,诱变速度快(数分钟以内),突变率高,突变库容量大等[16]。ARTP诱变已经成功地用于谷氨酰胺转氨酶[17]、丁醇[18]、脂肪酶[19]、油脂[20]等产品高产菌株的诱变育种,已逐渐成为一种微生物快速进化育种的重要平台技术。
作者将来源于B.subtilis 168 L-ASNase表达于食品安全的B.subtilis WB600,并通过ARTP诱变系统对重组菌进行诱变,获得了L-ASNase高产突变株。
1材料与方法
1.1材料
1.1.1菌株与质粒大肠杆菌 Escherichia coli JM109,B.subtilis 168,B.subtilis WB600以及质粒pMA5-wapA(在pMA5质粒的NdeI-BamHI序列之间插入wapA信号肽):均为作者所在实验室保存。
1.1.2酶、试剂、引物和DNA序列测定限制性内切酶、DNA连接酶、PrimeSTAR HS DNA聚合酶、小片段DNA回收试剂盒以及琼脂糖凝胶DNA回收试剂盒:TaKaRa公司;氨苄青霉素、硫酸卡那霉素、质粒提取试剂盒:生工生物工程(上海)股份有限公司;引物合成和DNA测序也由该公司完成。蛋白质Marker和SDS-PAGE凝胶配制试剂盒:Fermentas公司和碧云天公司;L-天冬酰胺:Sigma公司;蛋白胨、酵母粉:OXID公司;其余试剂均为国产分析纯。
1.1.3培养基大肠杆菌的培养以及 B.subtilis WB600种子培养用LB培养基(g/L):酵母浸出粉5,蛋白胨10,NaCl 10;固体培养基添加2 g/dL的琼脂。Bacillus subtilis WB600发酵培养基(g/L):蔗糖35,蛋白胨15,尿素0.8,玉米浆12,K2HPO42.612,KH2PO42.041,MgSO4·7H2O 1.845,NaCl 3,L-天冬酰胺1;pH 7,氨苄青霉素100 μg/mL,硫酸卡那霉素50 μg/mL。
1.2方法
1.2.1重组菌的构建根据GenBank提供的Bacillus subtilis 168的L-ASNase的基因序列ansZ,设计引物G19F和G19R,引物具体见表1。PCR扩增条件为:98℃3 min;98℃30 s;50℃30 s;72℃70 s;30个循环;72℃延伸5 min。将扩增得到的ansZ基因片段与pMD18-T-simple连接,转化E.coli感受态细胞JM109。涂布平板,37℃培养过夜,提取质粒。用和BamH I和EcoR I分别双酶切pMD18-T-simple/ansZ和pMA5-wapA,再用TaKaRa DNA Ligation Kit中的连接酶连接,构建重组质粒pMA5-wapA-ansZ。连接过夜后转化E.coli感受态细胞JM109,通过菌落PCR验证筛选阳性克隆。挑选阳性克隆于含100 μg/mL氨苄青霉素的LB培养基中,37℃培养过夜,提取质粒进行酶切验证及测序鉴定。采用化学转化法[21]转化重组质粒pMA5-wapA-ansZ至B.subtilis WB600,在含有50 μg/mL卡那霉素(Km)平板上挑选阳性克隆。菌落PCR并酶切验证,构建成功的重组菌于-80℃甘油管保藏。

表1 引物序列Table 1 Sequences of primers
1.2.2重组菌的表达在37℃、200 r/min下,用LB培养基培养B.subtilis WB600(pMA5-wapA-ansZ)10 h,然后转接于B.subtilis WB600发酵培养基中,发酵30 h后检测胞外酶活。
1.2.3ARTP诱变方法利用清华大学与思清源公司研发的常压室温等离子体育种机(ARTP)对重组菌液进行诱变。在诱变功率、工作气流量及等离子体发射源与样品载片距离一定的条件下,诱变的可操作参数为处理时间。为了得到最佳诱变条件,首先需要得到重组菌的致死率曲线,操作条件见表2。诱变处理后的样品稀释涂布平板,用CFU方法计算致死率。

表2 B.subtilis WB600(pMA5-wapA-ansZ)的ARTP诱变条件Table 2 ARTP operating conditions of B.subtilis WB600 (pMA5-wapA-ansZ)
1)初筛:将经过ARTP诱变后的种子悬浮液稀释涂布于筛选平板上,于37℃培养12 h。将平板上的单菌落接种于含有种子培养基的96浅孔培养板中,于37℃培养10 h,然后转接于装有发酵培养基的96深孔培养板中。将96深孔培养板放在96孔摇床上培养30 h后测定酶活,酶活高于原始菌株10%以上的记为正突变株。
2)复筛:将初筛所得的菌株接种于液体种子培养基中,37℃、200 r/min培养10 h。然后将种子转接到装有发酵培养基的250 mL三角瓶中,接种体积分数3%,37℃、200 r/min培养2 d,取发酵上清液测定酶活。
1.2.4遗传稳定性分析为了分析突变株的遗传稳定性,在固体平板上进行5次传代培养,对每代菌株进行发酵,然后测定其L-ASNase活性。
1.2.5L-ASNase酶活测定采用奈氏试剂法[22]测定ASNase的酶活。反应分两步进行。1)酶解反应:1 mL磷酸盐缓冲液(10 mmol/L,pH 7.5)、300 μL酶液、100 μL底物,37℃反应30 min后加入100 μL三氯乙酸终止反应。混匀后12 000 r/min离心2 min;2)显色反应:第一步酶解反应液200 μL,3.3 mL去离子水,500 μL奈氏试剂,混匀后于436 nm处测定吸光值。
酶活性单位定义:每分钟水解L-天冬酰胺生成1 μmol氨所需要的酶量定义为L-ASNase活力单位(U/mL)。
标准曲线用(NH4)2SO4测定:配制18 mmol/L的(NH4)2SO4的标准溶液,分别加入0、50、100、150、200、250、300、350、400 μL,用去离子水补至 400 μL,然后加入1 mL磷酸盐缓冲液 (10 mmol/L,pH 7.5),37℃反应30 min后加入100 μL三氯乙酸终止反应。混匀后于12 000 r/min离心2 min,然后进行显色反应。
1.2.6菌体生物量的测定利用分光光度计检测经适当稀释的菌液在600 nm波长处的吸光度值,即OD600。
1.2.7蔗糖质量浓度的测定采用蒽酮-浓硫酸法测定发酵液中蔗糖的质量浓度,见文献[23]。
2结果与讨论
2.1重组菌的构建与表达
以合成的B.subtilis 168基因组为模板,利用引物G19F和G19R扩增L-ASNase基因,所得PCR产物大小为1071bp,见图1-3。将该基因片段连接至表达载体pMA5-wapA的wapA信号肽下游,得到重组载体pMA5-wapA-ansZ,见图2-3。测序验证后,将pMA5-wapA-ansZ转化B.subtilis WB600,得到重组菌B.subtilis WB600(pMA5-wapA-ansZ)。

图1PCR产物电泳Fig.1 Electrophoretic analysis of PCR products

图2 质粒双酶切电泳Fig.2 Electrophoretic analysis of double digested products

图3 重组表达质粒pMA5-wapA-ansZ的构建Fig.3 Construction of pMA5-wapA-ansZ
重组菌B.subtilis于37℃发酵30 h,取发酵上清液进行酶活及SDS-PAGE分析。在重组菌的发酵上清液中,可见相对分子质量约38 000的蛋白质条带,与L-ASNase的理论相对分子质量一致,见图4。而对照的发酵上清液则未见此条带,表明LASNase在B.subtilis WB600中成功实现了分泌表达。经酶活分析,重组表达的L-ASNase能分泌至胞外,且胞外酶活达37.2 U/mL。

图4SDS-PAGE分析L-ASNase的分泌表达Fig.4 SDS-PAGE analysis of the secretory expression of L-ASNase
2.2ARTP诱变致死率曲线的测定
王立言等[24]前期研究发现,等离子体对微生物细胞壁和细胞膜以及蛋白质都具有显著影响。等离子体中含有的大量的高能自由基团和活性离子,能破坏细胞结构,不断击穿微生物导致其死亡。同时在形成等离子体的过程中,伴随产生的部分紫外线也能引起细菌的死亡。而只有少数经过ARTP处理后的微生物通过自身的修复系统存活下来,并在这一过程中发生基因突变。因此选择合适的诱变操作条件有利于快速有效的筛选突变株。
如图5所示,随着处理时间的增加,B.subtilis WB600(pMA5-wapA-ansZ)菌体的致死率不断提高,处理10 s致死率就达到了89.2%,20 s致死率接近 100%。但是处理 30 s发现致死率下降为70.6%。出现这一现象的原因可能是由于菌体经一定量的等离子体处理后激发了菌体自身的修复作用,当修复作用强于等离子体的破坏作用时,菌体的致死率会有所下降。但随着等离子体注入的时间的增加,等离子体对菌体的破坏作用大于其修复作用时,菌体致死率上升。可以看到等离子体处理40 s时,致死率达99%以上。处理时间大于40 s后,菌体全部死亡。以酶活高出对照10%为正突变株,B.subtilis WB600(pMA5-wapA-ansZ)诱变40 s的正突变率达26%,因此将本研究的诱变时间定为40s。
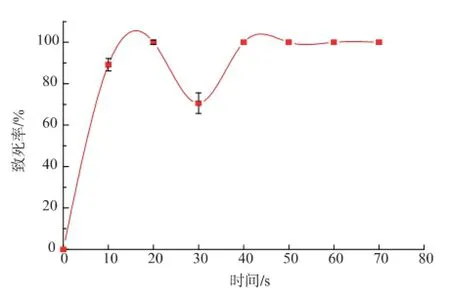
图5 B.subtilis WB600(pMA5-wapA-ansZ)的诱变致死率曲线Fig.5 Mutation of the lethal rate of the B.subtilis WB600 (pMA5-wapA-ansZ)with the ARTP treatment
2.3突变菌株的筛选
以初筛酶活提高10%作为正突变株,正突变率达26%。然后在摇瓶上进行复筛,并对突变株进行编号。复筛的结果见图6。筛选到一株正向突变株HG-10,酶活为48.4 U/mL,是出发菌株酶活的1.3倍。

图6 B.subtilis WB600(pMA5-wapA-ansZ)(HG)及突变株的酶活分析Fig.6 L-ASNase activity analysis of 15 mutants and B.subtilis WB600(pMA5-wapA-ansZ)(HG)
2.4突变株发酵特性分析
为了进一步了解重组菌与突变株的生长发酵情况,对它们的生长、蔗糖消耗以及产酶情况进行了研究。如图7所示,重组菌B.subtilis WB600 (pMA5-wapA-ansZ)和突变菌株HG-10对糖的利用情况比较一致。前期0~6 h,菌体生长较缓慢,耗糖比较少,几乎不产酶。6~18 h,菌体生长进入对数期,由于菌体大量增殖,发酵培养液中蔗糖质量分数急剧下降,此时产酶速率增大。突变菌株HG-10的生长较原始重组菌快。18 h后菌体生长进入稳定期,产酶量继续上升。对于绝大多数胞外酶来说,酶的合成与菌体的生长呈大致平行的关系,生长停止时,酶产量达到最大,继续培养酶的产量可能会下降[25]。原始重组菌的稳定期较短,菌体衰亡较快。而突变株HG-10稳定期比较长,菌体衰亡的较慢,这可能是HG-10酶活提高的原因。

图7 B.subtilis WB600(pMA5-wapA-ansZ)(HG)和突变株HG-10发酵曲线Fig.7 Growth,sucrose comsuption and enzyme production curve of mutant HG-10 and B.subtilis WB600(pMA5-wapA-ansZ)
2.5突变株遗传稳定性分析
按照1.2.4的方法,对突变株HG-10生产LASNase的遗传稳定性进行了考察,见图8。酶活分析结果表明,连续传代5次,突变株酶活范围在43.8~46.5 U/mL,每代酶活变化幅度较小。以上结果说明突变株HG-10具有较好的遗传稳定性,与本研究结果类似,野生菌经等离子诱变后得到的突变株的遗传稳定性较高。夏书琴等[17]考察了产谷氨酰胺转氨酶的野生菌茂源链轮丝菌(Streptoverticillium mobaraense)经等离子体诱变后的遗传稳定性,3个突变株酶活水平下降幅度均小于10%。金丽华等[20]研究发现,圆红冬孢酵母(Rhodosporidium toruloides)突变体的增殖速度和产油脂量都保持稳定。

图8 突变株HG-10的遗传稳定性分析Fig.8 Analysis of genetic stability for mutant HG-10
3结语
作者以B.subtilis WB600为宿主,构建了一株高效分泌 L-ASNase重组菌 B.subtilis WB600 (pMA5-wapA-ansZ),胞外酶活达到37.2 U/mL。通过ARTP诱变技术获了B.subtilis WB600(pMA5-wapA-ansZ)的突变株,胞外酶活提高至48.4 U/mL,较诱变前提高30%,且突变株具有较高的遗传稳定性。上述结果表明,通过以食品安全的B.subtilis构建产L-ASNase重组菌并进行ARTP诱变,是获得L-ASNase高产菌有效方法,为L-ASNase发酵生产提供了高产菌株。此外,对重组菌进行物理诱变的策略也为其它产酶重组菌的优化提供了有益参考。
[1]Rob Pieters,Stephen P Hunger,Joachim Boos,et al.L-asparaginase treatment in acute Lymphoblastic leukemia[J].Cancer,2011,117(2):238-249.
[2]Avramis V I,Tiwari P N.Asparaginase native ASNase or pegylated ASNase in the treatment of acute lymphoblastic leukemia[J]. Int J Nano Medicine,2006,1:241-254.
[3]J D BROOME.Evidence that the L-asparaginase activity of guinea pig serum is responsible for its antilymphoma effects[J]. Nature,1961,191:1114-1115.
[4]Oettgen H F,Old L J,Boyse EA,et al.Inhibition of leukemias in man by L-asparaginase[J]. Cancer Research,1967,27(12):2619-2631.
[5]Mingmei Jia,Meijuan Xu,Beibei He,et al.Cloning,expression,and characterization of L-asparaginase from a newly isolated Bacillus subtilis B11-06[J].J Agric Food Chem,2013,61:9428-9434.
[6]Kukurova K,Morales F J,Bednarikova A,et al.Effect of L-asparaginase on acrylamide mitigation in a fried-dough pastry model [J]. Mol Nutr Food Res,2009,53:1532-1539.
[7]Pritsa A A,Papazisis K T,Kortsaris A H,et al.Antitumor activity of L-asparaginase from Thermus thermophilus[J].Anticancer Drugs,2001,12(2):137-142.
[8]H Geckil,S Gencer.Production of L-asparaginase in Enterobacter aerogenes expressing Vitreoscilla hemoglobin for efficient oxygen uptake[J].Appl Microbiol Biotechnol,2001,63:691-697.
[9]Yasser R Abdel-Fattah,Zakia A Olama.L-asparaginase production by Pseudomonas aeruginosa in solid-state culture:evaluation and optimization of culture conditions using factorial designs[J].Process Biochemistry,2002,38:115-122.
[10]Ashraf A El-Bessoumy,Mohamed Sarhan,Jehan Mansour.Production,isolation,and purification of L-asparaginase from Pseudomonas aeruginosa 50071 using solid-state fermentation[J]. J Biochem Mol Biol,2004,37:387.
[11]G Baskar,M Dharmendira Kumar,A Anand Prabu,et al.Optimization of carbon and nitrogen sources for L-asparaginase production by Enterobacter aerogenes using response surface methodology[J]. Chem Biochem Eng,2009,23(3):393-397.
[12]Hatanaka T,Usuki H,Arima J,Uesugi Y,et al.Extracellular production and characterization of two streptomyces L-asparaginases [J].Appl Biochem Biotechnol,2010,163:836-844.
[13]Eisele N,Linke D,Bitzer K,Na'amnieh S,et al.The first characterized asparaginase from a Basidiomycete,Flammulina velutipes [J].Bioresour Technol,2011,102:3316-3321.
[14]Gilbert H J,Blazek R,Bullman H M S,et al.Cloning and expression of the Erwiniachrysanthemi asparaginase gene in Escherichia coli and Erwinia carotovora[J].J Gen Microbiol,1986,132,151-160.
[15]Guo Li,He ping Li,Li yan Wang,et a1.Genetic effects of radio-frequency,atmospheric-pressure glow discharges with Helium[J]. Applied Physics Letters,2008,92(22):39-42.
[16]夏书琴,刘龙,张东旭,等.大气压辉光放电低温等离子体诱变选育谷氨酰胺转氨酶高产菌株[J].微生物学通报,2010,37 (11):1642-1649. XIA Shuqin,LIU Long,ZHANG Dongxu,et al.Mutation and election of transglutaminase producing strain by atmospheric pressure glow discharge plasma[J].Microbidogy China,2010,37(11):1642-1649.(in Chinese)
[17]王风芹,原欢,谢慧,等.丁醇高产菌株诱变育种及其发酵条件优化研究[J].中国酿造,2011,5:84-86. WANG Fengqin,YUAN Huan,XIE Hui,et al.Mutation breeding of butanol high-yielding strain and its fermentation condition optimization[J].China Brewing,2011,5:84-86.(in Chinese)
[18]陈靖,王斌,李德明,等.疏棉状嗜热丝孢菌耐热脂肪酶在无孢黑曲霉中的高效表达[J].食品工业科技,2012,20:160-163. CHEN Jing,WANG Bin,LI Deming,et al.Effectively expression of Thermomyces anuginosus thermastable lipase in non-spore Aspergillus niger[J]. Science and Technology of Food Industry,2012,20:160-163.(in Chinese)
[19]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467. JIN Lihua,FANG Mingyue,ZHANG Chong,et al.Operating conditions for the ropid mutation of the oleaginous yeast by atmospheric and room temperature plasmas and the characteristics of the mutants[J].Chinese Journal of Biotechnology,2011,27(3):461-467.(in Chinese)
[20]Reilly B E,Spizizen J.Bacteriophage deoxyribonucleate infection of competent Bacillus subtilis[J].Journal of Bacteriology,1965,89:782-790.
[21]Shifrin S,Parrott C L,Luborsky S W.In vitro assembly of L-asparaginase subunits[J].J Biol Chem,1974,249:1335-1340.
[22]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,2006.
[23]Wang L Y,Huang Z L,Li G,et a1.Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma[J].Journal of Applied Microbiology,2010,108(3):851-858.
[24]陈石根.酶学[M].上海:复旦大学出版社,2001.
Screening of High L-Asparaginase Activity Mutants of Recombinant Bacteria WB600 by Atmospheric and Room Temperature Plasmas Mutation System
CHEN Xuan1,2,LIU Song1,2,FENG Yue1,2,DU Guocheng1,2*,CHEN Jian1,2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
L-asparaginase(L-ASNase)can catalyze the deamidation of L-asparagine(a precursor of toxic acrylamide)to L-aspartic acid and ammonia,and it is thus an important food enzyme.This study used Bacillus subtilis WB600 as the expression host,successfully realizing the secretory expression of L-ASNase.By using the atmospheric and room temperature plasmas(ARTP)mutation system,the titer of the recombinant L-ASNase was improved further.After 30 h fermentation,extracellular enzyme activity of recombinant B.subtilis WB600(pMA5-wapA-ansZ)reached 37.2 U/mL.This result suggested that L-ASNase can secrete to the medium mediated by a signal peptide of wapA.When treated with the ARTP at power input 120 W and gas flow rate 10 L/min for 40 s,a mutant of B.subtilis WB600(pMA5-wapA-ansZ)with a activity of 48.4 U/mL was obtained,the activity value was increased by 30%.These results suggested that ARTP mutation system can be used to improve the production of L-ASNase of recombinant strains.This study provided a good L-ASNase producing strain to fermentation production at an industrial scale.
L-asparaginase,Bacillussubtilis,heterologousexpression,atmosphericandroom temperature plasmas mutation
Q 814
A
1673—1689(2016)05—0485—07
2014-11-10
国家863计划项目(2011AA100905);国家973计划项目(2012CB720806)。
*
堵国成(1965—),男,江苏常州人,工学博士,教授,博士研究生导师,主要从事代谢工程、发酵过程优化与控制等方面的研究。E-mail:gcdu@jiangnan.edu.cn

