屎肠球菌和枯草芽孢杆菌混合培养条件的优化
胡治铭, 梁丛丛,国洪旭,邓先余,林连兵
(昆明理工大学 生命科学与技术学院,云南 昆明650500)
屎肠球菌和枯草芽孢杆菌混合培养条件的优化
胡治铭, 梁丛丛,国洪旭,邓先余,林连兵*
(昆明理工大学 生命科学与技术学院,云南 昆明650500)
以屎肠球菌和枯草芽孢杆菌为研究对象,以MRS培养基为基础培养基,采用单因素试验、Box-Behnken实验设计对屎肠球菌和枯草芽孢杆菌的混合培养进行优化。结果表明:初始pH、装液量和氮源对活菌数影响显著。最优条件为:初始pH 6.5、装液量50/500 mL、氮源用量35 g/L、接种比1∶12、转速180 r/min,在此条件下活菌数达到6.99×1010CFU/mL,比优化前提高了5倍,屎肠球菌菌株和枯草芽孢杆菌菌株的活菌数分别达到4.58×1010CFU/mL和2.41×1010CFU/mL。
屎肠球菌;枯草芽孢杆菌;混合培养
益生素(Probitics)俗称益生菌、生菌素、微生态制剂等,是活的微生物饲料添加剂[1]。它在改善动物体内微生态或酶的平衡、预防疾病、提高饲料利用率、促进生长及净化养殖环境等方面发挥重要作用[2]。益生素中常用的益生菌包括乳酸菌、芽孢杆菌、酵母菌和霉菌。
屎肠球菌为动物肠道益生菌,能提供一些必需氨基酸和维生素、产生酶类帮助宿主消化、发酵产生乳酸降低肠道pH、分泌细菌素从而抑制致病菌的生长,并且以粘附抗性和竞争排斥限制有害菌体内定植[3]。枯草芽孢杆菌能够产生维生素、各种酶以及多种代谢产物,对饲料的降解消化吸收和动物的营养代谢起到促进作用[4],还能够产生抗菌素、刺激畜禽的免疫器官发育,从而提高机体免疫力[5]。
屎肠球菌为兼性厌氧菌,枯草芽孢杆菌为好氧菌,两者的生长特性及营养要求差异很大。屎肠球菌在培养过程中产生的细菌素等抑菌物质会阻碍枯草芽孢杆菌的生长繁殖,两者的混合发酵过程十分复杂,控制其过程比较困难,特别是生产上两者的混合发酵难以实现[6],因此工业生产中通常采用单独培养,然后再混合的工艺,由此造成设备利用率低、周期延长、生产成本增加。
有研究表明,枯草芽孢杆菌对乳酸菌的生长有促进作用,并且在溶氧较高时,枯草芽孢杆菌生长十分迅速。据此,作者通过对屎肠球菌和枯草芽孢杆菌菌株单独培养,对培养基中的碳源、氮源、营养因子等成分和培养条件如温度、初始pH、装液量、转速等因素进行优化,获得能够同时显著促进屎肠球菌和枯草芽孢杆菌菌株生物量的因素,然后通过响应面试验的优化,探索能够提高两种微生物混合培养生物量的方法。
1材料与方法
1.1材料
1.1.1菌种屎肠球菌(Enterococcus faecium)ET11菌株和枯草芽孢杆菌(Bacillus subtilis)BY06菌株:由作者所在实验室保存。
1.1.2培养基
1)MRS液体培养基(g/L):蛋白胨10.0,牛肉膏10.0,酵母粉 5.0,C6H12O6·H2O 20.0,K2HPO4·3H2O 2.0,(NH4)2HC6H5O72.0,CH3COONa·3H2O 5.0,MgSO4·7H2O 0.2,MnSO4·H2O 0.04;吐温-80 1.0 mL/L,pH 6.2~6.8。
2)LB液体培养基(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0。
1.2试验方法
1.2.1种子液制备将斜面保存的枯草芽孢杆菌BY06菌株接种LB液体培养基,37℃、150 r/min摇床培养14 h,连续增殖三代,备用。将斜面保存的屎肠球菌ET11菌株接种MRS液体培养基,37℃静置培养14 h,连续增殖三代,并用MRS液体培养基进行稀释,使以上两种菌液的菌体浓度一致,备用。
1.2.2摇瓶培养将种子液按照3%的接种体积分数接入装有150 mL培养基的500 mL三角瓶中,37℃、150 r/min摇床培养16 h,进行单因素和响应面的发酵条件研究。
1.2.3发酵培养基组分对屎肠球菌和枯草芽孢杆菌生物量的影响
1)碳源对生物量的影响:分别用蔗糖、麦芽糖、乳糖等量替代MRS液体培养基中的葡萄糖。
2)氮源对生物量的影响:分别用蛋白胨、胰蛋白胨、牛肉膏、酵母粉、硫酸铵等量替代MRS液体培养基中的混合氮源(蛋白胨+牛肉膏+酵母粉)。
3)营养因子对生物量的影响:在MRS液体培养基中分别添加体积分数5%的西红柿汁、胡萝卜汁、土豆汁、玉米汁[7]、无菌水,用于最适营养因子的筛选。
1.2.4发酵条件对屎肠球菌和枯草芽孢杆菌生物量的影响
1)温度对生物量的影响:分别设置28、32、37、42℃4个温度梯度作为摇床培养温度。
2)初始pH对生物量的影响:针对屎肠球菌分别设置 5、5.5、6、6.5、7、7.5、8、8.5、9共 9个 pH梯度;针对枯草芽孢杆菌分别设置6、6.5、7、7.5、8、8.5、9共7个pH梯度。
3)转速和装液量:针对枯草芽孢杆菌分别设置100、150、180、210 r/min共 4个转速梯度和 50 mL/500 mL、70 mL/500 mL、100 mL/500 mL、150 mL/500 mL、200 mL/500 mL、250 mL/500 mL共6个装液量梯度用于筛选最适转速和装液量。
1.2.5混合培养最适接种比筛选将屎肠球菌和枯草芽孢杆菌按照1∶3、1∶5、1∶8、1∶10、1∶12、1∶15接种体积分数接种到MRS培养基中,筛选最适的接种比。
1.2.6混合培养的响应面优化根据Box-Benhnken实验设计原理和先前已做的单因素筛选,选取对屎肠球菌和枯草芽孢杆菌皆有显著影响的初始pH、氮源、装液量3个因素为Box-Benhnken实验设计的自变量,以总活菌数为响应值,通过响应面分析(Response Surface Analysis,RSA)进行混合培养条件的优化。响应面设计因素水平见表1。
1.2.7测定方法由于两种菌的菌落形态差异较大,故单独培养和混合培养时每种菌的活菌数的测定均采用平板稀释涂布计数法;pH测定仪测定菌液pH。
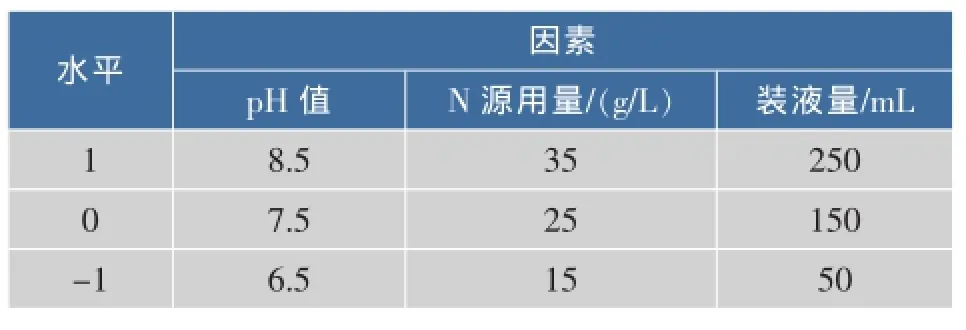
表1 响应面试验因素水平表Table 1 Factors and levels of response surface
1.2.8数据处理采用 Microsoft Excel 2003整理实验数据并绘制表格;采用SPSS21进行统计分析。
2结果与分析
2.1发酵培养基组分对屎肠球菌和枯草芽孢杆菌生物量的影响
碳源是微生物生长繁殖最基本的营养物质,ET11菌株和BY06菌株对各种碳源均可利用但差异不显著 (P>0.05)。ET11菌株的最适碳源为麦芽糖,对应的活菌数为6.2×109CFU/mL;BY06菌株的最适碳源为蔗糖,对应的活菌数为9.6×108CFU/mL。
氮源利用结果见图1。由图1可知,ET11菌株和BY06菌株均可利用各种有机氮源并且差异较为显著(P<0.05),且二者的最适氮源都是混合氮源,对应的活菌数分别为 8.2×109CFU/mL和 9.5×108CFU/mL。ET11菌株和BY06菌株对无机氮源几乎都不能利用。
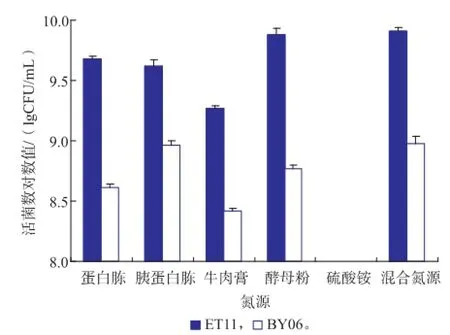
图1 氮源对ET11和BY06活菌数的影响Fig.1 Effects of nitrogen sources on the viable counts of strain ET11 and strain BY06
在添加了各种不同的营养因子之后,ET11菌株和BY06菌株的生物量均有所增加但差异不显著,并且以土豆汁和胡萝卜汁的加入效果最为明显,土豆汁中含有ET11菌株较易利用的糖类、矿物质和维生素等,而BY06菌株较易利用胡萝卜汁中的各种营养物质[8],ET11菌株和BY06菌株的活菌数分别为8.0×109CFU/mL和1.5×109CFU/mL。
2.2发酵条件对屎肠球菌和枯草芽孢杆菌生物量的影响
细胞内的酶都有其最适温度,无论外界温度是低于还是高于此温度,都会影响酶的活性,进而影响菌体的代谢活动,而且培养温度不同,菌体的细胞膜流动性也会不同。ET11菌株和BY06菌株的最适生长温度分别是42℃和37℃。对应的活菌数分别为7.3×109CFU/mL和1.1×109CFU/mL。
培养基pH会影响菌体细胞膜内外的电荷状态,从而使细胞膜的渗透性发生改变,而且还会改变营养物质的离子化状态,二者的共同作用会影响菌体细胞对营养物质的吸收,改变菌体的生长状态。由图2可知,ET11菌株和BY06菌株生物量都随着pH的变化而变化,且差异较为显著。ET11菌株在pH 7.5~9范围内生长较好,pH为8.5时生物量最高,活菌数为1.3×1010CFU/mL;BY06菌株的适宜生长范围为pH 6~7,当pH为6.5时BY06菌株的生物量最高,其活菌数为2.0×109CFU/mL。
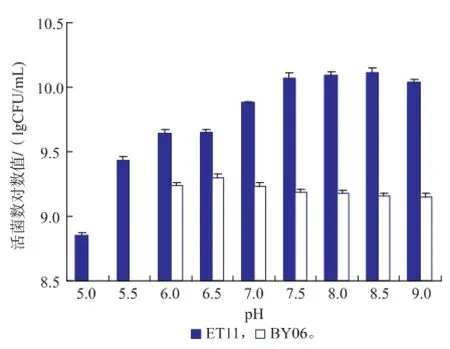
图2 初始pH对ET11和BY06活菌数的影响Fig.2 Effects of initial pH on the viable counts of strain ET11 and strain BY06
装液量和转速都会影响溶氧水平,装液量越少则溶氧越多,越利于好氧菌的生长,反之亦然,但是较少的装液量会增加经济成本。在一定范围内,随着转速的提高溶氧也会增加,但是如果转速过大,虽然溶氧较多,但较高的剪切力会对菌体细胞造成伤害,影响菌体的生长。BY06菌株的最适转速为180 r/min,活菌数为2.2×109CFU/mL,由图3可知,BY06菌株的最适装液量为50 mL,活菌数为4.6× 109CFU/mL。
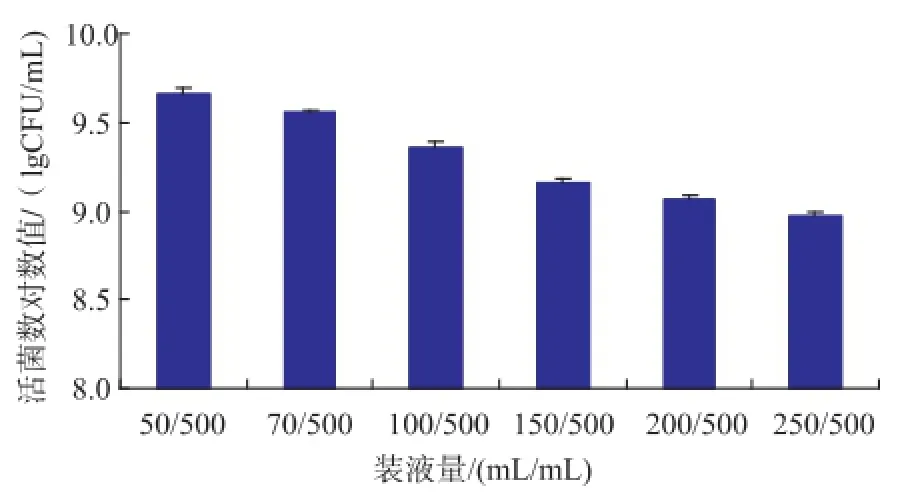
图3 装液量对BY06活菌数的影响Fig.3 Effects of liquid volume on the viable counts strain BY06
2.3接种比对混合培养总生物量的影响
混合培养时总的生物量随着接种比的减小而呈现出先增大后减小的趋势,当ET11与BY06接种比为1∶12时,总的生物量最高,其活菌数为1.3× 1010CFU/mL。屎肠球菌属于乳酸菌,能降低pH值,合成分泌细菌素等抑菌物质,从而抑制枯草芽孢杆菌的生长,当ET11和BY06二者接种比较小时,枯草芽孢杆菌数量多,能迅速繁殖,待含氧量减小,有利于乳酸菌的繁殖且分泌细菌素,此时枯草芽孢杆菌已形成数量上的优势,故最后表现为二者的生物量都比较高。但如果二者的接种比过小,就会造成枯草芽孢杆菌的过快繁殖,从而快速消耗培养基中的养分,乳酸菌的繁殖受到影响,最终的总生物量就会下降。
2.4混合培养的响应面优化:
根据实验设计表进行了17次试验,实验设计和方差分析见表2-3。
利用Design Expert 8.0拟合实验结果并以 Y代表响应值,以A、B、C分别代表初始 pH、氮源、装液量,得到回归方程:
Y=28.43-5.77A+4.26B-12.28C+1.98AB+ 11.50AC+3.11BC-2.08A2+2.04B2+10.38C2
由表3可知,该模型达到极显著水平(P<0.01),失拟项不显著(P=0.002 5),这说明该方程在被研究的回归区域拟合较好;复相关系数R2=0.943 3,说明该模型相关性较好,试验误差小,可以用此模型对ET11菌株和BY06菌株的混合培养进行分析和预测。由对回归方程的方差分析表明,A、B对混合培养菌体浓度影响显著,C、AC影响极显著。
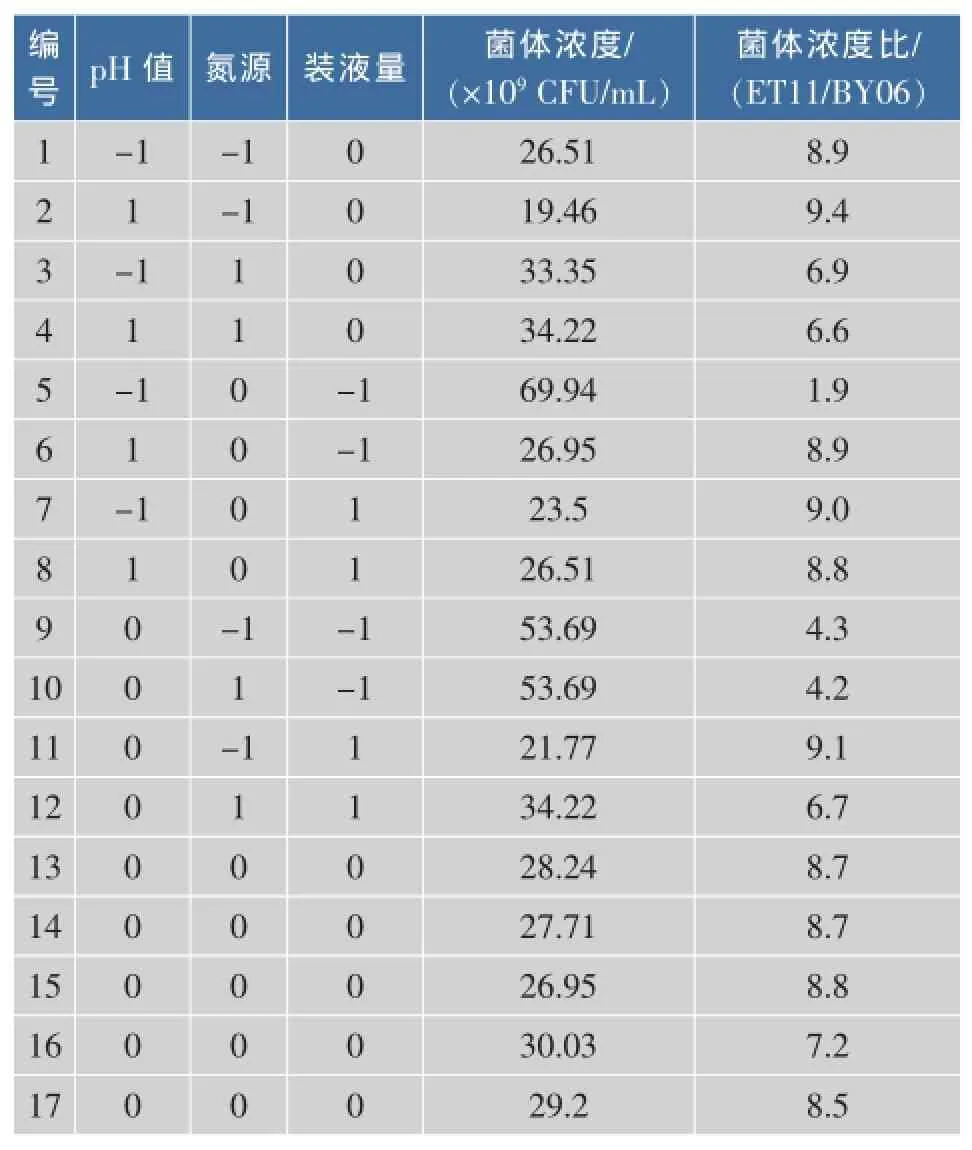
表2 响应面设计及试验结果Table 2 Experimental design and results of response surface
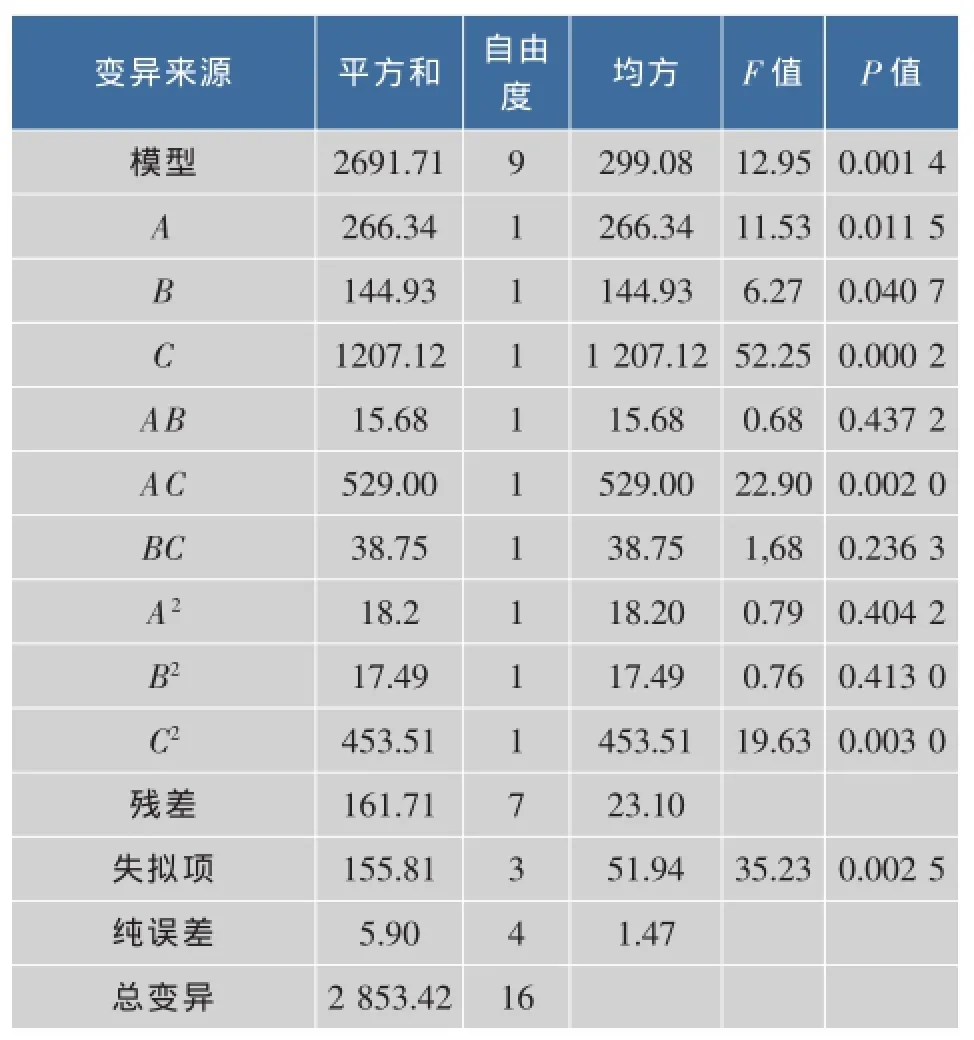
表3 方差分析Table 3 Analysis of variance
初始pH和装液量之间的三维响应曲面图见图4。由表2-3及图4可知,装液量对ET11菌株和BY06菌株混合培养的菌体浓度影响极为显著,随着装液量的减少,菌体浓度呈现明显的增加趋势,当装液量为50 mL时,菌体浓度呈现最大值6.994× 1010CFU/mL,ET11菌株菌体浓度为 4.581×1010CFU/mL,BY06菌 株 菌 体 浓 度 为 2.413×1010CFU/mL,并且和pH的交互作用也比较明显。当装液量为50 mL时,随着pH的降低,菌体浓度逐渐增加。pH和氮源对菌体浓度影响也较显著,当氮源含量增加且初始pH降低,菌体浓度也会随着增加,但二者的交互作用不明显。由响应面的等高点和等值线分析可知,在所选范围之内有极大值,极大值为6.994×1010CFU/mL,对应的氮源用量为35 g/L、初始pH为6.5、装液量为50 mL。以此条件进行3次验证性试验, 所得菌体浓度的均值为 6.989×1010CFU/mL,可见以上分析较为可靠。

图4 pH和装液量交互影响的响应面图Fig.4 Interactive effect of pH and liquid volume on the response surface
3结语
通过单因素试验研究了培养基成分(碳源、氮源、营养因子)和培养条件(温度、初始pH、转速、装液量)对屎肠球菌和枯草芽孢杆菌生物量的影响。氮源、初始pH、装液量对其影响比较显著,然后通过Box-Behnken实验和响应面分析优化并综合考量成本、易操作等因素得到二者混合培养的最优培养基配方为(g/L):蛋白胨14.0,牛肉膏14.0,酵母粉7.0,葡萄糖(C6H12O6·H2O)20.0,K2HPO4·3H2O 2.0,柠檬酸氢二铵 (NH4)2HC6H5O72.0,CH3COONa·3H2O 5.0,MgSO4·7H2O 0.2,MnSO4·H2O 0.04;pH 6.5。最优培养条件为:接种比(ET11/BY06)1∶12、装液量50 mL/500 mL、温度37℃、转速180 r/min。
孔健等混合培养乳酸杆菌和枯草芽孢杆菌,结果OD值得到了显著提高[9];赵镇国等利用廉价培养基混合培养植物乳杆菌、酿酒酵母及枯草芽孢杆菌得到了和利用MRS培养基相同的效果[10]。屎肠球菌和枯草芽孢杆菌在培养过程中都会产生抑菌物质,且枯草芽孢杆菌在培养过程中芽孢形成率也比较低。作者通过调节接种比、初始pH、装液量等因素让好氧的枯草芽孢杆菌快于屎肠球菌而迅速繁殖,然后带动和促进屎肠球菌的生长,以此减弱屎肠球菌对枯草芽孢杆菌的抑制作用,最终表现为混合培养的最高总生物量比单独培养的最高生物量提高了5倍,且此时 ET11菌株生物量为 2.413×1010CFU/mL,BY06菌株生物量为4.581×1010CFU/mL,为进一步研究屎肠球菌和枯草芽孢杆菌的混合培养提供了依据,也为以后的工业化益生素制备中的菌种混合发酵奠定了基础。
[1]李子平,靳月生,田树飞.益生素在动物生产中的应用[J].畜牧与饲料科学,2009,30(4):50-51. LIZiping,JIN Yuesheng,TIAN Shufei.Application ofprobiotics in animal production[J].Animal Husbandry and Feed Science,2009,30(4):50-51.(in Chinese)
[2]Gold M A,Brady W E,Lankes H A,et a1.A phase II study of a urokinase-derived peptide(A6)in the treatment of persistent or recurrentepithelialovarian,fallopiantube,orprimaryperitonealcarcinoma:agynecologiconcologygroupstudy[J].Gynecol Oncol,2012,125(3):635-639.
[3]黄庆生,王加启.饲料乳酸菌类益生素的作用机制和应用[J].动物营养学报,2002,14(4):12-17. HUANG Qingsheng,WANG Jiaqi.Probable mechanism and application of probiotic lactic acid bacteria[J].Chinese Journal of Animal Nutrition,2002,14(4):12-17.(in Chinese)
[4]Schlalmey M,Singh A,Ward O P.Developments in the use of Bacillus species for industrial production[J].Canadian Journal of Micorbiology,2004,50(1):1-17.
[5]周映华,吴胜莲,贺月林,等.饲用枯草芽孢杆菌发酵条件的优化[J].湖南农业科学,2010(11):21-23. ZHOU Yinghua,WU Shenglian,HE Yuelin,et al.Optimization of fermentation conditions of Bacillus subtilis feed[J].Hunan Agricultural Sciences,2010(11):21-23.(in Chinese)
[6]贺月林,郭照辉,谭周进,等.酵母菌与乳酸菌混合培养中试研究[J].现代农业科技,2010(2):29-31. HE Yuelin,GUO Zhaohui,TAN Zhoujin,et al.The pilot-scale study on the mixed culture of yeast and lactic acid bacteria[J]. Modern Agricultural Science and Technology,2010(2):29-31.(in Chinese)
[7]李用芳,李学梅,单英芳,等.嗜热链球菌和乳杆菌最佳促生长剂的选择[J].食品与发酵工业,1998,24(3):50-52. LI Yongfang,LI Xuemei,SHAN Yingfang,et al.Selection on the best growth promoter to Streptococcus thermophilus and Lactobacilli[J].Food and Fermentation Industries,1998,24(3):50-52.(in Chinese)
[8]田菊梅,梁琪,米兰,等.低温乳酸菌混菌培养增殖培养基的优化[J].中国酿造,2013,32(2):101-105. TIAN Jumei,LIANG Qi,MI Lan,et al.Optimization of enrichment medium of low temperature mixed lactic acid bacteria[J]. China Brewing,2013,32(2):101-105.(in Chinese)
[9]山东大学.一种乳酸杆菌和芽孢杆菌混合培养的方法[P].中国专利:201210581009.7,2013-04-03.
[10]沈阳禾丰生物技术有限公司.混合培养乳酸杆菌、酵母菌及芽孢杆菌不同菌属的培养基 [P].中国专利,201010193726.3,2011-04-06.
Study on Mixed Culture of Enterococcus faecium and Bacillus subtilis
HU Zhiming,LIANG Congcong,GUO Hongxu,DENG Xianyu,LIN Lianbing*
(College of Life Science and Technology,Kunming University of Science and Technology,Kuming 650500,China)
In order to investigate the effect of Enterococcus faecium and Bacillus subtilis mixed culture on their biomass,MRS medium,single factor experiment,Box-Behnken Design were adopted to optimize the mixed culture.Results showed that medium initial pH,liquid volume and nitrogen source had significant effects on the viable counts of the strains.The optimal culture conditions were as follows:initial medium pH 6.5,50 mL liquid medium in 500 mL flask with 180 rpm in shake,35 g/L of nitrogen source,the inoculation of Enterococcus faecium and Bacillus subtilis at a ratio of 1∶12.Under this conditions,the total viable counts reached to 6.99×1010CFU/mL,with 4.58×1010CFU/mL of Enterococcus faecium and 2.41×1010CFU/mL of Bacillus subtilis,which was five times higher than that of before optimization.
Enterococcus faecium,Bacillus subtilis,mixed culture
TQ 92
A
1673—1689(2016)05—0537—06
2014-11-13
云南省科技创新强省项目(2014AB015)。
*
林连兵(1969—),男,湖南通道人,理学硕士,教授,硕士研究生导师,主要从事应用微生物学方面的研究。E-mail:linlb@sohu.com

