幽门螺杆菌CagA和VacA基因型与IL-6、IL-8的关系研究
郭 皓,戚艳丽,张世同,李 慧,金建军
1.河南科技大学临床医学院河南科技大学第一附属医院消化内科,河南 洛阳 471003; 2.河南省洛阳市宜阳县人民医院消化内科
幽门螺杆菌CagA和VacA基因型与IL-6、IL-8的关系研究
郭 皓1,戚艳丽2,张世同1,李 慧1,金建军1
1.河南科技大学临床医学院河南科技大学第一附属医院消化内科,河南 洛阳 471003; 2.河南省洛阳市宜阳县人民医院消化内科
目的 观察幽门螺杆菌(Helicobacter pylori,H.pylori)的不同基因型与IL-6、IL-8之间的关系,了解H.pylori的致病机制。方法 采集91例经14C尿素呼气试验检测为H.pylori(+)患者血清,采用酶联免疫吸附试验(ELISA)对CagA、VacA进行定性分析,对IL-6、IL-8进行定量分析。结果 CagA(+)与CagA(-)中所含IL-6、IL-8含量差异有统计学意义(t=6.55、t=7.348,P<0.001);VacA(+)与VacA(-)中所含IL-6、IL-8含量差异有统计学意义(t=6.418、t=6.977,P<0.001);CagA、VacA均阳性中所含IL-6、IL-8的含量较CagA、VacA均阴性差异有统计学意义(t=6.438、t=7.231,P<0.001);CagA阳性患者血清中IL-6与IL-8含量呈正相关(r=0.672,P<0.01),VacA阳性患者血清中IL-6与IL-8含量呈正相关(r=0.664,P<0.01)。结论 CagA、VacA基因型与IL-6、IL-8之间有密切关系,IL-6、IL-8在H.pylori的致病机制中起重要作用,细胞因子在H.pylori感染诱导的炎症反应涉及多种细胞及多种细胞因子的相互作用。
幽门螺杆菌; 细胞毒素相关蛋白; 空泡细胞毒素; 白介素6; 白介素8
自1983年 Warren和Mashall从胃黏膜中分离出H.pylori后,国内外对其研究逐渐深化,流行病学研究显示发达国家成年人H.pylori感染率为30%~50%,而发展中国家则高达80%[1]。更深入、广泛的研究发现其与慢性胃炎、消化性溃疡、胃腺癌和黏膜相关淋巴组织淋巴瘤(MALT)的发生、发展密切相关[2]。关于H.pylori的致病机制,很多研究都提出空泡细胞毒素(Vacuolating cytotoxin A,VacA)和细胞毒素相关蛋白(Cytotoxin-associated protein,CagA)与H.pylori的致病有关,而也有部分研究表明免疫学功能紊乱学说也是本病的主要病理机制之一,认为细胞介导的免疫反应及大量细胞因子的释放,在H.pylori的病理过程中起着重要作用[3]。而白介素6(IL-6)、白介素8(IL-8)在两者之中的表达更是研究热点,因此本文旨在通过检测感染不同基因型H.pylori患者血清IL-6、IL-8的含量,分析对比,推测H.pylori的致病机制。
1 资料与方法
1.1 一般资料 收集2014年9月-2014年11月在河南科技大学第一附属医院消化内科经14C尿素呼气试验检测为H.pylori(+)的患者共91例,男38例,女53例,平均年龄(50.16±15.33)岁。入选标准:(1)所有病例经14C尿素呼气试验提示H.pylori感染,并均有胃镜检查结果,其中慢性浅表性胃炎43例、慢性隆起糜烂性胃炎9例、十二指肠球部溃疡9例、平坦糜烂性胃炎8例、反流性食管炎5例、胃溃疡5例、霉菌性食管炎3例、贲门炎3例、食管癌2例、胃息肉2例、幽门黏膜慢性炎2例;(2)排除严重心、脑、肝、肾以及内分泌系统疾病者;(3)排除4周内使用过影响H.pylori的药物,如质子泵抑制剂、H2受体拮抗剂、抗生素、铋剂、非甾体类消炎药等;(4)无HIV感染,无免疫系统疾病,近3个月内未使用过激素及免疫调节剂;(5)非肿瘤患者及孕妇。入选对象均于治疗前清晨空腹抽取肘静脉血3 ml,室温下静置1 h使血液自然凝集,离心30 min(4 000 r/min),收集上清液血清约500 μl,分装后放入-80 ℃冰箱保存待检。
1.2 研究方法
1.2.1H.pylori检测:采用14C尿素呼气试验。仪器购自深圳中核海得威生物科技有限公司。
1.2.2 CagA和VacA检测:采用酶联免疫吸附试验(ELISA法)检测CagA及VacA。
1.2.3 IL-6、IL-8含量测定:采用ELISA法,以上酶联免疫分析试剂盒,均为美国TSZ公司生产,上海酶联生物科技有限公司分装,严格按照说明书进行操作。首先将经14C尿素呼气试验检测为H.pylori(+)的91例患者,进行CagA和VacA的测定,然后进行血清IL-6、IL-8含量测定,再进行分层对比分析。

2 结果
2.1 各组患者血清IL-6、IL-8含量的比较 CagA阳性患者血清中IL-6、IL-8含量均高于CagA阴性患者,差异有统计学意义(P<0.05);VacA阳性患者血清中IL-6、IL-8含量均高于VacA阴性患者,差异有统计学意义(P<0.05,见表1)。


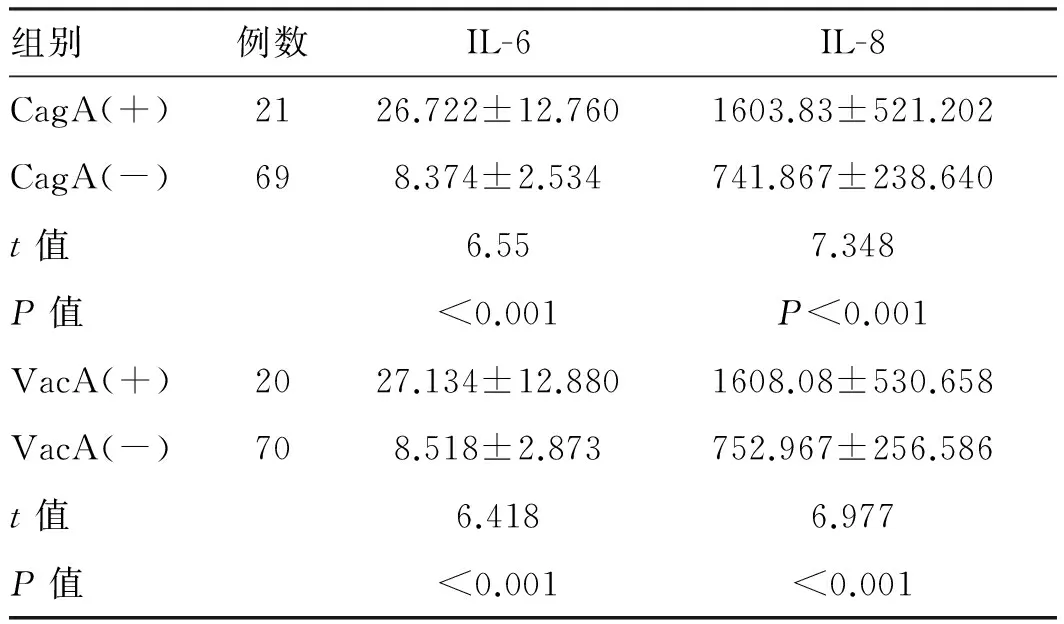
组别例数IL-6IL-8CagA(+)2126.722±12.7601603.83±521.202CagA(-)698.374±2.534741.867±238.640t值6.557.348P值<0.001P<0.001VacA(+)2027.134±12.8801608.08±530.658VacA(-)708.518±2.873752.967±256.586t值6.4186.977P值<0.001<0.001
注:有1例患者未完成检测。
2.2 CagA、VacA均阳性与CagA 、VacA均阴性者血清IL-6、IL-8的含量比较 CagA、VacA均阳性患者血清中IL-6、IL-8含量高于CagA、VacA均阴性患者,差异有统计学意义(P<0.05,见表2)。
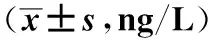
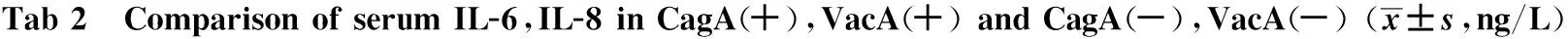

组别例数IL-6IL-8CagA(+)VacA(+)1927.598±13.0601637.672±527.969CagA(-)VacA(-)688.228±2.240737.982±234.488t值6.4387.231P值<0.001<0.001
2.3 CagA、VacA阳性者血清IL-6、IL-8的含量的相关性分析 CagA阳性者血清中IL-6与IL-8含量呈正相关(r=0.672,P<0.01);VacA阳性者血清中IL-6与IL-8含量也呈正相关(r=0.664,P<0.01,见图1~2)。

图1 CagA阳性患者血清IL-6、IL-8含量的相关性分析

图2 VacA阳性患者血清IL-6、IL-8含量的相关性分析
3 讨论
研究[4]显示,H.pylori是一种高度变异的菌种,其基因含有1 590个编码序列,具有多态性,正是这种高度的变异性及多态性决定了H.pylori的毒力和致病性,从而导致H.pylori感染后出现不同临床结局,其致病性的差异与其毒力基因型的多态性密切相关, 包括VacA基因和CagA基因及相应基因表达的蛋白质的致病性有关。
VacA基因包括两个显著多变的区域,即AA端编码信号肽第二部分约50 bp的S区和中间约700 bp的m区。所有H.pylori菌株的S区分为s1a、s1b、s1c、s2;m区分为m1a、m1b、m2三型。由不同信号序列和不同中间序列而构成的不同H.pyloriVacA基因型,不但与其H.pylori的毒力水平有关,而且有地区差异,其中以s1a/m1型空泡毒素毒性最强,s1/m2次之,而s2/m2则无细胞毒性。研究发现s1/m1型与胃癌和胃溃疡有关,s2/m2仅与胃溃疡有关[5]。
结合H.pylori感染后临床结局以及地区分布的多样性提示了其致病机制的复杂性,研究表明,H.pylori致病机制涉及H.pylori菌株类型、炎症、免疫、泌酸、氧化、遗传等多个方面[6]。有毒力基因(CagA、VacA)、细胞因子(IL-4、IL-6、IL-8)、毒力因子(膜蛋白、脂多糖、黏附素等)、自由基等多种H.pylori致病因子参与,各种因子之间既各自独立又相互影响。通过本研究,我们发现CagA(+)组与VacA(+)组中所含IL-6、IL-8含量高于CagA(-)组和VacA(-)组,差异有统计学意义,说明CagA、VacA两种基因型的致病机制与IL-6、IL-8有密切关系,为进一步说明,我们又将CagA、VacA均阳性与均阴性者IL-6、IL-8含量进行比较发现,两种基因型均阳性组明显高于均阴性组,差异有统计学意义。
从细胞因子的角度出发,H.pylori感染后,H.pylori与宿主相互作用,介导机体对细菌的免疫反应而导致IL-6、IL-8、TNF等一序列细胞因子表达上调,这些炎性因子在H.pylori感染后胃黏膜表达增加[7],通过本研究证明在两种基因型阳性患者血清中,细胞因子L-6、IL-8的含量呈高浓度,进一步论证了在H.pylori致病机制中,细胞因子IL-6、IL-8起较大的作用,并认为这些细胞因子构成一个复杂的炎性免疫调节网络,并通过旁分泌、内分泌等途径,作用于B淋巴细胞、NK细胞、巨噬细胞,使其在胃黏膜局部增殖、分化、激活,产生特异性和非特异性免疫反应,损伤局部组织,导致胃肠疾病的发生。
IL-6是由单核巨噬细胞、T细胞、B细胞等多种细胞产生的细胞因子,除具有免疫增强作用和造血促进作用外,还可参与炎症反应,Yamaoka等[8]研究显示,H.pylori感染后胃黏膜上皮细胞IL-6 mRNA表达率明显上升。IL-8主要由单核巨噬细胞、肿瘤坏死因子(TNF)、IL-1等细胞因子的刺激而产生,作为H.pylori相关胃炎发生、发展中的一个重要调节因子,其与CagA更为密切,研究证实,H.pylori可通过微生物IV型分泌系统(type IV secretion system,TISS)将CagA基因编码的毒力蛋白注入胃黏膜上皮细胞中,并诱导胃上皮细胞IL-8的过度表达与分泌,进而将大量嗜中性粒细胞趋化到胃黏膜部位,并导致炎性反应的加重[9]。童明宏等[10]研究显示,H.pylori感染患者高毒力菌株血清IL-8的水平高于低毒力菌株及未感染组,并认为H.pylori感染胃黏膜上皮细胞诱导分泌IL-8,且具有菌株特异性,即表达CagA的菌株其诱导分泌的IL-8水平高于不表达CagA的菌株。通过细胞因子间的相关性分析,本研究显示H.pylori感染患者血清中IL-8与IL-6水平呈正相关,提示H.pylori感染诱导的炎症反应涉及多种细胞及多种细胞因子的相互作用,而细胞因子的持续存在将进一步增强细胞对感染的反应,导致病变的加剧及延续。本研究进一步发现,在两组基因型的IL-6、IL-8浓度上,IL-8的浓度均明显高于IL-6,提示IL-6在CagA、VacA的表达以及参与程度较IL-8弱。
综上所述,H.pylori致病基因与宿主细胞因子间可能存在协同效应,这种交互效应的存在有助于解释H.pylori感染临床结局的复杂性,在探索方式上已经从单一的致病因素发展成现在从细菌-环境-宿主三方面及其相互作用中寻找答案,随着研究的深入,一些新的问题同样值得关注,如H.pylori既能逃逸宿主免疫防御而持续定植于胃黏膜,又能激发机体免疫反应致胃黏膜损伤,其机制仍不明确;IL-8蛋白阳性表达率从浅表性胃炎、胃溃疡、萎缩性胃炎逐渐上升,可能参与胃癌前病变的进展模式,并促进肿瘤细胞形成、转移,值得进一步探讨[11]。如果能对IL-6、IL-8因子的刺激、分泌通路进行干预,将其向抗感染免疫、减轻免疫病理损害方面引导,以减轻细胞因子导致的一系列炎症反应会为治疗提供新的靶点,目前针对H.pylori的基因疫苗已经开始研制,总之,对H.pylori感染后细胞因子的变化及意义进行深入研究,有助于对H.pylori相关胃肠疾病的认识,并可能为该类疾病的诊断、治疗提供新的手段。
[1]Zhu B, Yuan H, Xi HF, et al. Expression of CagA in gastric epithelial tissue and changes of IL-6, IL-8 and CRP levels in tissue culture media in patients with helicobacter pylori infectious gastritis [J]. Chin J Nosocomiol, 2011, 2(2): 236-238. 朱宝, 袁航, 奚惠芳, 等. 幽门螺杆菌感染性胃炎患者胃黏膜组织中CagA表达与其培养液中IL-6、IL-8及CRP水平的变化 [J].中华医院感染学杂志, 2011, 2(2): 236-238.
[2]Zhuang Y, Shi Y, Liu XF, et al. Helicobacter pylori-infected macro phages induce Th17 cell differentiation [J]. Immunobiology, 2011, 216 (1-2): 200-207.
[3]Gao TX, Xi ZM, Liu ZZ. Effects of Helicobacter pylori infection in serum inflammatory factors in coronary heart disease [J].Chin J Nosocomiol, 2012, 22(6): 1207-1209. 高廷孝, 席作明, 刘忠志. 幽门螺杆菌感染对冠心病患者血浆炎症因子的影响 [J]. 中华医院感染学杂志, 2012, 22(6): 1207-1209.
[4]Schneller J, Gupta R, Mustafa J, et al. Helicobacter pylori infection is associated with a high incidence of intestinal metaliasia in the gastric mucosa of patients at inner-city hospitals in New York [J]. Dig Dis Sci, 2006, 51(10): 1801-1809.
[5]Rad R, Dossumbekova A, Neu B, et al. Cytokine gene polymorphisms influence mucosal cytokine expression, gastric inflammation, and host specific colonization during Helicobacter pylori infection [J]. Gut, 2004, 53(8): 1082-1089.
[6]Romero-Adrián TB, Leal-Motiel J, Monsalve-Castillo F, et al. Helicobacter pylori: bacterial factors and the role of cytokines in the immune response [J]. Curr Mircrobiol, 2010, 60(2): 143-155.
[7]Rhead JL, Letley DP, Mohammadi M, et al. A new Helicobacter pylori vacuolating cytotixin determinant, the intermediate region, is associated with gastric cancer [J]. Gastroenterology, 2007, 133(3): 926-936.
[8]Yamaoka Y, Kita M, Kodama T, et al. Helicobacter pylori cagA gene and expression of cytokine messenger RNA in gastric mucosal [J]. Gastroenterology, 1996, 110(6): 1744-1752.
[9]Lai CH, Wang HJ, Chang YC, et al. Helicobacter pylori Cag A-mediated IL-8 induction in gastric epithelial cells is cholesterol-dependent and requires the C-terminal tyrosine phosphorylation-containing domain [J]. FEMS Microbiol Lett, 2011, 323(2): 155-163.
[10]Tong MH, Sun CG, He SP. Study on the levels of IL-8 and TNFα in serum of patients with Helicobacter pylori infection and its clinical significance [J]. Laboratory Medicine, 2004, 19(2): 106-108. 童明宏, 孙晨光,贺士平. 幽门螺杆菌感染患者血清IL-8和TNFα的水平变化及临床意义探讨 [J]. 检验医学, 2004, 19(2): 106-108.
[11]Fu H, Wang XG, Fu WN, et al. Expression of gene interleukin-8 in Helicobacter pylori-related gastric diseases [J]. Journal of China Medical University, 2009, 38(1): 26-27. 付浩, 王旭光, 富伟能, 等. IL-8基因在幽门螺杆菌相关性胃疾病中的表达[J]. 中国医科大学学报, 2009, 38(1): 26-27.
(责任编辑:李健)
The study of the relationship between Helicobacter pylori CagA and VacA genotype and IL-6, IL-8
GUO Hao1, QI Yanli2, ZHANG Shitong1, LI Hui1, JIN Jianjun1
1.Department of Gastroenterology, the First Affiliated Hospital, and College of Clinical Medicine of He’nan University of Science and Technology, Luoyang 471003; 2. Department of Gastroenterology, Yiyang County Poeple’s Hospital, China
Objective To observe the pathogenesis of Helicobacter pylori (H.pylori), and the relationship between different genotypes ofH.pyloriand IL-6, IL-8.Methods Ninety one patients serum who detected theH.pyloripositive through 14 carbon urea breath tests were collected, the qualitative analysis of CagA, VacA and the quantitative analysis of IL-6, IL-8 were made by enzyme linked immunosorbent assay(ELISA).Results There was statistical significance in the contents of IL-6, IL-8 in CagA(+) and CagA(-) (t=6.55,t=7.348,P<0.001). There was statistical significance in the contents of IL-6, IL-8 in VacA(+) and VacA(-) (t=6.418,t=6.977,P<0.001). There was statistical significance in the contents of IL-6, IL-8 in both CagA, VacA positive and both CagA, VacA negative(t=6.438,t=7.231,P<0.001). The contents of IL-6, IL-8 in serum of CagA positive patients were positively correlated (r=0.672,P<0.01). The contents of IL-6, IL-8 in serum of VacA positive patients were positively correlated (r=0.664,P<0.01).Conclusion There was close relationship between genotypes of CagA, VacA and IL-6, IL-8. IL-6, IL-8 play important roles in the pathogenic mechanism ofH.pylori.
Helicobacter pylori; Cytotoxin-associated gene A; Vacuolating cytotoxin A; Interleukin-6; Interleukin-8
郭皓,在读硕士研究生,研究方向:消化系统疾病的诊治。E-mail:xinxianggh@126.com
金建军,硕士研究生,教授,研究方向:消化系统疾病的诊治。E-mail:jjj0379@163.com
10.3969/j.issn.1006-5709.2016.03.011
R573
A
1006-5709(2016)03-0279-04
2015-05-16

